Гидроксибром(хлор)ированием зкзо- и эндо-алкилбицикло [2.2.1]гепт-2-енов в системе HHlg-H2O2 (или NaOCl) получена смесь двух изомеровпри присоединении электрофильного реагента (HOHlg). Соотношение между этими изомерами зависит от пространственной ориентации в исходном углеводороде. Найдено, что хемо- и региоселективнось реакции превращения экзо- и эндо-5-метил- и 5-этенилбицикло- [2.2.1]гепт-2-енов в условиях окислительного превращения галогенводородных кислот определяются не только природой генерирующего электрофильного интермедиата, но и конформацией расположения структурных фрагментов в исходноймолекуле углеводорода. В случае экзорасположения заместителей в продуктах реакции преобладают изомеры 6-метил-, 6-этенил-3-бром(хлор)бицикло [2.2.1]гепт-2-олы, а в случае эндорасположения: 5-метил-, 5-этенил-3-бром-(хлор)бицикло [2.2.1]гепт-2-олы. Использование растворителя низкой полярности (диоксан-1.4, тетрагидрофуран) гидроксибром-(хлор)ирования эндо- и экзо- 5-этенилбицикло [2.2.1]гепт-2-енов в реакции участвуют исключительно по двойной связи норборненового фрагмента. Различие в электроакцепторных свойствах метил- и винильной групп не позволяет объяснить такую ориентацию, кроме как электронным эффектом заместителя. Вероятно, также присутствует влияние различных сольватных эффектов смешанных систем растворителей и конформационная направленность взаимодействия активированных реагентов в переходном состоянии, что обуславливают преимущественное образование этих изомеров. Установлено, что в присутствии бинарной смеси Н2О-СН3СООН,Н2О-О(СН2СН2)2О и Н2О-(-СН)4О растворителей влияние алкильных и алкенильных заместителей в эндорасположении по сравнению с экзорасположением отличается. В частности, изомер 6-этенил-3-бром(хлор)бицикло [2.2.1]гепт-2-ола практически не образуется.
Ключевые слова: гидроксибром(хлор)ирования, алкилбицикло [2.2.1]гепт-2-ены, гидрксихлор(бром)иды, эндо- и экзо- изомерии, N-замещенные алкилбицикло- [2.2.1]-гептан-2-олы.
Введение
Бицикло [2.2.1]гепт-2-ен и его производные являются удобными субстратами для изучения механизма реакции присоединения электрофильных интермедиатов по кратной связи С=С [1, 2].
Исследование стереохимии механизма и условия галогенирования бицикло- [2.2.1]гепт-2-енов с различными галогенами изучено достаточно подробно [2, 3]. Электронодонорные (СН3 и др.) заместители в голове моста (у С7 углеродного атома) бицикло [2.2.1]гепт-2-енов практически не оказывают влияния на направление присоединения электрофильных интермедиатов [1], тогда как электроноакцепторные заместители (COOR, COOH, CN) существенно повышают стереоселективность реакции [4]. Исходя из соотношений продуктов присоединения к кратной связи бицикло- [2.2.1]гепт-2-енов в различных условиях можно судить об особенностях реакции, как ее электрофильного или радикального характера, так и ориентирующей способности заместителей.
С целью синтеза N-замещенных алкилбицикло [2.2.1]гептанолов, через стадии получения гидроксигалогенидов в настоящей работе изучено окислительное гидроксигалогенирование экзо- и эндо-5-метил- (I) и экзо- и эндо-5-этенилбицикло- [2.2.1]гепт-2-енов (II) для выявления ориентирующей способности алкильного и алкенильного заместителя на характер двойной связи. Взаимодействием полученных гидроксигалогенидов с вторичными циклическими аминами в щелочной среде были синтезированы соответствующие N-замещенные алкилбицикло [2.2.1]гептанолы.
Экспериментальная часть
В работе использовали вторичные амины, Н2О2, HCl и HBr фирмы “Alfa Aesar” (A. Johonson Maltey Co.). NaOCl с активным хлором 110 г-ион/л. Исходные бицикло [2.2.1]-гепт-2-ены получены [4+2]- присоединением циклопентадиена (в условиях мономеризации димера циклопентадиена) с С2-С4 олефинами в присутствии катализатора Н-форм клинопитилолита (SiO2/ Al2O3=5:4) или морденита (SiO2/Al2O3=10) по известной методике [13]. Для уточнения физических параметров исходных непредельных углеводородов они были синтезированы и другими методами. 5-метилбицикло [2.2.1]гепт-2-ен(I) получен конденсацией циклопентадиена и бромистого аллила с последующим восстановлением бромида цинка в этаноле. Отношение эндо-/ экзо- изомеров составляет 90:10, Ткип.116–117℃ (740 мм. Hg), ![]() 1.4598. 5-этенилбицикло [2.2.1]гепт-2-ен(II) отношение эндо/экзо- изомеров 65:35, Ткип.64.5–65.5℃ (4.5 мм. Hg)
1.4598. 5-этенилбицикло [2.2.1]гепт-2-ен(II) отношение эндо/экзо- изомеров 65:35, Ткип.64.5–65.5℃ (4.5 мм. Hg) ![]() 1.0224,
1.0224, ![]() 1.4875 выделен перегонкой технического продукта на колонке эффективности 25 т.т. Алкил- и алкенилбицикло [2.2.1]гепт-2-ены (по данным ГЖХ анализа) получаются в виде трудноразделяемой смеси экзо- и эндоизомеров.
1.4875 выделен перегонкой технического продукта на колонке эффективности 25 т.т. Алкил- и алкенилбицикло [2.2.1]гепт-2-ены (по данным ГЖХ анализа) получаются в виде трудноразделяемой смеси экзо- и эндоизомеров.
ИК спектры снимали на ИК Фурье- спектрометре Alpha в диапазоне 400–4000 см-1 в таблетках с КBr. Спектры ЯМР 1Н и 13С снимали на спектрометре Bruker Bio-spin AG при рабочей частоте 300.18 МГц в CDCl3. Элементный анализ проводили на анализаторе TruSpes Micro Leco Corporation USA.
Определение состава, строения продуктов реакции и их идентификацию проводили методами ГЖХ, ЯМР 1Н и 13С спектроскопии и определением элементного состава. Анализ спектров и последующее структурное отнесение как бром(хлор)- (1a,b-4a,b) алкилбицикло [2.2.1]гептан-2-олов так и N-замещенных алкилбицикло [2.2.1]гептан-2-олов (5–8) сделаны на основании данных по влиянию заместителей на химические сдвиги ядер, по константам спин-спинового взаимодействия 1Н-1Н и 1Н-13С, а также с использованием двумерной корреляционной спектроскопии 1Н-1Н и 1Н-13С (COSY) [8]. Полученные данные представлены в соответствующих таблицах (табл. 1, 2).
Общая методика проведения реакции гидроксихлор(бром)ирования бицикло [2.2.1] гепт-2-ена и его производных.
Гидроксихлор(бром)ирование алкилбицикло [2.2.1]гепт-2-енов проводили по разработанной нами методике [14]. В колбу при заданной температуре загружали 0.15–0.2 моль 8–15 %- ного раствора HCl или НBr и 0.1 моль соединения (1 a-c). Из капельной воронки при интенсивном перемешивании реакционной массы (200–250 об /мин) вводили 0.2–0.25 моль 26–30 %-ного водного раствора пероксида водорода (скорость подачи 10г/ч) или 124.2 г 18.5 %- ного раствора гипохлорита натрия (содержание активного хлора 110 г-ион.л-1, скорость подачи 25г.ч-1). Перемешивание продолжали еще 5–6 ч. Реакция завершалась при полном расходовании окислителя (контроль перманганотометрическим и йодометрическим методами [15]). После окончания реакции органический слой отделяли. Водный слой экстрагировали диэтиловым эфиром (или толуолом) (2×100 мл). Экстракт объединяли с органическим слоем, нейтрализовали 10 %-ным раствором К2CO3, сушили МgSO4, отгоняли растворитель, остаток перегоняли в вакууме и выделяли продукты реакции.
Общая методика получения N-замещанных алкилбициклогептан-2-олов из хлор-(бром)гидрокси производных алкилбицикло [2.2.1]гептан-2-ена.
N-замещенные алкилбицикло [2.2.1]гептанолы получали также по ранее разработанной методике [5.6]. К смеси выделенного из катализата 14.7 г (0.1 моль) соединения 2a или 19.1 г 3a добавляли 3.0 г КОН и 50–100 мл пропан-2-ола (или этанола). Смесь нагревали в течение 1–1.5 часов при температуре 30–60°С и при перемешивании по каплям в течение 0.5–1.0 часа добавляли 0.2–0.25 моль вторичного амина. Реакцию заканчивали в течение 3–6 часов, до полного расхода хлор(бром)гидроксигалогенидов (контроль ГЖХ-методом). После отгонки растворителя и охлаждения реакционной массы получали целевые продукты.
ГЖХ-анализы проводили на хроматографе “Цвет-500”, на колонке 100×0.3 см заполненной неподвижной фазой Chromaton N—AW-DMCS, пропитанной 5 %-ным ХЕ-60, при температуре колонки 140℃, скорость газа носителя (гелия) 40 мл/мин. В некоторых опытах наблюдение за ходом реакции и выделение продуктов из реакционной массы осуществляли методом ТСХ на пластинах “Silufol” (элюент – смесь этилацетат-гептан, 1:10).
3-Хлор-6(5)-экзо(эндо)-метилбицикло [2.2.1]гептан-2-ол (1a, 3a), получали из 5.4 г (50 ммоль) 5- метилбицикло [2.2.1]гепт-2-ена. Выход 6.1 г (77 %), Ткип. 55–57°С (2.5 мм. Hg.), соотношение эндо:экзо=20:80. Найдено, %:С 58.36; Н 7.88; Cl 21.68. C8H13ClO. Вычислено, %: С 59.81; Н 8.09; Cl 22.12.
3-Бром-6(5)-экзо(эндо)- метилбицикло [2.2.1]гептан-2-ол (1b, 3b), получали из 5.4 г (50 ммоль) 5- метилбицикло [2.2.1]гепт-2-ена. Выход 7.2 г (70 %), Ткип. 95–97°С (2.5 мм. Hg.), соотношение эндо:экзо=20:80. Найдено, %: С 45.89; Н 6.01; Br 38.45. C8H13BrO. Вычислено, %: С 46.83; Н 6.01; Br 39.02.
3-хлор-6(5)-этенилбицикло [2.2.1]гептан-2-ол (2а,4а) получали из 6.0 г (50 ммоль) 5- этенилбицикло [2.2.1]гепт-2-ена. Выход 6.3 г (73 %), Ткип. 80–82°С (2.5 mm. Hg st.), соотношение эндо:экзо=65:35. Найдено, %: С 62.25; Н 7.15; Cl 20.12.С9Н13 Cl О. Вычислено, %: С 62.61; Н 7.54; Cl 20.58.
3-бром-6(5)-этенилбицикло [2.2.1]гептан-2-ол (2b,4b) получали из 6.0 г (50 ммоль) соединения 5-этенилбицикло [2.2.1]гепт-2-ена. Выход 7.11 г (65.5 %), Ткип. 117–118°С (2.5. Hg.), соотношение эндо:экзо=65:35. Найдено, %: С 49.48; Н6.15; Br 36.27. С9Н13BrО. Вычислено, %: С 49.77; Н 5.99; Br 36.87.
6(5)-Метил-3-(пиперидин-1-ил)бицикло [2.2.1]гептан-2-ол (5), получали из 4.82 г (30 ммоль) смеси изомеров соединения (1а,3а) или 6.15 г (30 ммоль) смеси изомеров соединения (1b,3b) и 5.1 г (60 ммоль) пиперидина. Выход из соединения (1а и 3а) 4.0 г (63.8 %), из соединения (1b и 3b) 4.5 г (71.8 %,), Тпл. 85–87°С. Найдено, %: С 75.25; Н 11.29; N 6.75. C13H23NO. Вычислено, %: С 74,64; Н 11.0; N 6.69.
6(5)-метил-3-(морфолин-4-ил)бицикло [2.2.1]гептан-2-ол (6) получа-ли из 4.82 г (30 ммоль) смеси изомеров соединения (1а, 3а) или 6.15 г (30 ммоль) (1b, 3b) и 4.8 г (60 ммоль) морфолина. Выход из соединения (1a и 3а) 4.14 г (65,4 %), из соединения (1b, 3b) 4,67 г (73,8 %), Тпл. 103–105°С. Найдено, %: С 67.85; Н 10.26; N 6.83. С12Н21NО2. Вычислено, %: С 68.25; Н 9.95; N 6.64.
6(5)-Этенил-3-(пиперидин-1-ил)бицикло [2.2.1]гептан-2-ол(7), по-лучали аналогично примеру (6) 4.27 г (30 ммоль) смеси изомеров из соедиения (2а, 4а) или 6.51 г (30 ммоль) соединения (2b,4b) и 5.1 г (60 ммоль) пиперидина. Выход из соедиения (2а, 4а) Выход 4.21 г из соединения (2а, 4а) (63.0 %), 4.5 г из соединения (2b, 4b) (67.9 %,), Т.пл. 98–101°С. Найдено, %: С 75.87; Н 10.25; N 6.41. С14Н23NО. Вычислено, %: С 76.02; Н 10.40; N 6.33.
6(5)-Этенил-3-(морфолин-4-ил)бицикло [2.2.1]гептан-2-ол (8), полу-чали аналогично примеру (7) из 4.27 г (30 ммоль) смеси изомеров соединения (2а, 4а) или 6.51 г (30 ммоль) соединения (2b, 4b) и 5.2 г (60 ммоль) морфолина. Выход 4.58 г из соединения (2а, 4а) (68.5 %), 4.96 г из соединения (2b, 4b) (74.8 %,), Тпл.. 114–116.5°С. Найдено, %: С 69.79; Н 8.89; N 6.16. C13H21NO2. Вычислено, %: С 69.96; Н 9.42; N 6.3.
Обсуждение результатов
При окислительном гидроксибром(хлор)ировании эндо-, экзо-5-метил бицикло [2.2.1]гепт-2-енов(I) и эндо-, экзо-5-этенилбицикло [2.2.1]гепт-2-енов (II) в основном образуется смесь двух изомеров 5- и 6-метил(этенил)-3-бром(хлор) бицикло [2.2.1]гептан-2-олов, соотношение между которыми зависит от ориентации СН3- и СН2=СН- заместителей в исходном углеводороде.
Процесс синтеза N-замещенных алкил(алкенил)бицикло [2.2.1]гепт-2-енов осуществляли через стадии получения гидроксхлорид 1(a,b) и гидроксибромид 2(a,b) производных этих циклоолефинов по схеме(схема 1):
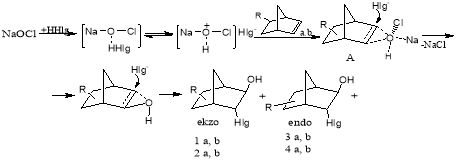
Схема 1
Где: X=Cl (1); Br (2); R=5-CH3 (a); 5-CH=CH2 (b)
Из предложенной схемы реакции видно, что использование окислителя NaOCl (или H2O2) в режиме in situ, в реакционной зоне создает благоприятные условия для генерирования и поляризации связей в переходном комплексе (А), приводящей к образованию активного оксигалогенидного HO--Hlg+ (Hlg=Cl, Br) интермедиата. Электрофильный ион Hlg+ быстро присоединяется к кратной связи субстрата, образуя карбокатион стабилизирующимся нуклеофилом-гидроксианионом, отщепляющимся от интермедиата.
В отсутствие гипохлорита натрия (или пероксида водорода) гидроксигалогенирование циклоолефинов не происходит, т. к. исходный НHlg без участии последних не может генерировать в водном растворе активный гидроксигалогенидный интермедиат.
На основании данных работы [9] и спектральных характеристик синтезированных продуктов реакций, отвечающих нормальной поляризации связи HO-Hlg, мы полагали, что их конфирмация также должна определяться следующими известными факторами [3]:
1) электрофил атакует кратную связь бицикло [2.2.1]гепт-2-енов с экзо- стороны;
2) в результате перегруппировки Вагнера-Мейервейна электрофил и нуклеофил могут занимать положение 7;
3) перегруппированный катион (в комплексе А, схема 1) атакуется нуклеофилам с эндо- стороны [9].
Согласно этому атом брома (или хлора) в продуктах 1 (а, b) и 2 (а, b) должен находиться в экзо- ориентации, а нуклеофильный гидроксил в эндо- ориентации в положении 7 по отношении СН3 или –СН=СН2 группы.
По данным ГЖХ анализа в продуктах реакции окислительного гидроксигалогенирования экзо-5-метил- (I) и экзо-5-этенилбициклогептенов (II) образуется смесь 5- и 6-метил(етенил)-3-хлор(бром)бициклогептан-2-олов. В случае исходного экзо- (I) и экзо- (II) наблюдалось некоторое преобладание 6-метил(этенил)бицикло [2.2.1]гептан-2-олов (IV, VI) (схема 2):
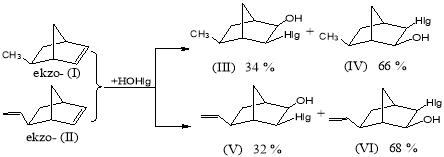
Схема 2
В случае же эндо- изомеров (I и II) была получена смесь двух изомеров присоединения электрофильных интермедиатов с преобладанием изомеров (VII) и (IX) (схема 3):
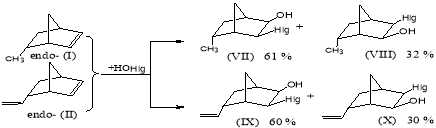
Схема 3
Следует отметить, что при наличии в молекуле двух двойных связей активность их в изучаемой реакции может быть иной, чем в соответствующих аналогах с одной кратной связью [10].
Углеводород (II) содержит в молекуле две двойные связи, этиленовую, сходную со связью в 3-метил-1-бутене и норборненовую, поэтому представляет интерес исследовать влияние растворителей с различной полярностью (ɛ) на направление накопления изомеров состава продуктов реакции и ориентации заместителей. Оказалось, что в присутствии СН3СООН или 1.4-диоксана, реакция протекала с участием только двойной связи бициклогептенового фрагмента, причем направление присоединения активного поляризованного интермедиата [Hlg+ — ОH-] зависит от положении этиленовой группы (схема 4):
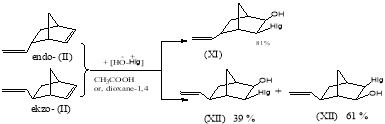
Схема 4
Как видно из схемы 4 при использовании СН3СООН или 1.4-диоксана-(растворителей с низкой диссоцирующей способностью) в реакции участвует только норборненовая двойная связь, и ориентирующее влияние этиленовой двойной связи для эндо- расположенного изомера (II) выражено значительно сильнее, чем экзо-расположенного изомера (II). В продуктах реакции 6-этенил-3-хлор(бром)бицикло [2.2.1]гептан-2-ола вовсе не образуется.
В случае реакции 4-этенилциклогекс-1-ена [11], близкого по своему строению к углеводороду (II), реакция с участием водно тетрагидрофурановой смеси протекает также по более активной этиленовой двойной связи, хотя основным продуктом реакции является соответствующий диол. Если же углеводород содержит в молекуле бицикло- [2.2.1]гепт-2-еновую и циклопентеновую двойные связи, то, как показали авторы [12] на примере трицикло [5.2.1.02.6]циклододец-3.8-диена, независимо от использованного растворителя, реакция протекает преимущественно по бицикло [2.2.1]гептеновой двойной связи.
Различие в электроноакцепторных свойствах метил- и винильной групп не позволяет объяснить такую ориентацию (схема 4) только электронным влиянием заместителей, тем более, что углеводороды эндо- (II) и экзо- (II) склонны к предпочтительному образованию 2,3,5- и 2,3,6-три замещенных бициклогептанов. Возможно также влияние сольватного эффекта смешанных растворителей. Конформационная направленность взаимодействия активных форм компонентов реакции в переходном состоянии обусловливает преимущественное образование этих изомеров. Полученные результаты показывают, что выход и изомерный состав продуктов реакции при использовании воды (растворитель с высокой диэлектрической проницаемостью) и смешанных растворителей Н2О-СН3СООН, Н2О-О(СН2СН2)2О и Н2О- тетрагидрофуран, реакция протекает преимущественно с образованием эндо-изомера. Это свидетельствует о том, что растворитель влияет на относительную реакционную способность и не оказывает никакого влияния на взаимное положение присоединяющихся ОН, Br(Cl) групп, и они почти всегда занимают конформационно выгодное экзо- положение.
На основе полученных хлор(бром)бицикло [2.2.1]гептанолов (1a,b-4a,b) были синтезированы N-замещенные алкилбицикло [2.2.1]гептан-2-олы (5–8) по схеме (схема 5):
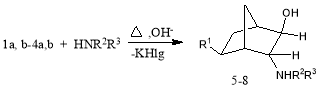
Схема 5
R1=CH3 (5,6), CH2=CH (7,8); R2,R3=(-CH2-)5 (5,7), (-CH2CH2)2O (6,8).
Выход и спектральные характеристики полученных N-замещенных алкилбицикло- [2.2.1]гептан-2-олов приведены в экспериментальной части. Необходимо отметить, что выход и изомерный состав продуктов реакции существенно зависят от изменения температурного режима. Повышение ее более 650С нецелесообразно, так как при этом реакция протекает с образованием 5–8 % продуктов перегруппировки Вагнера-Меервейна.
Из приведенных данных табл. 1 видно, что атомы Cl, Br, а также гидроксильная и винильная группа при атомах С (2), С (3) и С (5) оказывают практически одинаковое влияние на экранирование протонов Н (2), Н (3), Н (5) и мостиковых протонов Н (7). Химические сдвиги anti- и syn- мостиковых протонов [Н (7)anti и Н (7)syn] также значительно отличаются (примерно на 0.4 м.д). Протон Н (7)анти испытывает парамагнитное влияние близко расположенного к нему экзо-атома галогена при атоме С (3) и гидроксильной группе при атоме С (2). Влияние заместителей на экранирование узловых протонов Н (1) и Н (4) незначительно (~0,25 м.д.). В то же время значительное пространственное взаимодействие эндо-заместителей (СН3- и –СН=СН2) приводит к сильному дезэкранированию разделенного четырьмя связями эндо-протонов [Н (6) эндо] в соединении I и II, и его сигнал лежит в заметно более слабом поле (примерно на 0.4–0.5 м.д) по сравнению с соответствующими экзо-протонами. Региоселективность присоединения галогена и гидроксильной группы доказывается при сопоставлении химических сдвигов 1Н и 13С групп С(2)Н(2)Х и С(2)Н(2)Y (X=Cl или Br, Y=(OH), определенных при использовании методов H-C-COSY и селективного двойного резонанса и 13С-{1Н } [8].
Значения химических сдвигов 13С для продуктов 1 и 2, а также 3 и 4 (a, b) (табл. 2) хорошо согласуются с теоретическими представлениями. Парные взаимодействия 3 (Cl и Br) и 2 (-ОН) производных в соединениях 1÷4 (a, b) на экранирование являются существенными, особенно для атомов углерода, связанных с атомами галогена (Cl и Br).
Tаблица 1
Химические сдвиги ядер 1Н (м.д.) иКССВ 1Н-1Н (Гц) вхлор(бром)бицикло [2.2.1]гептанолах (CDCl3)
|
№ Cоед |
Н (1) |
Н (2) |
Н (3) |
Н (4) |
Н (5) |
Н (6) |
Н (7) |
Н (8) |
Н (9) |
Н (10) |
|
1a |
2.048 J1.2 exo=6.8 |
3.49 J2.3=7.3 |
3.52 J3.7 anti=7.0 |
1.77 J4.5 endo=6.6 J4.7 syn=7.0 |
1.63 J5.6 endo=6.6 J5.4 endo=7.0 |
endo:1.53 exo:1.28 |
syn:2.15 anti:1.89 J5 endo,7=7.0 J7.7 =-10.2 |
0.98 J8.5 =6.9 |
3.60 H (-OH) | |
|
1b |
2.051 J1.2 exo=7.0 |
3.59 J2.4 exo=7.1 |
3.46 J3.6 endo=7.0 |
1.87 J4.5 endo =J4.7 syn=7.2 |
1.65 J5.6 endo= 7.3 J5.8 endo =6.9 |
endo:1.52 exo:1.26 |
syn:2.14 anti:1.90 |
0.97 J8.5 =6.9 |
3.60 H (-OH) | |
|
2a |
2.04 J1.2 exo=7.1 J6 endo,1=-12.5 |
3.48 J2.3 endo=7.2 |
3.50 J3.4 endo=7.1 |
1.79 J4.5 endo=7.2 |
2.13 J5.6 endo=7.1 J5.8 endo=6.3 |
endo:1.51 exo:1.26 |
syn:2.15 anti:1.89 J5 endo,7=7.1 J7.7 =-10.3 |
5.82 J8.9 =10.2 J8.1 =6.9 J8.5 =6.3 |
4.98 J10.8 =16.8 J10.9 =2.1 J10.5 =-1.0 |
4.92 J9.8 =10.3 J9.1 =2.1 J9.5 =1.0 |
|
2b |
2.05 J1.2 exo=7.0 J6 endo,1=-12.4 |
3.58 J2.4 exo=7.1 |
3.48 J3.6 endo=7.0 |
2.06 J4.5 endo= =J4.7 syn=7.2 |
2.14 J5.6 endo=7.1 J5.8 endo=6.2 |
endo:1.54 exo:1.27 |
syn:2.15 anti:1.91 |
5.82 J8.9 =10.2 J8.1 =6.9 J8.5 =6.3 |
4.98 J10.8 =16.8 J10.9 =2.1 J10.5 =-1.0 |
4.92 J9.8 =10.3 J9.1 =2.1 J9.5 =1.0 |
|
3a |
2.03 J1.2 exo=7.0 |
3.49 J2.3=7.2 |
3.51 J3.7 anti=7.0 |
1.76 J4.5 endo=7.1 J4.7 syn=7.0 |
1.62 J5.6 endo=6.8 J5.4 endo=7.0 |
endo:1.51 exo:1.26 |
syn:2.15 anti:1.89 J5 endo,7=7.0 J7.7 =-10.2 |
0.98 J8.5 =6.9 |
3.60 H (-OH) | |
|
3b |
2.04 J1.2 exo=7.0 J6 endo,1=-12.5 |
3.58 J2.4 exo=7.1 |
3.48 J3.6 endo=7.1 |
1.86 J4.5 endo= =J4.7 syn=7.1 |
1.64 J5.6 endo=7.2 J5.8 endo=6.8 |
endo:1.53 exo:1.27 |
syn:2.14 anti:1.89 |
J8.5 =6.9 |
3.60 H (-OH) | |
|
4a |
2.04 J1.2 exo=7.0 J6 endo,1=-12.3 |
3.49 J2.3 endo=7.2 |
3.51 J3.7 anti=7.0 |
1.81 J4.5 endo=7.2 |
2.12 J5.6 endo=7.1 J5.8 endo=6.2 |
endo:1.54 exo:1.28 |
syn:2.15 anti:1.89 |
5.82 J8.9 =10.2 J8.1 =6.9 J8.5 =6.3 |
4.99 J10.8 =16.9 J10.9 =2.1 J10.5 =-1.0 |
4.94 J9.8 =10.3 J9.1 =2.1 J9.5 =1.0 |
|
4b |
2.038 J1.2 exo=7.1 J6 endo,1=-12.4 |
3.58 J2.3 endo=7.2 |
3.47 J3.6 endo=7.1 |
2.86 J4.5 endo=7.2 |
2.14 J5.6 endo=7.1 J5.8 endo=6.2 |
endo:1.54 exo:1.28 |
syn:2.15 anti:1.89 |
5.82 J8.9 =10.2 J8.1 =6.9 J8.5 =6.3 |
5.01 J10.8 =16.8 J10.9 =2.1 J10.5 =-1.0 |
4.95 J9.8 =10.3 J9.1 =2.1 J9.5 =1.0 |
Tаблица 2
Химические сдвиги 13С (м.д.) хлор(бром)бицик-ло [2.2.1]гептанолов (CDCl3)
|
Cоединение |
С (1) |
С (2) |
С (3) |
С (4) |
С (5) |
С (6) |
С (7) |
С (8) |
С (9) |
|
1a 1b 2a 2b 3a 3b 4a 4b |
38.6 40.0 39.0 40.2 38.6 39.8 38.9 40.3 |
77.8 78.9 78.0 79.0 77.8 79.0 77.8 80.0 |
67.0 59.8 67.5 60.2 66.9 59.7 67.2 60.0 |
52.0 51.7 37.6 38.3 52.0 51.6 32.4 38.5 |
31.7 33.0 36.3 37.4 31.5 33.0 31.5 37.6 |
31.4 31.0 31.4 31.2 31.2 31.0 28.9 31.3 |
28.6 30.0 29.0 30.0 28.6 29.8 28.9 30.0 |
18.0 18.0 142 142 17.8 17.6 141.8 142 |
115 114.6 115 114.8 |
Выводы
- Исследована реакция гидроксигалогенирования экзо- и эндо-5-метил-, 5-этенилбицикло [2.2.1]гептан-2-енов при температуре 20–50ºС с использованием пероксида водорода и галогеноводородных кислот. Установлено, что в системе HHlg+окислитель генерируется электрофильный HОHlg и в режиме “in situ” присоединяется к двойной связи субстрата.
- Установлено, что ориентация электрофильного интермедиата контролируется не только влиянием электрона заместителя, но и сольватным эффектом смещанных систем растворителей, а также конформационной направленностью взаимодействия в активированных компонентах переходного состояния, что обуславливает преимущественное образование изомерных продуктов реакции.
- Установлено, что в экзоизомерах продуктов как гидроксигалогенирования, так и аманолиза преобладают 5-метил-, 5-этенил-3-хлор(бром)бицикло [2.2.1]гептан-2-олы и 5-метил-, 5-этенил-3-аминобицикло [2.2.1]гептан-2-олы, а в случае эндоизомеров 6-метил- и 6-этенил производные.
Литература:
- Смит В. А. Новое в реакциях электрофильного присоединения по двойной связи. ВХО им.Д. И. Менделеева.1977, т.22, с.300–314
- Зык Н. В., Белоглазкина Е. К., Тюрин В. С., Гришин Ю. К. Изв. А. Н. Сер. Хим., 1997, №, с.517 [Russ. Chem. Bull., 1997, 46, p.4961 (Engl. Transl.)]
- Зык Н. В., Белоглазкина Е. К., Тюрин В. С., Гришин Ю. К. Регио и стереохимические аспекты бромхлорирования норборнена. Изв. А. Н. Сер. Хим., 1998, № 11, с. 2290–2295
- Faktor A., Taylor T. G. Oxymercuration of strained olefins. Effect of neighboring groups, J. Org. Chem.1968, Vol.33, Issue 7, p.p.2607–2614
- Садыгов О. А., Алимарданов Х. М., Исмаилова Ш. И. Индуктивное гидроксигалогенирование бицикло [2.2.1]гептенов и синтез аминоспиртов на основе продуктов реакции, ЖОХ, 2018, Т.88, Вып.5, с.717–723. Sadygov O. A., Alimardanov Kh.M., and Ismailova Sh.I. [Russ. J. Gen. Chem., 2018, Vol.88, No. 5, pp.862–868. doi 10.1134/S1070363218050031
- Алимарданов Х. М., Садыгов О. А., Бабаев Н. Р., Исмаилова Ш. И., Султанова С. А. N-замещенные аминометоксибицикло [2.2.1]гептенолы и их антимикробная активность в смазочноохлождающих жидкостях и маслах, ЖОрХ, 2018, Т.54, Вып.3, с.1–11
- О. А. Sadygov, Kh.М. Alimardanov, Sh.I. Ismayilova Synthesis of aminoalcohols based on hydroxyhalogen derivatives of bicycloheptene and aliphatic amines, The journal “Processes of Petrochemistry and oil Refining” (PPOR), Vol. 19, No. 3, 2018, pp.265–273
- Дероум А. Э. Современны методы ЯМР для химических исследований, М.: Мир, 1982, 403 с. [A. E. Derome, Modern NMR Techniques for Chemistry Research, Perqamon Press, Oxford, 1997]
- Zefirov N. S., Sadovaya N. K., Novgorotseva L. A., Achmedova R.Sh., Baranov S. V. and Badrikov I. V. New method for increasing of effective electrophilicity of weak electrophiles in addi-tion reactions. Rearrangements and cis-addition in reactions of sulphenyl chlorides with norbornene and dimethoxybenzonorbornadiene, Tetrahedron, 1979, Vol. 35, Issue 23, pp. 2759–2765
- Takaishi N., Fujikura V., Inamoto Y. Oxymercuration-demercuration and hydroboration-oxidation of endo-tricyclo [5.2.2.02,6]undeca-3,8-diene. Stereospecific oxymercuration leading to the 4-exo-hydroxy derivative, J.Org. Chem., 1975, Vol. 40, Issue 25, pp.3767–3772
- Brown H. C., Geoghegan Ph.J., Lynch G. J., Kurek J. T. Solvomercuration-demercuration. IV. Monohydration of representative dienes via oxymercuration-demercuration, J. Org. Chem., 1972, Vol. 37, Issue 12, pp. 1941–1947
- Wilder P., Portis A. R., Wright G. W., Shepherd J.M, Oxymercuration-demercuration and hydroboration-oxidation of endo-dicyclopentadiene (endo-tricyclo [5.2.1.02,6]deca-3,8-diene), J. Org. Chem., 1974, Vol. 39, Issue 12, pp. 1636–1641
- Добросердова И. Б., Анисимов А. Б. Практикум по нефтехимическому синтезу. М.: МГУ, 1981, 109 с.
- Садыгов О. А., Алимарданов Х. М., Аббасов М. Ф. Синтез галогенгидринов 5-алкилбицикло [2.2.1]гептенового ряда с использованием систем индуцирующих электрофильные реагенты, Журнал Общей Химии, 2009, т.79, Вып.8, с.1338–1343; Sadygov O. A., Alimardanov Kh.M., Abbasov M. F. Russ. J. Gen. Chem., 2009, Vol.79, No. 8, p.1668. doi 10.1134/S1070363209080192
- Бабко А. К., Пятницкий И. В. Количественный анализ. М.: ВШ, 1962, 508с.

