Возникший на рубеже 20-го и 21-го столетий термин «зелёная химия» на сегодняшний момент обозначает, с одной стороны, мировоззренческий подход, предполагающий решение всех научно-производственных задач, связанных с применением химии, максимально экологически дружественными средствами. Впервые такой подход был предложен в классической работе Анастаса и Уорнера [1]. Там же были сформулированы 12 принципов «Зеленой химии».
На сегодняшний момент, однако, «зелёная химия» — это не просто мировоззренческий подход, а реально сформировавшееся и очень динамично развивающееся научное направление в химии. Одной из основных областей исследований в этом направлении является поиск альтернативы летучим органическим растворителям для применения в промышленном и лабораторном химическом синтезе. Среди наиболее перспективных соединений, используемых в этом качестве, особое место занимают ионные жидкости.
Целью данной работы заключалась в обобщении имеющегося экспериментального материала по методам синтеза, свойствам и применению ионных жидкостей, содержащих аминогруппу в боковой цепи, а также получении ряда ионных жидкостей с третичной аминогруппой в боковой цепи.
Для достижения этой цели были поставлены следующие задачи:
изучить современные литературные данные по ионным жидкостям с аминогруппами в боковой цепи, их методам синтеза и физико-химическим свойствам;
проанализировать наиболее перспективные направления их применения;
синтезировать ионные жидкости, содержащие третичные аминогруппы в боковой цепи.
В настоящее время проявляется значительный интерес к разработке ионных жидкостей «целевого назначения» (task-specific), в которых катион или анион сообщают соединению специфические свойства, такие, как хиральность или улучшенная экстракционная (разделяющая) способность в отношении каких-либо классов соединений. Обычно дизайн структуры ионных жидкостей для той или иной конкретной задачи основывается на таких характеристиках, как смешиваемость с водой, электропроводность, вязкость, растворяющая способность по отношению к веществам-участникам реакции. В число таких важных параметров ионной жидкости, определяющих многие её свойства, входят и кислотно-основные свойства, которые могут быть обусловлены как природой катиона, так и природой аниона.
Вместе с тем, ряд анионов, способных образовывать с органическими катионами ионные жидкости, можно считать основными. Так, к их числу относятся лактат, формиат, ацетат (и другие карбоксилат-анионы), а также дицианамид-анион. В частности, дицианамидные ионные жидкости стали легкодоступными реагентами, чему способствовала их низкая вязкость, даже для фосфониевых солей. Поскольку основность этих анионов придает ионным жидкостям новые свойства, такие, как иная солюбилизирующая и каталитическая активность, прогнозируется рост интереса к этой категории ионных жидкостей и синтез новых их представителей в ближайшие годы.
Необходимо отметить, что существует альтернативный подход к приданию ионным жидкостям основных свойств. Вместо использования основного аниона можно ввести основный центр в состав катиона. Чаще всего в качестве такого центра выступает третичный атом азота в составе аминогруппы. Такие соединения могут иметь более высокую термическую стабильность по сравнению с ионными жидкостями, содержащими основный анион, которые часто легко претерпевают расщепление по Гофману при повышенных температурах [5, с.1905–1917]. Особенно нестабильны в этом смысле производные пиридиния [6, с. 559–568.].
В настоящем обзоре мы рассмотрим только последнюю группу ионных жидкостей — соединения, содержащие основный заместитель в составе катиона. Как правило, в качестве такого заместителя выступает аминогруппа различной степени замещения.
Синтез хлорида 2-гидрокси-N,N,N-этанаминия(холинхлорида)
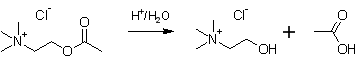
Рис. 1. Синтез холинхлорида
В круглодонной колбе на 1000 см3 смешивают 100 г ацетилхолина, 1 см3 концентрированной соляной кислоты и 200 см3 дистиллированной воды. Смесь кипятят с обратным холодильником в течение 8 часов, периодически отбирая пробы для установления концентрации уксусной кислоты титриметрическим методом. Для этого отбирают 5 см3 раствора, доводят дистиллированной водой в мерной колбе до 100 мл, отбирают аликвоты по 10 см3 и титруют 0,1 М раствором NaOH в присутствии фенолфталеина. После достижения постоянной концентрации уксусной кислоты (о чём свидетельствует прекращение увеличения объёма раствора щёлочи, пошедшего на титрование, по сравнению с предыдущей пробой) раствор упаривают на роторном испарителе до уменьшения объёма примерно в 5 раз, затем охлаждают в кристаллизаторе в смеси соль+снег. Выпавшие кристаллы отфильтровывают под пониженным давлением и сушат в сушильном шкафу при температуре 60˚С. Выход холинхлорида 52 %, температура плавления соответствует литературным данным.
Синтез хлорида 2-хлор-N,N,N-этанаминия
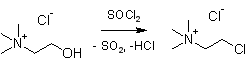
Рис. 2.Синтез хлорида N,N,N-триметил-2-хлорэтанаминия
Весь синтез выполняется под тягой!
В круглодонную трёхгорлую колбу, снабжённую мощным обратным холодильником и капельной воронкой, помещают 200 см3 хлороформа и 0,1 моль ранее полученного холинхлорида. При перемешивании на магнитной мешалке к смеси постепенно добавляют 0,15 моль тионилхлорида. Смесь кипятят с обратным холодильником до тех пор, пока влажная индикаторная бумажка, поднесённая к выходу обратного холодильника, не перестанет окрашиваться в красный цвет, на что требуется около 10 часов. После этого добавляют ещё 0,02 моль тионилхлорида и кипятят ещё 1 час. Растворитель и избыток тионилхлорида отгоняют досуха на ротационном испарителе, остаток кристаллизуют из смеси хлороформ — этилацетат. Выход продукта составляет 47 %. Спектр ПМР: 2.84 (синглет, 9H), 3.95 (триплет, 2H, t, J=6.1 Гц), 3.31 (триплет, 2H, J=6.1 Гц).
Синтез ионных жидкостей, содержащих третичную аминогруппу вбоковой цепи.
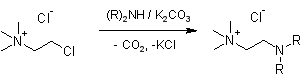
(R)2NH = пирролидин, морфолин, диэтиламин
В коническую колбу, снабжённую обратным холодильником, помещают 0,01 моль хлорида 2-хлор-N,N,N-этанаминия, 0,02 моль амина и 0,011 моль безводного карбоната калия, прибавляют 50 см3 безводного ацетонитрила и перемешивают на магнитной мешалке до прекращения выделения углекислого газа (контроль по счётчику пузырьков), на что требуется от 3 до 6 часов. Реакционную смесь фильтруют, упаривают досуха, остаток экстрагируют 3 раза этилацетатом, после чего высушивают в вакууме водоструйного насоса при 70оС, получая ионные жидкости:
Хлорид N,N,N-триметил-2-(пирролидин-1-ил)этанаминия
Выход 71 %, спектр ПМР: 2.85 (синглет, 9H), 1.73 (мультиплет, 2H), 1.74 (мультиплет, 1H), 1.78 (мультиплет, 1H), 2.96 (триплет, 2H, J=7.4 Гц), 3.01 (мультиплет, 2H), 3.13 (мультиплет, 2H), 3.130 (мультиплет, 1H), 3.26 (триплет, 2H, J=7.4 Гц).
Хлорид N,N,N-триметил-2-(морфолин-4-ил)этанаминия
Выход 68 %, спектр ПМР: 2.45 (мультиплет, 4H), 2.82 (триплет, 2H, J=2.7 Гц), 2.85 (синглет, 9H), 3.26 (триплет, 2H, J=2.7 Гц), 3.60 (мультиплет, 4H).
Хлорид 2-(диэтиламино)-N,N,N-триметилэтанаминия
Выход 63 %, спектр ПМР: 0.960 (триплет, 6H, J=7.2 Гц), 2.68 (квартет, 4H, J=7.2 Гц), 2.85 (синглет, 9H), 2.99 (триплет, 2H, J=7.4 Гц), 3.26 (триплет, 2H, J=7.4 Гц).
Все синтезированные ионные жидкости представляют собой вязкие вещества без запаха, бесцветные или с бледно-желтым оттенком. При растворении в воде дают выраженную щелочную реакцию, термически устойчивы по крайней мере до 120оС. Данные свойства свидетельствуют о том, что они могут использоваться в качестве каталитических сред для реакций, требующих мягкого основного катализа, при температурах, близких к комнатным, или несколько более высоких. Не исключена также возможность применения в качестве компонентов поглотительных смесей для обратимого поглощения газов слабокислотного характера, таких, как диоксид углерода и сероводород.
Ионные жидкости, содержащие функциональные группы в составе катиона либо аниона, привлекают в последние годы большое внимание исследователей как новый класс веществ, обладающими принципиально иными свойствами по сравнению с «классическими» органическими растворителями, имеющими молекулярное строение. Такие их особенности, как чрезвычайно низкая летучесть (а следовательно, низкая пожароопасность и отсутствие угрозы выброса токсичных паров в атмосферу) в сочетании с высокой растворяющей способностью как по отношению к неорганическим, так и по отношению к органическим веществам, полярным характером и высокой диэлектрической проницаемостью, сделали их весьма перспективными растворителями как для лабораторных, так и для мало- и среднемасштабных промышленных синтезов.
Ионные жидкости, содержащие аминогруппы, являются сравнительно мало изученным классом соединений, однако уже привлекли интерес исследователей. Обобщение литературных данных и собственных экспериментальных результатов, приведённых в настоящей работе, позволяет сделать следующие выводы:
Синтез ионных жидкостей с аминогруппами в боковой цепи, как правило, осуществляется по реакциям нуклеофильного замещения. Восстановительные методы получения этих веществ представляют интерес, однако пока не нашли отражения в литературе.
Основными областями применения ионных жидкостей, содержащих аминогруппы, в перспективе могут стать селективная экстракция комплексообразующих металлов, обратимое поглощение углекислого газа, сероводорода и других слабокислотных газов из газовых смесей, а также использование их в качестве каталитических сред в органическом и, возможно, также неорганическом синтезе.
Синтезированные в настоящей работе новые представители ионных жидкостей, содержащие третичную аминогруппу, обладают подходящими характеристиками для их использования в качестве каталитических сред или компонентов таких сред в реакциях при комнатной или несколько более высокой температуре.
Литература:
- Anastas, P. T. Green Chemistry: Theory and Practice / P. T. Anastas, J. C. Warner // Oxford University Press, New York. — 1998. — P.30.
- Ionic Liquids in Synthesis. / Eds. P. Wasserscheid, T. Welton // Wiley-VCH Verlag. — 2002. — 355 pp.
- Асланов, Л. Н. Ионные жидкости в ряду растворителей. / Л. Н. Асланов, М. А. Захаров, Н. Л. Абрамычева. // Москва, изд.-во МГУ. — 2005. — 175 c.
- Вальден П. Молекулярные веса и электропроводность некоторых расплавов солей. / Бюлл. Импер. Акад. Наук. // Санкт-Петербург. — 1914. — С.405–422.
- MacFarlane, D. R. Lewisbaseionicliquids. / D. R. MacFarlane, J. M. Pringle, K. M. Johansson, S. A. Forsyth, M. Forsyth // Chem. Commun. — 2006. — P. 1905–1917.
- Crosthwaite, J. M. Phase transition and decomposition temperatures, heat capacities and viscosities of pyridinium ionic liquids. / J. M. Crosthwaite, M. J. Muldoon1, J. K. Dixon, J. L. Anderson, J. F. Brennecke. // J. Chem. Thermodynamics. — 2005. — Vol. 37. — № 6. — P. 559–568.
- Karthikeyan, P. Development and efficient 1-glycyl-3-methyl imidazolium chloride — copper(II) complex catalyzed highly enantioselective synthesis of 3, 4-dihydropyrimidin-2(1H)-ones / P. Karthikeyan, S. A. Aswar, P. Narayan Muskawar, P. R. Bhagat, S. S. Kumar // Journal of Organometallic Chemistry. — Vol. 723. — 2013. — P. 154–162.
- Chen, L. A one-pot multicomponent reaction for the synthesis of 2-amino-2-chromenes promoted by N,N-dimethylamino-functionalized basic ionic liquid catalysis under solvent-free condition / L. Chen, X.-J. Huang, Y.-Q.Li, M.-Y.Zhou, W.-J.Zheng. // MonatsheftefürChemie — Chemical Monthly. — 2009. — Vol. 140. — Issue 1. — P. 45–47.
- Zheng, J. Basic ionic liquid-catalyzed one-pot synthesis of the spiroacenaphthylene derivatives in water medium / J. Zheng, Y. Li. // Mendeleev Commun. — 2012. — Vol. 22. — P. 148–149.
- Miao, W. Ionic-Liquid-Supported Organocatalyst: Efficient and Recyclable Ionic-Liquid-Anchored Proline for Asymmetric Aldol Reaction. / W. Miao, T. H. Chan. // Advanced Synthesis & Catalysis. Special Issue: Multiphase Catalysis, Green Solvents and Immobilization. — 2006 — Vol. 348. — Issue 12–13. — P. 1711–1718.
- Luo, S. Functionalized ionic liquids catalyzed direct aldol reactions. / S. Luo, X. Mi, L. Zhang, S. Liu, H. Xu, J.-P. Cheng // Tetrahedron. — 2007. — Vol. 63. — Issue 9. — P. 1923–1930
- Sanchez, L.M. G. Solvent properties of functionalized ionic liquids for CO2 absorption. / L. M. Galan Sanchez, G. W. Meindersma, A. B. de Haan. // Trans IChemE, Part A, Chemical Engineering Research and Design. — 2007. — Vol. 85. — Issue A1. — P. 31–39.
- Visser, A. E. Task-specific ionic liquids for the extraction of metal ions from aqueous solutions. / A. E. Visser, R. P. Swatloski, W. M. Reichert, R. Mayton, S. Sheff, A. Wierzbicki, J. H. Davis, Jr, R. D. Rogers. — Chem. Commun. — 2001. — P.135–136
- Visser, A. E. Task-Specific Ionic Liquids Incorporating Novel Cations for the Coordination and Extraction of Hg2+ and Cd2+: Synthesis, Characterization, and Extraction Studies. A. E. Visser, R. P. Swatloski, W. M. Reichert, R. Mayton, S. Sheff, A. Wierzbicki, J. H. Davis, Jr, R. D. Rogers. // Environ. Sci. Technol. — 2002. — Vol. 36. — Issue 11. — P. 2523–2529.
- Alok Rout, K. A. Extraction behavior of actinides and fission products in amide functionalized ionic liquid / K. A. Alok Rout, T. G. Venkatesan, P. R. Srinivasan, R. Vasudeva. // Separation and Purification Technology. — 2012. — Vol. 97. — P. 164–171.

