Праведен двухстадийный синтез N-замещенных циклопентанолов через промежуточную стадию окислительного гидроксибромирования индивидуальных изомеров метилциклопентена с участием системы циклоолефин +Н 2 О 2 + HBr. Найдено, что образующийся в режиме in situ электрофильный интермедиат присоединяется к кратной связи метилциклопентена с образованием гидроксибромидов. Путем замещения атома брома на амииногруппы получены аминоспирты. Установлено, что селективность реакции зависит от соотношения скоростей образования и расходования интермедиата и достигает максимума в случае превосходства скорости его расходования. Изменением значений pH среды реакции можно направить, как в сторону аминолиза гидроксибромида так и в сторону дегидробромировани с образованием соответствующего аминоспирта и эпоксида. Рассмотрен механизм реакции. С целью получения сравнимых данных состава аминоспиртов был осуществлён встречный синтез эпоксидов изомеров метилциклопентена, трансформация которых с первичными или вторичными аминами привела к идентичным аминоспиртам без изменения их структуры.
Ключевые слова: бромметилциклопентанол, индуктивное, аминометилциклопентанол, электрофильный интермедиат, эпоксидирование, антимикробное и бактерицидные свойства.
Кислород-азотная (серная и т. д.) функционализация алифатических и циклических непредельных углеводородов в настоящие время является приоритетным направлением в развитии органического и нефтехимического синтеза. Синтез полифукциональных соединений путем окислительного превращения циклических углеводородов имеет огромный научный и практический потенциал. На их основе разработан ряд синтетических аналогов биологически активных веществ [1], лекарственных препаратов с широким спектром свойств: антимикробными, противотуберкулезными, противомалярийными, анальгетическими, анти-ВИЧ активными [2–7]. Эти соединения также используются для получения материалов технического назначения, обладающие бактерицидными и противовирусными свойствами [4,8].
Окислительная бифункционализация С 5 –С 12 циклоолефиновых углеводородов путем их окисления системами, индуцирующими электрофильные интермедиаты, является перспективным методом, позволяющим придать определенные функциональные свойства исходным реагентам без изменения их углеродной структуры. Особенно широкое исследование проводится по синтезу бифункциональных соединений с ОН и NH 2 группами, содержащими моно- и полициклические структурные фрагменты [9–12].
Ранее нами были рассмотрены результаты по синтезу аминоспиртов на основе углеводородов в циклогексеного [13], бицикло [2.2.1]гепт-5-еного [14], а также макроциклического [15] рядов путем присоединения в режиме
in situ
, образующихся активных метастабильных комплексов
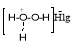
Сведения о получении гидроксиаминов циклопентановыми структурными фрагментами в окислительной системе с использованием пероксида водорода в литературе весьма ограничены. Пероксид водорода характеризуется высоким окислительным потенциалом, эффективностью взаимодействия с различными веществами в мягких условиях синтеза, а также экологической чистотой продуктов его восстановления [16]. В настоящие время разрабатываются и внедряются новые прогрессивные технологии производства пероксида водорода [17], что делает его еще более привлекательным для органического синтеза.
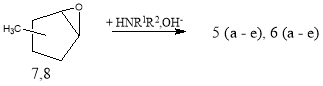
Целью данной работы является получение аминоспиртов на основе продуктов окислительного индуктивного гидроксибромирования изомеров метилциклопентена в системе H 2 O 2 +HBr + циклоолефин с последующим замещением атома брома первичными или вторичными аминами.
Обсуждение результатов
Смесь метилциклопентенов МЦП была получена по известной методике [18] путем дегидратации циклогексанола в циклогексен и изомеризации последнего при 430–450 0 С над активной γ-Al 2 O 3 , предварительно модифицированного соединениями циркония и объемной скоростью 0.5 ч -1 . Индивидуальные изомеры выделены из продуктов дегидратации изомеризации четкой ректификацией.
Получение аминоспиртов через стадии гидроксибромирования индивидуальных изомеров МЦПс участием водных растворов Н 2 О 2 и HBr протекает в гетерофазной системе вода-органический слой. В начальной стадии процесса Н 2 О 2 при температуре (20–40°С) в водной фазе взаимодействует с HBr и окисляет ее до активного МСК (схема I).Установлено, что при сильном перемешивании (450–650 об/мин) МСК переходит в органическую фазы и атакует двойные связь субстрата с образованием активного переходного комплекса, (В) распад последнего приводит к соответствующим гидроксибромидам. Во второй стадии происходит замещение атома брома аминогрупп образованием соответствующих N-замещенных МЦП по схеме:
Схема1
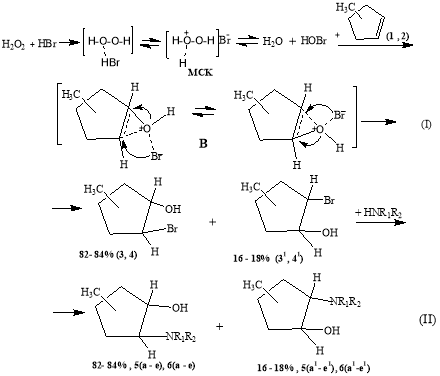
где: 1-СН 3 (1,3,5), 3-СН 3 (2,4,6); R 1 = R 2 = C 2 H 5 (a,a 1 ); R 1 = H,R 2 = C 4 H 9 (b,b 1 ), C 6 H 11 (c,c 1 ); R 1 + R 2 =(- CH 2 -) 5 (d,d 1 ), (- CH 2 -CH 2 -)O(e,e 1 ).
Известно, что в молекуле изомеров МЦП СН 3 группа в основном расположена в цис- форме с преобладанием наиболее выгодной конформации псевдоэкваториальной ориентации [19]. Из приведенной схемы реакции (II) видно, что молекула изомера МЦП не являются плоскими и реагирует МСК наиболее выгодной конформации в форме «конверта» [19] и оно атакует кратную связь субстрата преимущественно «сверху», и формируя активный переходной комплекс (АПК). По-видимому, при гидроксибромировании изомеров МЦП АПК оказывается менее напряженным и к присоединению элементов активного МСК: электрофильного кислорода и нуклеофильного фрагмента Br - к двойной связи субстрата контролируется положением СН 3 группы и структурно-конформационной направленностью атакующих частиц, аналогично нуклеофильному раскрытию оксиранового кольца в эпоксидах по правилу Фюрста — Платтнера [20,21]. При этом электрофильная частица присоединяется к двойной связи через стадии образования оксиранового фрагмента с последующей атакой бром аниона. Присоединение ОН группы преимущественно происходит по углеродному атому, содержащему СН 3 группу (в случае 1-СН 3 - ЦП). В случае 3-СН 3 -ЦП алкильный заместитель удален от кратной связи и он практически мало влияет на реакционную способность субстрата.
Окисление HBrпроисходит при небольшом мольном избытке пероксида водорода (1.5–2.0):1, который позволяет иметь стабильную концентрацию активного МСК до завершения процесса в реакционной зоне и такой подход обеспечивает высокую конверсию превращения исходных субстратов.
При использовании 4.0–8.0 %-ного водного раствора НВr практически единственными продуктами реакции при температуре 30–40°С являются изомеры гидроксибромида МЦПЕ и соответствующий диол. С увеличением исходной концентрации НВr от 10.0 до 20.0 % и температуры реакции в интервале 50–60°С селективность реакции по гидроксибромидам резко снижается, а содержание дибром-производного этих изомеров МЦП в составе продуктов реакции увеличивается. При использовании более разбавленного раствора H 2 O 2 (15–20 %-ного) реакция протекает с большим индукционным периодом (от 2 до 3 часов).
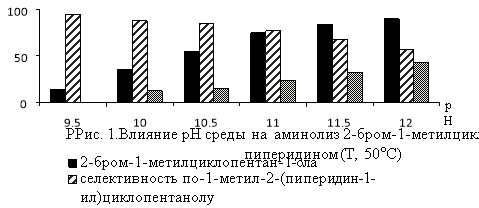
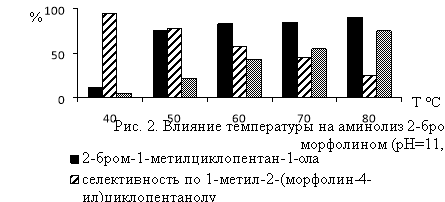
В реакции замещения атома брома в изомерах гидроксибромида МЦП аминогруппой существенное влияние на выход аминоспиртов оказывают температура реакции и значение рН-среды (рис.1 и 2).Наиболее высокая селективность по аминоспиртам (57.0–92.0 %) достигается при температуре 40–60°С и рН 9.5–11.0. При более жестких условиях реакции аминолиз гидроксибромида сопровождается его дегидробромированием и образованием соответствующего эпоксида. Выход последнего при температуре 60–80°С и рН11.5 достигает 27.7–69.3 % (Рис. 1 и 2).
С целью выявления структурных особенностей аминоспиртов, полученных аминолизом гидроксибромидов и эпоксидов МЦП с вторичными аминами нами был проведен встречный синтез эпоксидов изомеров МЦП по известной методике [22] с участием HCOOH или CH 3 COOH и аддукта пероксида водорода с карбамидом, 30 %-ого диоксанового или 35 % водного раствора Н 2 О 2 при мольном соотношении МЦП: окислитель: RCOOH=1:1–2:0,2–0,4 и температуре 40–55 0 С, с использованием сульфокатионита КУ-23х8 в качестве катализатора.
В случае эпоксидирования индивидуальных изомеров МЦПЕ 30 %-ным диоксановым раствором пероксида водорода или его аддукта с мочевиной, основными продуктами реакции являются эпоксиды (78 % и 86 %).
В случае использования водных растворов пероксида водорода, основными продуктами реакции являются двухатомные спирты (до 83.5 %).
В продуктах эпоксидирования изомеров МЦП образуются, в основном, изомер с цис- расположением СН 3 и эпоксидные группы, трансформация последних с первичными или вторичными аминами приводит практически к идентичным аминоспиртам 5(а-е) и 6(а-е), как и в случае, полученным и аминолизом гидроксибромидов изомеров МЦП аминами по схеме:
Схема 2
Экспериментальная часть
Исходные изомеры метилциклопентена (МЦП) получены по известной методике [18]. Далее полученный продукт подвергли четкой ректификации из него было выделено 65 % 1-СН 3 -ЦП (Т.кип.75 0 С, П ᴅ 20 1.4333, ԁ 4 20 0.7869) и 35 % смесь 3- и 4- СН 3 -ЦПЕ (Т.кип.65 0 С, П ᴅ 20 1.4222, ԁ 4 20 0.7624). По данным газожидкостного хроматографического (ГЖХ) анализа чистота 1- СН 3 -ЦП составляет 99.5 %а3- СН 3 -ЦП содержит незначительное количества4- СН 3 -ЦП.
Реакцию гидроксибромирования индивидуальных изомеров метилциклопентенов и аминолиз синтезированных гидроксиброидов изомеров МЦП проводили в стеклянном реакторе по ранее разработанной методике [13–15]. Эпоксидирование индивидуальных изомеров МЦП проводили также по известной методике [22].
Строение полученных соединений подтверждали с помощью ИК-, ЯМР 1 Н, 13 С спектроскопии и элементного анализа [23–26].
ГЖХ анализы проводили на хроматографе Цвет-500 с ПИД колонка 2000х3 мм. фаза — полиэтиленгликольсукцинат (ПЭГС) на хромосорбе (5мас %), газ-носитель — азот, т.кол =120–140°С, т.исп=220–240°С.
ИК-спектры синтезированных соединений снимали на Фурье-спектрометре Alpha в диапазоне 400–4000см -1 в виде суспензий в вазелиновом масле и таблетках КВr. Спектры ЯМР 1 Н и 13 С зарегистрировали на импульсном Фурье-спектрометре фирмы “Bruker” при рабочей частоте 300.18 и 75 МГц, соответственно в растворителе СНD 3 .В качестве внутреннего стандарта использовали сигнал дейтерий-хлороформа СНD 3 (δ Н 7.25, δ С 77.00 м.д.) при комнатной температуре. Элементный анализ выполнен на приборе «Tru Spes Mikro Leco Corporatin»(USA).
В опытах использовали коммерческие амины фирмы Alfa Aesar (A. Johonson Malthey Co) н-(изо-)бутил-,диэтиламины, пиперидин и морфолин, Н 2 О 2 , и HBrа также циклогексанол, НСООН, СН 3 СООН «хч».
2-Бром-1(2)-метилциклопентан-1-ол (3,3 1 ) (мольное соотношение = 70: 30 по данным ГЖХ) получен из 8.2 г (0.1 моль) 1-СН 3 - ЦП. Выход 14 г (78.2 %). т. кип. 73–75°С (0.33 кПа). ИК — спектр . см -1 : 3570. 3480 c(.OH), 2920 s , 2865 а s , (CH 3 ), 2860, 2848 с ( s ,CH 2 ), 1650 сл (С-Н),1460 ср(CH 2 ), 1115,1095 сл(,OH), 560–610 ш (C-Br) [21,22]. ЯМР 1 H, (СНD 3 ), , м.д.: 1.31c (3H, C H 3 ОН), 1.48–2.13 м (6H. 3CH 2 ), 3.49 т (1H. H CBrСН 2 . 1 J 7.1 Гц), 3.67 уш.c. (H, OH) [23,24]. Найдено. %: С 40.63; Н 6.56; Br 44.68. C 6 H 11 Br O. Вычислено. %: С40.23; H 6.15; Br 44.70.
2-Бром-3(5)-метилциклопентан-1-ол (4,4 1 ) (мольное соотношение = 70:30) получен из 8.2 г (0.1 моль) 3- СН 3 -ЦП. Выход 15,4 г (85.6 %), т.кип. 70–71°С (0.33 кПа). ИК — спектр . см -1 : 3565.3480 с(. OH), 2920 с ( s ), 2865 а s , ( s CH 3 ), 2860, 2848 с ( s ,CH 2 ), 1650 сл (С-Н),1460 ср (CH 2 ), 1115,1095 сл (,OH), 585–605 ш (C-Br) [21,22]. ЯМР 1 H, (СНD 3 ), , м.д.: 1.03д (3H, C H 3 СН 1 J 7.0 Гц), 1.38–1.81м (4H. 2CH 2 ), 2.12 т (1Н, CH 3 С Н 1 J= 2 J 7.0, 3 J=6.7 Гц), 3.50д (1H. HCBrСН 2 . 1 J 7.1 Гц), 3.56 уш.c. (H. OH), 3.66 д (1Н, Н СОН, 1,2 J 7.1, 6.7 Гц) Найдено, %: С 40.45; Н 6.36; Br 44.75. C 6 H 11 BrO. Вычислено, %: С40.23; H 6.15; Br 44.70.
2-(Диэтиламино)-1(2)-метилциклопентан-1-ол (5 а, а 1 ) (мольное соотношение =70:30 по данным ГЖХ) получен из 5.37г (30ммоль) смеси изомеров 3, 3 1 2- бром-1(2)-метилциклопентан-1-ола и 7.3 г (100 ммоль) диэтиламина. Выход 4.24 г (82.6 %). т.кип. 107–109°С (2.5 мм рт.ст.). ИК спектр. .см -1 : 3630 с (ОН), 3340. 3125 ср (C-N), 2960. 2895 сл (СН 3 ), 2940–2920. 2850 с ( s СН 2 ),.1935. 1658.1460 сл ( а s СН 2 ), 1320. 1280. 1250 сл (, С-N). 1130 сл (δ. ОН). Спектр, ЯМР 1 Н, (СНD 3 ), δ. м.д.: 1.05т [6Н. N(CH 2 С Н 3 ) 2 . 3 J 8.3 Гц), 1.33 с (3Н. С Н 3 С-ОН). 1.48–1.78м (7Н. 3СН 2 ,CH). 2.45 д [4H.СN<(C H 2 CH 3 ) 2 . 3 J 7.3 Гц]. 3.67 уш.с. (1Н.ОН). ЯМР 13 C, (СНD 3 ), δ c . м.д.: 77.1 [ C N<(CH 2 CH 3 ) 2 ], 75,9 (CH 3 C OH), 50,8 [N<( C H 2 CH 3 ) 2 ], 40,5 (СН 3 -СОН- C H 2 ), 24,8 (- C H 2 HC-N<), 21,3 ( C H 3 COH), 17.4(-CH 2 C H 2 CH 2 -), 13.8 [N<(CH 2 C H 3 ) 2 ]. Найдено, %: С 70.36; Н 12.47; N 8.25 С 10 Н 21 NО. Вычислено, %: С 70.18; Н 12.28; N 8.19.
2-(Бутиламино)-1(2)-метилциклопентан-1-ол(5 b , b 1 ) мольное соотношение = 70:30) получен из 5.37 г (30 ммоль) cмеси изомеров 2-бром-1(2)-метилциклопентан-1-ола 3, 3 1 и 6.6 г (90 ммоль) бутиламина. Выход 3.92 г (76.5 %), т.пл.75–77 0 С (из пропан-2-ола), 137–139 0 С(2.5 мм рт.ст). ИК спектр. .см -1 : 3630с (ОН), 3340. 3140 ср (C-N), 2895 сл (СН 3 ), 2920. 2850 сл ( s СН 2 ),1935. 1658 сл ( а s СН 2 ), 1540 с (,N-H),1280. 1250 с (, С-N-). 1111 сл (δ. ОН). Спектр, ЯМР 1 Н, (СНD 3 ), δ. м.д.: 1.25 с [3Н. ОНСНC H 3 )], 1.35–1.78 м [10Н. СН 3 СОН(C H 2 ) 3 циклопентана и NHCH 2 (С Н 2 ) 2 СН 3 )], 2.74 т (С Н NH –С 4 Н 9 ), 2.30 с (1Н. СНN H ), 1.16–1.65 м [10H. HNCH(C H 2 -) 5 ], 3.59 n (1H. –HNС H циклогексан). ЯМР 13 C, (СНD 3 ), δ c . м.д.: 78.8(CH 3 HO- C CHNH-), 70.6(H C NH-), 44(HN C H 2 -C 3 H 7 ), 34 (HNCH 2 C H 2 CН 2 CH 3 ), 21 (HNCH 2 -CH 2 C Н 2 CH 3 ),, 14.2 (HNCH 2 CH 2 CН 2 C H 3 ), Найдено. % С 69.86; Н12.55; N 7.89. С 10 Н 21 NО. Вычислено. %: С 70.18; Н12.28; N 8.19.
2-(Циколгексиламино)-1(2)-метилциклопентан-1-ол(5с,с 1 ) мольное со-отношение= 70:30) получен из 5.37 г (30 ммоль) из смеси изомеров 2-бром-1(2)-метилциклопентан-1-ола 3,3 1 и 8.91 г (90 ммоль) гексиламина. Выход 4.73 г (77.6 %), т.пл.99–101 0 С (из пропан-2-ола). ИК спектр. .см -1 : 3620 (ОН), 3340. 3136 ср (C-N), 2895 сл (СН 3 ), 2850 ( s СН 2 ), 1658.1460 с ( а s СН 2 ), 1540. 1510 сл (,N-H), 1280. 1260 (, С-N), 1110 сл (δ. ОН). Спектр, ЯМР 1 Н, (СНD 3 ), δ. м.д.: 1.31 с (3Н. С Н 3 СОН),1.15–1.78 м (16Н. 8СН 2 ), 2.3 уш.c (1H. H NC 6 H 11 -), 2.59 т [1Н. НN-C H (CH 2 ) 2 , 2 J HH 7.0 Гц], 2.75 т (1Н. НN-C H COHCH 3 , 2 J HH 7.0 Гц), 3.69 уш.с. (1Н.ОН). ЯМР 13 C, (СНD 3 ), δ c . м.д.: 78.9 (HO- C CH 3 ), 68.2 (HN C H], 58.8 [HN C H(CH 2 ) 2 ], 34.8 [HNCH( C H 2 ) 2 ], 27.3 (CH 2 С Н 2 СНNH), 25.8(-CH 2 C H 2 CH 2 -), 25,4 ( C H 2 ) 2 CH 2 ), 24.2 ( C H 3 COHNH), Найдено. % С73.54; Н12.05; N 7.18. С 12 Н 23 NО. Вычислено. %: С 73.10; Н11.68; N 7.11.
1(2)-Метил-2-(пиперидин-1-ил)циклопентан-1-о л (5 d , d 1 ) (мольное соотношение= 70:30) получен из 5.37г (30ммоль) смеси изомеров 2-бром-1(2)- метилциклопентан-1-ола 3, 3 1 и 7.6г (90ммоль) пиперидина. Выход 4.5 г (81.6 %). Т.кип.142–144°С (2.5 мм рт. ст.). ИК спектр. .см -1 : 3630, 3365c (ОН), 2960 (CН 3 ) c, 1620. 1595 (С-N). 1450.1320.1280.1250 (, С-N-), (СН 2 ), 1110, 1096 (.ОН). Спектр. ЯМР 1 Н (СНD 3 ), δ. м. д.: 1.33с (3Н, С Н 3 СНОН). 1.49–1.77 м (12Н, 6 СН 2 ), 2.49 д (4Н.-N<(CH 2 ) 2 2 J 7.3 Гц). 2.74 т (1Н. НС–N< 1 J 6.9 Гц). 3.67 уш. с (1Н.ОН). ЯМР 13 C,(СНD 3 ), δ c . м.д.: 77.2(СН 3 С НОНN), 59.0 [H C N( C H 2 -) 2 ], 41СНОН C H 2 ), 26.4 [HCN(CH 2 C H 2 ) 2 CH 2 -], 24.8, (H 2 C H-N), 24.4 [HC-N<(CH 2 CH 2 ) 2 C H 2 ]. Найдено. % С 71.88; Н 11.18; N 7.25 С 11 Н 21 NО. Вычислено. %: С 72.14; Н 11.48; N 7.65.
1(2)–Метил-2-(морфолино-4-ил)циклопентан-1-ол (5 е, е 1 ) (моль. соотн.=73:27) получен из 17.9 г (0.1 моль) смеси изомеров 3, 3 1 2-бром-1(2)- метилциклопентан-1-ола и 9.74 г (112 ммоль) морфолина. Выход 14.7 г (79.5 %), т.пл. 91–92.5°С (из пропан-2-ола). ИК спектр .см -1 : 3493 (. ОН). 3374.3320. 1620.1596 (. СN), 2950,1320.1280.1250 (. СH 2 ), 1240. 1180 (COC), 1130.1089 (.OH). ЯМР 1 H (СНD 3 ), . м.д.: 1.32 с (3Н. С Н 3 НСОН). 1.47–1.78 м (6H,3CH 2 ). 2.74 т [1H. H CN<(CH 2 CH 2 ) 2 О. 1 J 7.2 Гц). 2.69 д [4H.–N<(C H 2 CH 2 ) 2 О. 2 J 7.1 Гц]. 3.62 д [4Н. –N<(CH 2 C H 2 ) 2 О. 2 J 7.3 Гц]. 3.67 уш.c. (1Н. Н ОСНСН 3 ). ЯМР 13 C, (СНD 3 ), δ c . м.д.: 77.1(H C N<), 66.2 (CH 3 C OH), 67.3 [-N<(CH 2 C H 2 ) 2 O], 52.8 [-N<( C H 2 CH 2 ) 2 O], 41.0( C H 2 COH CH 3 ), 24.8 (- C H 2 CHN<), 21.4 ( С Н 3 НСОН). Найдено. %: С 65.18; Н 10.46. N 7.28 C 10 H 19 NO 2 . Вычислено. %: С 64.87; Н 10.27; N 7.57.
Аналогично были получены 6 (а-е).
3(2)-(Диэтиламино)-2(5)-метилциклопентан-1-ол (6а, а 1 ) мольное соот-ношение=73:27)получен 5.37г (30 ммоль) из смеси изомеров 2-бром-3(5)-метилциклопентан-1-ола 4, 4 1 и 7.3 г (100 ммоль) диэтиламина. Выход 4.48г (87.4 %). т. кип. 106–107.5°С (2.5 мм рт. ст.). Найдено, %: С 70.56; Н 12.46; N 8.22 С 10 Н 21 NО. Вычислено, %: С 70.18; Н 12.28; N 8.19.
3(2)-(Бутиламино)-2(5)-метилциклопентан-1-ол (6 b , b 1 ) (мольное-соотношение =73:27) получен 5.37 г (30 ммоль) из смеси изомеров 2-бром-3(5)-метилциклопентан-1-ола 4, 4 1 и 6.6 г (90ммоль) бутиламина. Выход 4.0 г (77.1 %), т.кип.135–7 0 С (2.5 мм рт. ст). Найдено. % С 71.0; Н12.55; N 7.96. С 10 Н 21 NО. Вычислено. %: С 70.18; Н12.28; N 8.19.
3(2)-(Циклогексиламино)-2(5)-метилциклопентан-1-ол (6с,с 1 ) (моль-ное соотношение =73:27) получен 5.37 г (30 ммоль) из смеси изомеров 2-бром-3(5)-метилциклопентан-1-ола 4, 4 1 и 8.91 г (90ммоль) гексиламина. Выход 4.78 г (78.4 %),т.пл.76–78 0 С (из пропан-2-ола). Найдено. % С73.64; Н11.08; N 7.20. С 12 Н 23 NО. Вычислено. %: С 73.10; Н11.68; N 7.11.
3(2)-Метил-2(5)-(пиперидин-1-ил)циклопентан-1-ол(6 d , d 1 ) (мольное соотношение =73:27)получали 5.37 г (30 ммоль) из смеси изомеров 2-бром-3(5)- метилциклопентан-1-ола 4, 4 1 и 7.6 г (90ммоль) пиперидина. Выход 4.5 г (81.6 %). т.кип. 142–143°С (2.5 мм рт. ст.). ИК спектр. .см -1 : 3930. 3370 (ОН). 2960 (CН 3 ), 2940. 1450. (СН 2 ). 1620. 1595 (СN), 1320.1280 (,С -N), 1110. 1095 сл (.ОН). Спектр. ЯМР 1 Н, (СНD 3 ), δ. м. д.: 1.33с (3Н. С Н 3 СНОН). 1.43–1.76м (12Н. СН 2 ). 2.48 д [4Н. N<(С Н 2 ) 2 . 2 J 7.4 Гц]. 2.73 т (1Н. Н СN< 1 J 6.9 Гц). 3.67 уш.с (1Н. Н ОCCH 3 ). Найдено. % С 72.0; Н 11.26; N 7.25 С 11 Н 21 NО. Вычислено. %: С 72.14; Н 11.48; N 7.65.
3(2)–Метил-2(5)-(морфолино-4-ил)циклопентан-1-ол (6е, е 1 ) (моль-ное соотношение=73:27) получили 17.9 г (0.1 моль) из смеси изомеров 4, 4 1 2-бром-3(5)- метилциклопентан-1-ола и 9.74 г (112 ммоль) морфолина. Выход 14.7 г (79.5 %), т.пл. 92–93.5°С (из пропан-2-ола). Найдено. %: С 65.38; Н 10.46. N 7.43 C 10 H 19 NO 2 . Вычислено. %: С 64.87; Н 10.27; N 7.57.
1-Метил-6-оксабицикло [3.1.0]гексан (7)
получали из 8.2 г (0.1 моль) 1-СН
3
-ЦПЕ (
1
). Выход 7.7 г (78.6 %), Т.кип. 101–102°С (0.33 кПа), n
D
20
=1.4358, d
4
20
=0.9734. ИК — спектр . см
-1
:2940–2920.2860 (
s
. CH
2
). 2845 (
s
, CH
3
). 1270, 1254 (

2-Метил-6-оксабицикло [3.1.0]гексан (8)
получали из 8.2 г (0.1 моль) 3-СН
3
-ЦПЕ (
2
). Выход 8.0 г (81.7 %), Т.кип. 102–103°С (0.33 кПа), n
D
20
=1.4365, d
4
20
=0.736. ИК — спектр . см
-1
: 2940–2920, 2860 (
s
. CH
2
). 2845 (
s
, CH
3
). 1270, 1250 (


1-Метил-2-(пиперидин-1-ил) циклопентан-1-ол(5 d ) получали из 1-СН 3– 6-оксабицкло [3.1.0]гексана (7) и 7.6г (90ммоль) пиперидина. Выход 4.5 г (81.6 %). т.кип. 142–144°С (2.5 мм. Hg). ИК спектр. .см. -1 : 3930. 3370 (ОН), 2960 (CН 3 ), 1620. 1595 (СN), 1460.1450 ( s СН 2 ),1385.1320.1250(. –N<)1110. 1096 (.ОН). Спектр. ЯМР 1 Н (СНD 3 ), δ. м.д.: 1.33с (3Н. С Н 3 CHOH). 1.43–1.73м (12Н. 6СН 2 ). 2.48 д (4Н. HCN<(С Н 2 ) 2 . J 7.4 Гц). 2.73 т (1Н. Н С–N<(СН 2 ) 2 J 6.9 Гц). 3.67 уш. с (1Н. ОН). Найдено. % С 71.88; Н 11.18; N 7.25 С 11 Н 21 NО. Вычислено. %: С 72.13; Н 11.47; N 7.61.
1–Метил-2-(морфолин-4-ил)циклопентан-1-ол (5е) получили из 5.49 г (56 ммоль) 1-СН 3– 6-оксабицкло [3.1.0]гексана (7) и 9.74 г (112 ммоль) морфолина. Выход 8.18 г (85.5 %). т. пл. 93–95°С из (CH 3 ) 2 CHOH. ИК спектр. .см -1 : 3493 (. ОН), 3374.3320 (. СN), 2950. 2940–2920 (. СH 2 ),1620.1596 (. С-N).), 1320.1280.1254 (, -N<), 1250.1240. 1180 (COC), 1140.1125 (.OH). ЯМР 1 H (СНD 3 ), . м. д.: 1.31 с (3Н. COHС Н 3 ). 1.43–1.77 м (6H. 3CH 2 ). 2.74 т (IH. H - CN< CH 2 1 J 7.2 Гц). 2.69 д [4H. –N<(C H 2 CH 2 ) 2 О. 2 J 7.1 Гц]. 3.67 д [4Н. N<(CH 2 C H 2 ) 2 О. 2 J 7.3 Гц]. 3.67 уш.c. (Н. ОН). Найдено. %: С 65.25; Н 10.86. N 7.36. C 10 H 19 NO 2 . Вычислено. %:С 64.86; Н 10.27; N 7.57
3-Метил-2-(пиперидин-1-ил)циклопентан-1-ол(6 d ) получали из 5.49 г (56 ммоль) 2-СН 3– 6-оксабицкло [3.1.0]гексана ( 8 ) и 7.6г (90 ммоль) пиперидина. Выход 8.2 г (80.3 %). т.кип. 140–142°С (2.5 мм рт. ст.).
Найдено. % С 71.93; Н 11.47; N 7.85 С 11 Н 21 NО. Вычислено. %: С 72.13; Н 11.47; N 7.61.
3–Метил-2-(морфолин-4-ил)циклопентан-1-ол (6е) получили из 5.49 г (56 ммоль) 2-СН 3– 6-оксабицкло [3.1.0]гексана ( 8 ) и 9.74 г (112 ммоль) морфолина. Выход 8.18 г (85.5 %). т.пл. 93–95°С (из пропан-2-ола).
Найдено. %: С 65.08; Н 10.46. N 7.36. C 10 H 19 NO 2 . Вычислено. %:С 64.86; Н 10.27; N 7.57
Таким образом, функционализация циклоолефиновых углеводородов путем их превращения системами, индуцирующими электрофильные интермедиаты, является перспективным методом позволяющим придать определенные функциональные свойства исходным реагентам без изменения их углеродной структуры.
Благодарности
Работа выполнена в рамках государственного задания Института Нефтехимических Процессов имени Ю. Г. Мамедалиева НАН Азербайджана.
Финансирование работы
Работа выполнена при финансовой поддержке НАН Азербайджана.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Информация о вкладе авторов
Авторы: О. А. Садыгов. Н. А. Пашабейли принимали участие в разработке и проведении экспериментальных реакций по синтезу изомеров метилциклопентена их гидроксибромированию, эпоксидирования и аминолиза продуктов реакции.
Литература:
- Bergmeier S. C. // Tetrahedron. 2000. Vol. 56. N. 17. Р. 2561. Doi 101016/S0040–4020(00)00149–6.
- Пальчиков В. А. Морфолины. Синтез и биологическая активность// ЖОрХ. 2013, Т. 49, Вып.6. С. 807–831.
- Машковский М. Д. Лекарственные средства: В 2т- Изд. 14-е, М.: Новая волна 2002. Т.1, 540с.; Т.2, 608с.
- Tandon V. K., Kumar M., Awashi A.K., Saxena H. O., Goswamy G. K. // Bioorg. Med.Chem. Lett. 2004, 14, 3177–3180. doi 10.1016/j.bmci.2004.04.009.
- Касьян Л.И., Пальчиков В.А. // ЖОрХ. 2010. Т. 46. Вып. 1. С. 7; Kas`yan L. I., Pal`chikov V. A. [Russ. J. Org. Chem. 2010. Vol. 46. N. 1. P. 7] Doi 10.1134/S107042801001001X.
- Inaba T., Yamada X., Abe H., Segawa S., Cho H. // J. Org. Chem. 2000. Vol. 65. N. 6. P.1623. Doi 10.1021/j991793e
- Liu X., Tang M., Wang L., Chao R.// 2016. Vol. 30. N. 1. P.161. Doi 10.1002/rem.7402.
- Алимарданов Х.М., Садыгов О. А., Сулейманова Э.Т., Абдуллаева М.Я., Бабаев Н.Р., Джафарова Н.А. // ЖПХ, 2009. Т.82. Вып.7. С.1159–1166.
- Saiz C., Villamil V., Gonzalez M. M., Rossi M. A., Martinez L., Suscun L., Vila A. J., Mahler G. // Tetrahedron: Asym. 2017. Vol.28. N.1. P.110. Doi 10.1016/j.tetasy.2016.11.002.
- Walker D. P., EklovB.M., Bedore M. W.// Synthesis. 2012. Vol.44. Р.2859. Doi10.1055/s-0032–1316748
- Касьян Л.И., Придьма С.А., Палчиков В.А., Касян А.О., Туров А.Б., Токарь А.В., Третьяков С.В. // ЖОрХ. 2010. Т. 46. Вып. 5. С. 649.
- Пальчиков В. А., Святенко Л. К., Плахотний И. Н., Касьян Л. И. // ЖОрХ. 2013. Т. 49. Вып. 5. С. 704.
- Садыгов О. А., Алимарданов Х. М., Исмаилова Ш. И., Бабаев Н. Р. // ЖОХ.2018. Т. 88. Вып. 4. С. 566–573. Doi 10.1134/S10700363218040072.
- Садыгов О. А., Алимарданов Х. М., Исмаилова Ш. И. // ЖОХ. 2018. Т. 88. Вып. 5. С. 717. Doi 10.1134/S107036328050031.
- Садыгов О. А., Алимарданов Х. М., Исмаилова Ш. И., Бабаев Н. Р. //ЖОрХ,2020.Т.56.Вып. 6.С.893–899. Doi10.31857/S051474922006–00063.
- Беренблит В. М., Бурдин В. В., Вишняков В. М. Химия и технология перекиси водорода. Л.: Химия 1984. 200 с.
- The Chemical Journal / Химический журнал. 2007. Вып. 12. С.7.
- Мусаев М. Р.,ГайдаровЭ.Э.,Ахмедова Р. Э.//Аз.хим.журнал,1978, Вып.4. С.47–49.
- Илиел Э. И., Аллинжер Н. А., Энжиал С. Э., Моррисон Г. Конформационный анализ. М.: Мир, 1969, 592 с
- Оковитый С.И., Гапонова Р.Г., Платницина Е.Л. // Вопр. хим. и хим.технол. 2001.Вып.1.С.51–56.
- Kirk D. N. Selectivity in reaction sofepoxides.// Chem. Ind. 1973. N3. p.109.
- Верешагина Н,В., Антонова Т.В., Абрамов И.Г., Конушкина Г.Ю. //Нефтехимия. 2014.Т.54. Вып.3.С.207–213.
- Larkin P. J. Infrared and roman spectroscopy principal and spectral interpertation. Stamford, Elsrvier. 2011, 230 p.;Поисковая база спектральных данных органических веществ (Spectral database for organic compounds. National Institute of Advanced Industrial Siense and Tehnoloqy Japan): http://riodb 01.ibase.aist.go.jp
- Преч Э., Бюлман Ф., Аффольтер К. Определение строения органических соединений.М.:Мир,2006,439с.
- Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрометрическая идентификация органических соединений. М.:БИНОМ, Лаборатория знаний. 2011,520с.
- Дероум Э. Современные методы ЯМР для химических исследований. М: Мир. 1992. 410 c.

