В настоящее время доказана ассоциация рака желудка кишечного типа с Helicobacter pylori-инфекцией. Наличие этой ассоциации обусловлено развитием хронического гастрита в ответ на колонизацию слизистой оболочки желудка (СОЖ) H.pylori [1]. Длительная персистенция клеток воспалительного инфильтрата, наблюдающаяся при хроническом H.pylori-ассоциированном гастрите, оказывает повреждающее воздействие на эпителиоциты СОЖ, отражением чего служит появление в СОЖ атрофических изменений. Дальнейшее повреждение генома эпителиоцитов приводит к возникновению в СОЖ, наряду с атрофическими изменениями, дисплазии/неоплазии, а затем и рака желудка кишечного типа [1, 2]. Поэтому важное значение приобретает не только оценка атрофических изменений СОЖ и выраженности воспаления, но и состава воспалительного инфильтрата, который на сегодняшний день недостаточно исследован. Уровень воспалительного ответа в значительной степени определяется полиморфизмом генов цитокинов [3]. Носительство полиморфных аллелей генов цитокинов определяет риск развития рака желудка кишечного типа, при этом он значительно варьирует в различных исследуемых популяциях [4].
Таким образом, результаты исследования особенностей воспалительной реакции в слизистой оболочке желудка, в дальнейшем могут позволить оценить индивидуальный риск развития рака желудка кишечного типа у обследуемого пациента.
Цель исследования: Определить особенности состава воспалительного инфильтрата слизистой оболочки желудка и полиморфизма генов цитокинов, регулирующих воспаление, для оценки факторов риска рака желудка кишечного типа.
Материалы и методы. Объектами исследования были фрагменты слизистой оболочки желудка и венозная кровь 82 больных раком желудка кишечного типа, находившихся на лечении в Омском клиническом онкологическом диспансере.
Морфологическому исследованию подвергались фрагменты слизистой оболочки резецированных желудков, забранные из 5 точек: большой и малой кривизны антрального отдела и тела желудка и угла желудка. Отдельно производился забор фрагментов ткани опухоли. Морфологическая оценка производилась в соответствии с Российским пересмотром классификации хронического гастрита OLGA.
Иммуногистохимическое исследование выполняли на парафиновых срезах. Демаскировка антигенов осуществлялась в цитратном буфере (pH=6,0) при кипячении в водяной бане на протяжении 1 часа. Использовались первичные мышиные моноклональные антитела CD4, CD8, CD20, CD68 производимые «DAKO» и система визуализации «Histofine». Ядра докрашивались гематоксилином Майера. Подсчет проводился на 1000 клеток, вычислялось процентное их соотношение.
При помощи метода полимеразной цепной реакции в аллель-специфической и ПДРФ-модификациях определялось носительство полиморфных аллелей генов IL-1β C+3953T (rs1143634) и C-511T (rs16944), TNF-α G-308A (rs1800629), IL-10 G-1082A (rs1800896) и вариабельное число тандемных повторов в интроне 2 гена IL-1RN. ПЦР проводилась с использованием коммерческих наборов реагентов «SNP-экспресс», производимых НПФ «Литех» и ИХФБМ СО РАН. Этапы амплификации ДНК выполнялись в соответствии с требованиями, указываемыми производителем. Детекцию продуктов амплификации осуществляли в 3% агарозном геле. В исследуемой группе определялось соответствие соотношения частот аллелей равновесию Харди-Вайнберга.
Для статистической оценки полученных результатов вычислялись U-критерий Манна-Уитни и критерий Краскелла-Уоллиса (H). Вычисления и построение диаграмм проводились с помощью пакета статистических программ Statistca 6.0 и Microsoft Excel 2007.
Результаты и обсуждение.
Плотность мононуклеарной инфильтрации варьировала в пределах от умеренной до выраженной. При оценке состава мононуклеарного воспалительного инфильтрата было выявлено преобладание CD4+ Т-лимфоцитов, диффузно инфильтрировавших собственную пластинку СОЖ, доля которых составила в антруме 44,1±8,8% и 35,6±3,2% в теле желудка. С несколько меньшей частотой встречались CD8+ Т-лимфоциты (21,5±6,1% и 16,2±2,2% в антральном отделе и теле желудка, соответственно). CD20+ В-лимфоциты локализовались в виде скоплений, вне этих скоплений их плотность была низка, их доля составила в антральном отделе 6,3±1,1% и 4,2±1,8% в теле желудка. CD68+ макрофаги составили 28,1±4,3% и 22,3±6,7% в антральном отделе и теле желудка, соответственно, от общего числа мононуклеарных клеток. При оценке состава воспалительного инфильтрата у больных с различными показателями стадии и степени хронического гастрита было выявлено, что доля CD20-позитивных клеток в собственной пластинке слизистой оболочки коррелирует с градацией воспаления в антральном отделе и теле желудка у больных раком желудка кишечного типа (Н=14,8; p<0,05). Рядом авторов было показано, что количество CD20-позитивных B-лимфоцитов в собственной пластинке СОЖ ассоциировано с H.pylori-инфекцией и коррелирует с выраженностью морфологических проявлений гастрита у детей, значительно снижаясь при эрадикации инфекта [8, 9]. По-видимому, увеличение доли CD20-позитивных клеток, формирующих скопления, при более выраженном воспалении в собственной пластинке СОЖ у больных раком желудка кишечного типа может указывать на длительность течения воспалительной реакции имеющей место также и после возможной спонтанной эрадикации инфекта. Возможность сохранения воспалительного инфильтрата после эрадикации H.pylori показана на примере феномена эксхеликобактерного гастрита [10].
Кроме того, было обнаружено, что в участках собственной пластинки слизистой оболочки желудка, граничащих с зоной опухолевого роста, наблюдается более выраженная инфильтрация CD8- и CD68-позитивными клетками, чем в антральном отделе и теле желудка (U=5,5; p<0,05 и U=43,0; p<0,05, соответственно). Инфильтрация собственной пластинки слизистой оболочки желудка CD8- и CD68-позитивными клетками, вероятно, является морфологическим проявлением неспецифического иммунного ответа и ответа Th-1 типа, возникающего в ответ на развитие опухоли. Увеличение количества цитотоксических лимфоцитов в зоне опухоли при раке желудка кишечного типа показано J. Chen и соавторами [11]. Полученные ими результаты указывают на корреляцию между долей CD8+ клеток и характеристиками опухоли по градации TNM [11]. Отсутствие подобной корреляции в нашем исследовании может объясняться оценкой характеристик воспалительного инфильтрата в пограничном с опухолью участке СОЖ, а не в зоне опухолевого роста. В данном случае отсутствует прямая зависимость между этими показателями и увеличение доли CD8+ клеток может рассматриваться скорее как феномен, указывающий на близкую локализацию опухоли.
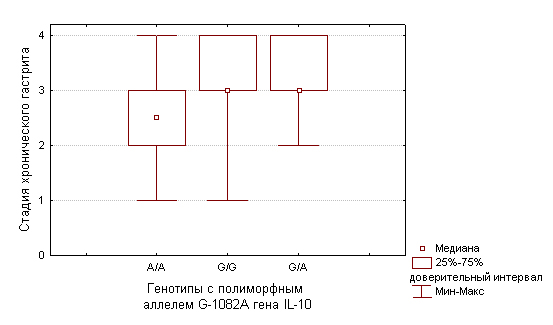
При исследовании генетического полиморфизма было выявлено, что распределение частот аллелей в исследуемой и контрольная группах соответствует равновесию Харди-Вайнберга. Поиск ассоциации между морфологическими характеристиками изменений в СОЖ и носительством исследуемых полиморфных аллелей генов цитокинов и генотипов с этими аллелями показал, что наличие рака желудка кишечного типа при атрофических изменениях слизистой оболочки желудка, соответствующих стадии II хронического гастрита ассоциировано с носительством генотипа -1082A/A гена IL-10 (U=7,5; p<0,05). Носительство генотипа -1082A/A гена IL-10 связано с меньшей экспрессией белка [12, 13]. Учитывая биологические эффекты IL-10, заключающиеся в подавлении воспалительного ответа, протекающего по Th-1 типу [14], меньшая продукция IL-10, по-видимому, обусловливает более выраженное повреждающее действие, оказываемое клетками воспалительного инфильтрата на СОЖ, что способствует, вероятно, быстрому протеканию каскада канцерогенеза в СОЖ и появление аденокарциномы уже на стадии II атрофических изменений СОЖ.
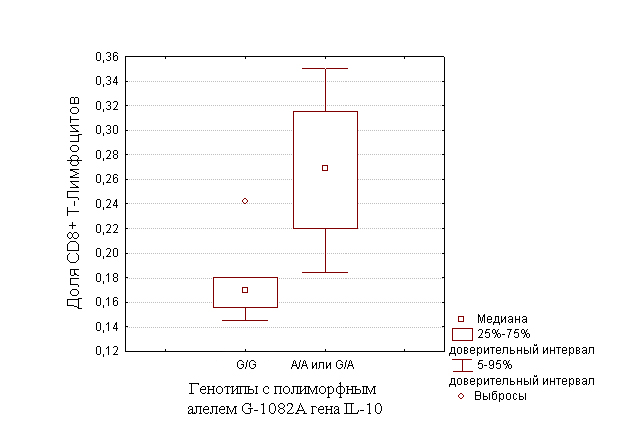
На усиление ответа иммунного ответа, протекающего по Th-1 типу указывает тот факт, что доля CD8-позитивных клеток в собственной пластинке слизистой оболочки антрального отдела желудка больных раком желудка кишечного типа достоверно выше у носителей гетерозиготного (-1082 G/A) и гомозиготного (-1082 A/A) генотипов по полиморфному аллелю G-1082A гена IL-10, в сравнении с носителями гомозиготного по нормальному аллелю генотипов (U=5,0; p<0,05) (рис.2)
Рис.1. Распределение стадии хронического гастрита у больных раком желудка кишечного типа в зависимости от носительства генотипов с полиморфным алелем G-1082A гена IL-10.
Рис.2. Выраженность инфильтрации СОЖ CD8-позитивными клетками у носителей генотипов с полиморфным алелем G-1082A гена IL-10.
Показатели степени хронического атрофического гастрита и мононуклеарной инфильтрации СОЖ в антральном отделе и теле желудка у больных раком желудка кишечного типа коррелируют с количеством полиморфных аллелей генов цитокинов у данного больного. Данная ассоциация, вероятно, обусловлена более выраженным провоспалительным ответом и менее выраженным его подавлением у носителей исследуемых полиморфных аллелей.
Таким образом, состав мононуклеарного воспалительного инфильтрата указывает на сочетание в СОЖ при раке желудка кишечного типа двух типов иммунного ответа: иммунного ответа протекающего по Th-2 типу, обусловленного инфильтрацией СОЖ CD20+ B-лимфоцитами и служащего отражением процесса хронического воспаления и иммунного ответа протекающего по Th-1 типу, являющегося как компонентом хронического восполения, так и реакцией на опухолевый процесс, однако распространяющийся в СОЖ за пределы опухоли на пограничные с ней участки. Для пограничных с зоной опухолевого роста участков СОЖ характерна активация и неспецифического иммунного ответа. Кроме того усиление воспалительного ответа по Th-1 связано с носительством полиморфного аллеля -1082 A гена IL-10.
- Литература:
1) Кононов А.В. Воспаление как основа Нelicobacter pylori – ассоциированных болезней / А.В. Кононов // Архив патологии. – 2006. – №5. – С. 3-10.
2) Konturek P.C. Helicobacter pylori infection in gastric cancerogenesis / P.C. Konturek, S.J. Konturek, T. Brzozowski // Journal of physiology and pharmacology. – 2009. – Vol. 60, № 3. – P. 3-21.
3) Shanks A.M. Helicobacter pylori infection, host genetics and gastric cancer / A.M. Shanks , E.M. El-Omar // Journal of digestive diseases. – 2009. – Vol.10, №3. – P.157-164.
4) Interleukin-1beta and interleukin-1 receptor antagonist gene polymorphisms and gastric cancer: a meta-analysis. / M.C. Camargo [et al.] // Cancer epidemiology, biomarkers & prevention: a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology. – 2006. – Vol.15, №9. – P.1674-1687.
5)Assessment of Atrophic Gastritis Using the OLGA System / K. Satoh [et al.] // Helicobacter. – 2008. – Vol. 13, №3. – P. 225–229.
6) OLGA Gastritis Staging in Young Adults and Country-Specific Gastric Cancer Risk / M. Rugge [et al.] // Int. J. Surg. Pathol. – 2008. – Vol. 16, № 2. – P. 150–154.
7) The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis / L. G. Capelle [et al.] // Gastrointest. Endosc. – 2010. – Vol. 71, №7. – P. 1150–1158.
8) Helicobacter pylori increases expression of proapoptotic markers Fas and FasL on CD4 lymphocytes in children / A. Kotłowska-Kmieć [et al.] // Acta biochimica Polonica. – 2009. – Vol. 56, № 3. – P.433-438.
9) B (CD20+) lymphocytes in the antrum mucosa of children with Helicobacter pylori infection / E. Maciorkowska [et al.] // Roczniki Akademii Medycznej w Białymstoku. – 2004. – Vol. 49 № 1. P. 222-224.
10) Ливзан М.А. Экс-хеликобактерный гастрит: неологизм или клиническая реальность? / М.А. Ливзан, А.В. Кононов, С.И. Мозговой // Экспериментальная и клиническая гастроэнтерология. – 2004. – № 5.- С. 55 - 59.
11) Intratumoral expression of il-17 and its prognostic role in gastric adenocarcinoma patients /Ju-gao Chen // International Journal of Biological Sciences. – 2011. – Vol. 7, № 1. P. 53-60.
12) Smith A.J. Cytokine and cytokine receptor gene polymorphisms and their functionality / A.J. Smith , S.E. Humphries // Cytokine & growth factor reviews. – 2009. – Vol.20, №1. – P.43-59.
13) Interindividual variations in constitutive interleukin-10 messenger RNA and protein levels and their association with genetic polymorphisms / A. Suarez [et al.] // Transplantation. – 2003. – Vol. 75, № 5. – P. 711-717.
14) IL10 interleukin 10 [ Homo sapiens ] [Электронный ресурс]. – 2011. – Режим доступа: http://www.ncbi.nlm.nih.gov/gene/3586.