На сегодняшний день современная ветеринарная медицина мелких домашних животных очень быстро развивается, что требует широкого внедрения новых технологий при диагностике и лечении, при которых происходит меньшее травмирование животных при оперативных вмешательствах, а также повышается эффективность диагностических и лечебных процедур. [1, 5, 26]
Манипуляции, выполняемые при помощи лапароскопии, подразделяются на диагностические и лечебно-профилактические. В первом случае лапароскопию используют, когда данные клинического обследования животного не достаточны для постановки верного диагноза, а также для выяснения операбельности патологии. В 90–100 % случаев после проведения диагностической лапароскопии возможно поставить заключительный диагноз. В лечебно-профилактических целях лапароскопию используют при удалении новообразований небольшого размера на различных органах, при гастропексии, цистопексии и колонопексии, а также кастрации кошек, сук и крипторхов. [2, 10, 25]
Целью проведённых исследований явилось изыскание более эффективных методов наркоза при лапароскопии в оперативном акушерстве мелких домашних животных.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ.
Представленная работа была выполнена на кафедре анатомии, ветеринарного акушерства и хирургии Кубанского государственного аграрного университета и в частной ветеринарной клинике «Большая медведица» г. Краснодара.
Для проведения настоящих исследований были сформированы 2 группы (контрольная и опытная) животных, подобранных по принципу «пар-аналогов», n=10 в каждой группе. В них входили кошки разных пород (по 2 животных персидской породы, 2 животных русской голубой породы, 1 животному сиамской породы, 5 животных, не имеющих породности) в возрасте от 1-го до 3-х лет, самки, со средним весом 3 кг, отобранные методом случайной выборки. Животные всех групп были подвергнуты лапароскопической овариогистерэктомии.
Операционную готовили, соблюдая правила асептики и антисептики. Было подготовлено два операционных набора: для эндоскопической операции, в том числе инструменты общехирургического назначения, и набор инструментов для открытой операции при необходимости конверсии. [4, 7, 24]
В качестве премедикации всем животным за 20 минут до операции применяли следующие препараты: Атропина сульфат 0,1 % по 0,15 мл подкожно; Пипольфен 0,25 % по 0,1 мл внутримышечно. В качестве седативного препарата применяли Ксилазин 2 % по 0,5 мл внутримышечно. [3, 6, 23]
В рамках опыта животным контрольной группы осуществляли внутривенный наркоз с применением Золетила-100 по 0,8 мл внутривенно с предварительным разведением 0,9 %-ым раствором Хлорида натрия. Животным опытной группы был осуществлен ингаляционный наркоз с применением Изофлурана. Для этого первоначально внутривенно вводилась минимальная доза Золетила с целью подавления рефлексов, затем производили интубацию трахеи. После этого производили подачу Изофлурана в концентрации 1,5–3 % в смеси с кислородом. Непосредственно около операционного стола имелся аппарат искусственной вентиляции легких. [8, 11, 14]
Ход операции. Первоначально произвели прокол брюшной стенки иглой Вереша с целью создания карбоноперитонеума, в чем убеждались по наличию тимпанического звука при перкуссии брюшной полости. При этом в параметрах инсуффлятора устанавливали показатель давления, равный 6–7 мм рт. ст. затем иглу Вереша извлекали и вводили троакары диаметром 5 мм в двух точках: точка, располагающаяся на расстоянии 4–5 см выше пупка и чуть левее от срединной линии живота, и точка на расстоянии 1–2 см ниже пупка. После чего животное поворачивали в боковое положение под углом в 45о. Из троакаров извлекали стилеты, затем в краниальный троакар вводили лапароскоп и присоединяли шланг для подведения газа, а в каудальный — зажим с кремальерой. Производилась фиксация одного из рогов матки, подведение его к брюшной стенке и подвешивание при помощи специального крючка. После извлекание зажима на его место устанавливали коагулятор, которым пережигали сосуды и связку яичника. После замены коагулятора на ножницы рассекали коагулированные ткани. Аналогичные действия осуществляли в отношении второго яичника. Далее выводили матку через каудальный троакар, производили ее экстирпацию по общепринятой методике. Убедившись в отсутствии остаточного кровотечения культи, опускали ее в брюшную полость и извлекали все инструменты. На мышцы брюшной стенки накладывали внутрикожный шов, а кожу склеивали специальным хирургическим клеем. Средняя продолжительность операции составляла 20–30 минут. [9, 13, 22]
При проведении эксперимента использовали следующие методы исследования: клинический, эндоскопический, гематологический. Результаты исследований подвергнуты математической обработке с использованием стандартных программ статистического анализа, а достоверность результатов определялась по параметрическому критерию Стьюдента. [12, 15, 21]
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ.
Проведение лапароскопических операций у животных становится невозможным без создания избыточного давления в брюшной полости, для этого использовали двуокись углерода с давлением 7–8 мм ртутного столба. Вследствие такой манипуляции происходят изменения легочной вентиляции и гемодинамики. Также неизбежно частичное всасывание углекислого газа, что влечет за собой нарушения гомеостаза. [16, 18, 20]
С целью профилактирования осложнений после проведенной лапароскопической операции, а также для снижения риска возникновения анестезиологических осложнений для организма животного, необходимо знать особенности гематологических изменений, происходящих при такого рода манипуляциях, при создании карбоноперитонеума. Следует учитывать, что достоверных данных, освещающих этот вопрос, в научной литературе на сегодняшний день не имеется. [17, 19]
В рамках опыта животным контрольной и опытной групп применялся различный наркоз, внутривенный и ингаляционный соответственно, о чем подробно изложено в материалах и методах исследования.
Динамика изменения температуры тела животных в течение и после проведения лапароскопической овариогистерэктомии.
Оценивая динамику изменения температуру тела кошек при проведении операции было отмечено ее снижение, что является нормой. Однако температура тела животных группы контроля была на 2,8 % ниже по сравнению с опытной группой.
По окончании операции отмечалось еще большее снижение температуры тела до 37,51±0,88 оС и 36,13±3,79 оС в опытной и контрольной группах соответственно. Изменения температуры тела кошек отражены в таблице 1.
Анализируя динамику изменения количества сердечных сокращений нами была отмечена брадикардия у подопытных животных. Так, у кошек опытной группы количество сердечных сокращений во время операции составило 103,8±12,71 уд/мин, а у кошек контрольной группы — 95,6 ±27,46 уд/мин.
Таблица 1
Динамика изменения температуры тела животных при проведении лапароскопической овариогистерэктомии
|
Вид группы животных |
Температура тела животного (оС) | |||
|
Норма* |
до операции |
во время операции |
сразу после операции | |
|
Опытная |
38,0–39,5 |
38,76± 1,19 |
37,91±1,0 |
37,51±0,88 |
|
Контрольная |
38,77±1,56 |
36,85±2,78 |
36,13±3,79 | |
при этом р <0,05.
*по данным Линевой А. «Физиологические показатели норм животных», 2008
Для наглядности оценки изменений температуры тела животных приведен рисунок 1.
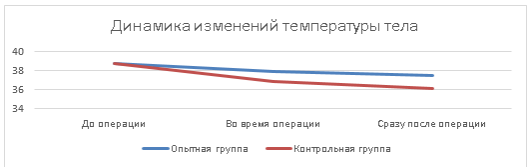
Рис. 1. Динамика изменения температуры тела животных при проведении лапароскопической овариогистерэктомии, где цена промежуточных делений оси абсцисс равна 0,5 оС
Динамика изменения количества сердечных сокращений в течение и после проведения лапароскопической овариогистерэктомии.
По завершении хирургического вмешательства был произведен очередной мониторинг сердечной деятельности организма животных, при этом было установлено, что количество сердечных сокращений у кошек контрольной группы было ниже на 21,02 % относительно такого же показателя у животных группы опыта.
Изменения количества сердечных сокращений у кошек отражены в таблице 2.
Таблица 2
Динамика изменения количества сердечных сокращений при проведении лапароскопической овариогистерэктомии
|
Вид группы животных |
Количество сердечных сокращений (уд/мин) | |||
|
Норма* |
до операции |
во время операции |
сразу после операции | |
|
Опытная |
110–130 |
120,3± 12,65 |
103,8±12,71 |
98,5 ±10,6 |
|
Контрольная |
120,1 ±16,82 |
95,6 ±27,46 |
77,8 ±36,76 | |
при этом р <0,05.
*по данным Линевой А. «Физиологические показатели норм животных», 2008
Для наглядности оценки изменений количества сердечных сокращений у животных приведен рисунок 2.
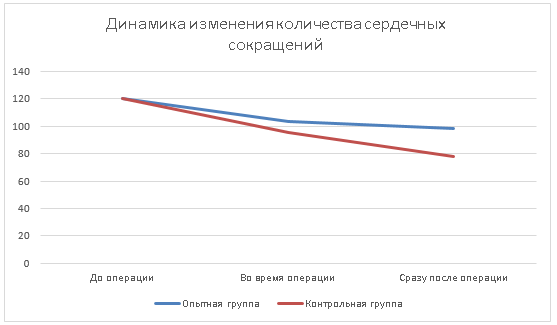
Рис. 2. Динамика изменения количества сердечных сокращений при проведении лапароскопической овариогистерэктомии, где цена промежуточных делений оси абсцисс равна 20 уд/мин
Динамика количества дыхательных движений в течение и после проведения лапароскопической овариогистерэктомии.
Прослеживая изменения частоты дыхательных движений у животных нами было отмечено урежение дыхания животных, что также является естественной реакцией организма на проведение наркоза. Данный показатель у кошек опытной группы находился в пределах физиологических параметров, хотя и имел снижение на 4,4 д. д./мин. При этом в трех случаях дыхание поддерживалось при помощи аппарата искусственной вентиляции легких.
У животных контрольной группы средняя частота дыхательных движений снизилась до 14,7 д. д./мин, а после операции еще на 14,1 %. При этом двое животных погибло к концу оперативного вмешательства. Частота дыхания животных сразу после операции так и не достигла физиологических параметров нормы. Изменения количества частоты дыхательных движений у кошек отражены в таблице 3.
Таблица 3
Динамика изменения частоты дыхательных движений при проведении лапароскопической овариогистерэктомии
|
Вид группы животных |
Количество дыхательных движений (д. д/мин) | |||
|
Норма* |
до операции |
во время операции |
сразу после операции | |
|
Опытная |
16–26 |
21,6±7,51 |
17,2±4,65 |
17,9±5,74 |
|
Контрольная |
19,8±10,0 |
14,7±6,01 |
12,63±8,01 | |
при этом р <0,05.
*по данным Линевой А. «Физиологические показатели норм животных», 2008
Для наглядности оценки изменений частоты дыхательных движений у животных приведен рисунок 3.
В заключении необходимо указать, что при проведении опыта в контрольной группе двое животных погибло, причем они принадлежали к группе брахицефальных пород.
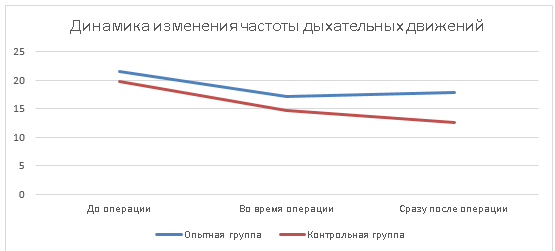
Рис. 3. Динамика изменения частоты дыхательных движений при проведении лапароскопической овариогистерэктомии, где цена промежуточных делений оси абсцисс равна 5 д. д./мин
ВЫВОДЫ:
- Проведение эндоскопической овариогистерэктомии с использованием ингаляционного наркоза, в частности с применением препарата Изофлуран, не приводит к летальному исходу, особенно при стерилизации животных брахицефальных пород. [8]
- При проведении опыта было отмечено снижение температуры тела животных, что является естественной реакцией на наркоз. Однако температура тела животных группы контроля во время проведения операции была на 2,8 % ниже по сравнению с опытной группой. Также был произведен мониторинг сердечной деятельности организма животных, при этом было установлено, что количество сердечных сокращений у кошек контрольной группы после хирургического вмешательства было ниже на 21,02 % относительно такого же показателя у животных группы опыта. Частота дыхательных движений у животных опытной группы на протяжении оперативного вмешательства и после него находилась в пределах физиологических параметров, чего нельзя отметить у кошек группы контроля. В контрольной группе средняя частота дыхания во время операции была ниже на 29,4 % по сравнению с опытной группой.
Литература:
- Жуленко В. Н. Фармакология: учебники и учеб. пособия для студен тов высш. учеб. заведений [Текст] / В. Н. Жуленко, Г. И. Горшков; под ред. В. Н. Жуленко. — М.: КолосС, 2008. — 512 с.
- Итин Г. С. Эколого-фаунистическая характеристика гельминтов лисицы обыкновенной на территории Краснодарского края / Г. С. Итин, В. М. Кравченко // Ветеринария Кубани. – Краснодар, – 2010. – № 3. – С. 17–19.
- Клиническая хирургия в ветеринарной медицине [Текст]: учебное пособие для студентов высших учебных заведений по специальности «Ветеринарная медицина» / Э. И. Веремей, А. А. Стекольников, Б. С. Семенов и др.; под ред. Э. И. Веремея, А. А. Стекольникова. ‒ Минск: ИВЦ Минфина, 2010. ‒ 600 с.
- Кравченко Г. А. Гельминтофауна волка северо-западного Кавказа // Научное обеспечение агропромышленного комплекса. — Краснодар: КубГАУ. 2016. — С. 122–123.
- Кравченко В. М. Зараженность домашних и диких плотоядных Dirofilaria immitis и Dirofilaria repens в различных эколого-географических зонах Краснодарского края / В. М. Кравченко, Г. С. Итин, Д. П. Винокурова // Труды КубГАУ. – № 1. – Краснодар: КубГАУ. 2009. – С. 164-165.
- Кравченко В. М. Патоморфологические изменения у собак и шакалов, вызываемые ассоциацией DIRОFILARIA IMMITIS и DIROFILARIA REPENS/В. М. Кравченко, Г. С. Итин, Д. П. Винокурова // Труды Кубанского государственного аграрного университета. – 2011. – № 32. – С. 166–168.
- Назаров М. В. Разработка и усовершенствование методов коррекции воспроизводительной функции у коров при патологическом течении родов и послеродового периода: Автореф. дисс. д-ра ветеринар. Наук / М. В. Назаров // Ставрополь, 1997. – 50 с.
- Околелова А. И. Фармакология и применение препарата клемацид при лечении кожно-мышечных инфицированных ран у лошадей: автореф. дисс. канд. вет. наук:-Краснодар, 2011. – 24с.
- Особенности этиопатогенеза, диагностики и лечения субинволюции половых органов у коров / М. В. Назаров, Б. В. Гаврилов, В. В. Сиренко, Е. А. Аганин, И. В. Коваль // Труды Кубанского государственного аграрного университета. – 2014. – Т. 1. № 46. – С. 193–194.
- Патент 2190324 Российская Федерация, МПК С2 А 01 J 7/00 Способ стимуляции молочной железы первотелок при машинном доении и устройство для его осуществления/Н. И. Богатырев, М. В. Назаров, Л. А. Дайбова и др.; заявитель и патентообладатель КГАУ. – № 2000110973/13 заявл. 28.04.2000; опубл. 10.10.2002. Бюл. № 28. – 12 с.
- Патент 2299559 Российская Федерация, МПК С2 А01J 7/00 (2006.01) А01J 7/04 (2006.01) Устройство для массажа вымени животных / Н. Н. Курзин, И. А. Потапенко, А. Л. Кулакова и др.; заявитель и патентообладатель КГАУ. – № 2004134316/12 заявл. 24.11.2004; опубл. 27.05.2007. Бюл. № 15. – 4 с.
- Пат. 2156115, Российская Федерация, МПК7 61 D 1/08. Способ электростимуляции мышц матки при патологии в послеродовой период (субинволюции половых органов, атонии и гипотонии матки, эндометритах) у животных и устройство для его осуществления / Н. И. Богатырев, М. В. Назаров, Н. А. Демьянченко. Опубл. 03.06.1999.
- Позябин С. В. Динамика изменения кислотно-основного и газового состава крови при проведении лапароскопических операций у собак [Текст] / С. В. Позябин, Н. И. Шумаков // Ветеринария, зоотехния и биотехнология. ‒ 2014. ‒ № 7. ‒ С. 28–32.
- Позябин С. В. Лапароскопическая хирургия у мелких домашних животных: безопасность и эффективность применения: Опыты на клинически больных домашних собаках [Текст] / С. В. Позябин, Н. И. Шумаков // Ветеринария, зоотехния и биотехнология. ‒ 2014. ‒ № 11. ‒ С. 23–26.
- Позябин С. В. Лапароскопия у мелких домашних животных [Текст]: С. В. Позябин. ‒ М.: Изд-во ФГБОУ ВПО МГАВМиБ, каф. вет. хирургии, 2013. ‒ 34 с.
- Полатайко О. Ветеринарная анестезия: практическое пособие [Текст] / О. Полатайко. — К.: Перископ, 2009. — 408 с.
- Ромбандирова Н. А. Проблемы фальсификации мяса и мясных продуктов // Наука и образование в XXI веке. — Люберцы: АР-Консалт, 2015. — С. 54–55.
- Тимофеев С. В. Общая хирургия животных [Текст] / С. В. Тимофеев, Ю. И. Филипов, С. Ю. Концевая. — М.: Зоомедлит, 2007. — 687 с.
- Уиллард М. Лабораторная диагностика в клинике мелких домашних животных: учебное пособие [Текст] / М. Уиллард, Г. Тведтен, Г. Торнвальд; под ред. Макарова В. В.; пер. с англ. Евелевой Л. И., Пимочкиной Г. Н., Свиридовой Е. В. — изд. 3-е. — М.: Аквариум Бук, 2004. — 430 с.
- Чернов А. В. 700 лапароскопий в ветеринарной практике. Уроки и перспективы: Собаки, кошки, кролики, хорьки; данные за 2006–2011 гг. [Текст] / А. В. Чернов // Российский ветеринарный журнал. Мелкие домашние и дикие животные. ‒ 2012. ‒ № 4. ‒ С. 29–36.
- Чернов А. В. Эндовидеохирургия ‒ новое направление ветеринарной хирургии [Текст] / А. В. Чернов // Российский ветеринарный журнал. Мелкие домашние и дикие животные. ‒ 2012. ‒ № 3. ‒ С. 30–32.
- Хаперский М. В. Ингаляционный наркоз для животных [Электронный ресурс] / М. В. Хаперский, А. А. Перов. — Электрон. текстовые дан. — С.-Пб.: [б. и.], 2013. — Режим доступа: http://vetclinic-if.ru/learnmore/poleznayainformacia/poleznyestatii/ingalyacionnyinarkoz/, свободный.
- Шумаков Н. И. Гематологический мониторинг у собак при проведении лапароскопии в ветеринарной клинике [Текст] / Н. И. Шумаков, С. В. Позябин, П. П. Ершов // Ветеринарная патология. — 2014. — № 1 (47). — С. 87–92.
- Barinskii I. F., Ulasov V. I., Kravchenko V. M., Toloknov A. S., Lycheva I. A., Alimbarova L. M. Combined use of killed vaccines and immunomodulator Ridostin for urgent prevention of epidemic stomatitis, aujeszky disease and carnivore plague in experiment. Problems of virology 2002; 47: 30–2.
- Laparoscopic ovariectomy in dogs: comparison between single portal and two-portal access [Text] / G. Dupre, V. Fiorbianco, M. Skalicky, N. Gultiken, S. S. Ay, M. Findik // Vet/ Surg., 2009. — № 38(7). — 824.
- Hall T. J. Manual of Canine and Feline Endoscopy and Endosurgery [Text] / T. J. Hall. — BSAVA, 2008.

