По скорости поглощения кислорода в среде окисляющегося 1,4-диоксана установлено ингибирующее действие 5-ти замещенных фенолов. Вычислены кинетические параметры торможения реакции в реакции инициированного окисления исходного субстрата.
Ключевые слова: антиоксидант, скорость поглощения кислорода, ионольный эквивалент
Ингибиторы окисления (антиоксиданты) играют важную роль в современной технологии получения полимеров, смазочных материалов, углеводородного топлива, растворителей, полупродуктов органического синтеза и пищевых продуктов. Они также выполняют функцию защиты живых организмов от вредного действия кислорода, света, радиоактивного излучения.
Окисление органических соединений кислородом в жидкой фазе протекает по цепному механизму, при этом в продолжение цепи принимают участие пероксильные радикалы. Поэтому центральное место среди антиоксидантов занимают соединения, способные быстро реагировать с пероксильными радикалами, что приводит к обрыву цепи. Антиоксидантами такого рода являются ингибиторы окисления фенольного типа.
Замещенные фенола являются эффективными ингибиторами по отношению к пероксильным радикалам, ведущими цепи окисления в кинетическом режиме окисления, например, ионол [2].
Цель исследования заключается в исследовании антиоксидантной активности новых пространственно-замещённых фенолов [3].
Для достижения цели исследования были поставлены следующие задачи:
− исследование влияния замещённых фенолов на скорость поглощения кислорода 1,4-диоксаном в инициированном режиме окисления;
− спектрофотометрическое исследование кинетики расходования замещённых фенолов в условиях окисления модельного субстрата;
− определение количественных параметров ингибирования для исследованных замещенных фенолов: стехиометрического коэффициента ингибирования, константы скорости взаимодействия фенолов с пероксильными радикалами субстрата.
Методы исследования.
Манометрический метод поглощения кислорода воздуха.
Антиокислительную активность оценивали по степени снижения начальной скорости поглощения кислорода при окислении модельного субстрата в присутствии замещенных фенолов. Выбор модельной реакции радикально-цепного окисления 1,4-диоксана связан с тем, что при его окислении большой выход пероксильных радикалов и легкая окисляемость субстрата окисления.
В качестве измерительного инструмента использовали универсальную манометрическую дифференциальную установку (УМД).
Установка предназначена для прецизионного измерения в условиях агрессивных сред. Измерительная часть УМД выполнена в виде двух идентичных половин, одна из которых служит эталоном для рабочей половины, что способствует снижению физических шумов. УМД позволяет измерять перепады давления в диапазоне 0–50 мм. рт. ст. [4]. Динамика измерения давления фиксируется в виде аналового сигнала на ленте самописца.
Исследование методом УФ-спектроскопии. УФ-спектры растворов снимали на спектрофотометре UV-2401 PC фирмы SHIMADZU в кварцевых кюветах толщиной 1 см относительно раствора сравнения. Раствор сравнения содержал все компоненты реакционной смеси, кроме замещённых фенолов. Экспериментально определили зависимость величины оптической плотности от длины волны и концентрации добавленного фенола, что позволило вычислить молярный коэффициент поглощения для исследованных 5 замещенных фенолов на максимуме их поглощения.
Кинетику расходования замещенных фенолов от времени реакции окислении 1,4-диоксана в присутствии фенолов изучали при длине волны, при которой замещённый фенол имеет максимум поглощения [5].
Результаты иобсуждение.
Исследовано влияние 5-типространственно-затрудненных фенолов (заместители в 2,4,6 положениях) на окисление 1,4-диоксана. Окисление 1,4-диоксана проводили при температуре 75°С в присутствии классического инициатора окисления — азодиизобутиронитрила (АИБН) [6]. За кинетикой реакции следили по поглощению кислорода на дифференциальной манометрической установке. В отсутствии ингибирующих добавок кинетическая кривая поглощения кислорода имеет линейный вид, порядок реакции по кислороду нулевой, что является подтверждением наличия кинетического режима окисления модельного субстрата [7]. По результатам данных опытов доказано, что параметр окисляемости субстрата совпадает с литературными данными [8].
Введение в реакционную смесь исследуемых веществ приводит к снижению начальной скорости окисления модельного субстрата вследствие обрыва цепи на молекулах по реакции (7) [RO2 +InHIn + ROOH], очевидным доказательством этого является изменение вида кинетических кривых поглощения кислорода в присутствии добавок образцов обсуждаемых веществ.
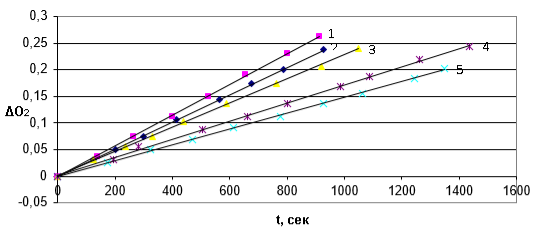
Рис. 1. Кинетические кривые поглощения кислорода 1,4-диоксаном в присутствии добавок фенола (1). [InH]: 1-0; 2-0,1310–4 моль/л; 3- 0,38 10–4 моль/л; 4-0,6310–4 моль/л; 5-1,310–4 моль/л
Была определена зависимость между величиной скорости поглощения кислорода и концентрацией замещённого фенола. Данная зависимость спрямляется в координатах формулы 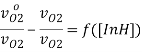 , что позволило вычислить эффективную константу ингибирования.
, что позволило вычислить эффективную константу ингибирования.
По опытам, проведённым ранее, установлен стехиометрический коэффициент ингибирования, который равен двум. Следует отметить, что для данного класса ингибиторов характерна гибель двух радикалов на одной молекуле ингибитора.
Следующим этапом работы было слежение за кинетикой расходования добавленных замещенных фенолов реакции окисления 1,4-диоксана по спектрам поглощения в коротковолновой области спектра.
Для исследованных соединений установили максимумы поглощения, находящиеся в области 276–284 нм. Для каждого производного фенола установлена линейная зависимость между величиной оптической плотности и концентрацией добавленного замещенного фенола, которая позволила вычислить молярные коэффициенты поглощения, находящиеся в пределах (2,31–4,84)·104 л/моль·см.
В кинетическом режиме окисления исследовали влияние изученных замещенных фенолов на инициированное окисление 1,4-диоксана. В специальных опытах установлено, что оптическая плотность без добавок инициатора остается постоянной. Таким образом, добавленные фенолы термически стабильны при температуре опыта, они расходуются только в режиме окислительного процесса [9]. В кинетических опытах в присутствии инициатора окисления оптическая плотность уменьшается, что подтверждает расходование добавленных производных фенола. Кинетические кривые расходования фенолов спрямляются в координатах реакции первого порядка, что позволило вычислить удельные скорости расходования фенолов. В стационарном режиме окисления по величине удельной скорости расходования фенолов, определили константу скорости реакции взаимодействия пероксильных радикалов 1,4-диоксана с молекулой замещенного фенола; она находится в пределах (1,1–22)·103 л/моль·с. Константа скорости реакции взаимодействия пероксильных радикалов 1,4-диоксана с молекулой ингибитора сравнена с таковой величиной для классического ингибитора — ионола, т.н. ионольный эквивалент (ИЭ) [10].
|
Фенол |
1 |
2 |
3 |
4 |
5 |
|
kрасх.InH, сек-1 |
4,2∙10–4 |
1,1∙10–4 |
5,3∙10–5 |
1,5∙10–5 |
1,4∙10–5 |
|
k7, л/моль*с |
(2,2±0,2)∙104 |
(7,2±0,2)∙103 |
(3,8±0,1)∙103 |
(1,1±0,3)∙103 |
(2,2±0,1)∙103 |
|
ИЭ |
0,95 |
0,33 |
0,14 |
0,05 |
0,1 |
По величине ИЭ исследуемые фенолы располагаются в ряд: ИЭ (1) > ИЭ (2) > ИЭ(3) > ИЭ(5)> ИЭ(4).
Заключение.
В соответствии с определенными кинетическими параметрами ингибирования установлено, что замещенный фенол 1 проявляет ингибирующее действие в реакции окисления модельного субстрата 1,4-диоксана на уровне классического ингибитора окисления ионола, остальные изученные фенолы являются более слабыми ингибиторами. Стехиометрический коэффициент ингибирования изученных фенолов равен двум, что характерно для данного класса ингибиторов.
Литература:
- Касаикина О. Т., Кортенска В. Д. Ингибирующая активность природных фенольных антиоксидантов в процессах окисления липидных субстратов // Изв. РАН. Сер. хим. — 1997. — T. 6. — № 8. — C. 1083–1092.
- Е. Т. Денисов, В. В. Азатян. Ингибирование цепных реакций. Черноголовка: ИХФЧ РАН, 1997. 266 с.
- Фомин В. М. Радикально-цепное окисление органических соединений и его торможение ингибиторами фенольного типа: электр. учеб. пособие. Нижний Новгород, 2010. С. 5–37.
- Эммануэль Н. М., Денисов Е. Т., Майзус З. К. Цепные реакции окисления углеводородов в жидкой фазе. М.: Наука, 1965. С. 99–116.
- Чакчир Б. А., Алексеева Г. М. Фотометрические методы анализа: Методические указания. СПб.: Изд-во СПХФА, 2002. 44 с.
- Денисов Е. Т. Механизмы гомолитического распада молекул в жидкой фазе // Итоги науки и техники. Сер. Кинетика и катализ. М.: ВИНИТИ, 1981. Т.9. 158 с.
- Денисов Е. Т. Элементарные реакции ингибиторов окисления. // Успехи химии — 1973. — Т. 42. — № 3. — 361 с.
- Денисов Е. Т. Константы скорости гомолитических жидкофазных реакций. – М.: Наука, 1971. — 711 с.
- Денисов Е. Т., Денисова Т. Г. Реакционная способность природных фенолов. // Успехи химии — 2009. Т. 78. — № 11.
- Денисов Е. Т., Мицкевич Н. И., Агабеков В. Е. Механизм жидкофазного окисления кислородсодержащих соединений. Минск: Наука и техника, 1975. 335 c.

