Работа посвящена изучению термодинамических функций процесса гидроочистки синтеза акролеина. На примере основной реакции газофазного окисления пропилена воздухом, рассчитаны зависимости энтальпии, энергии Гиббса и константы равновесия от температуры в температурном интервале проведения процесса 593–623 К. Полученные результаты позволили сделать выводы об оптимальных условиях проведения процесса, а также выбрать тип реактора.
Ключевые слова: термодинамический анализ, энтальпия, энергия Гиббса, синтез полупродукта для получения метионина, кожухотрубный каталитический реактор.
В современной химии происходит постоянное добавление все новых экспериментальных данных о параметрах реакций, термодинамических свойствах веществ и условиях проведения множества реакций. Эти данные позволяют без проведения реакции определить тепловой эффект, направление протекания реакции, равновесие реакции и другие термодинамические параметры для огромного числа реакций, что позволяет изучить не только трудоемкие и дорогостоящие реакции, но и реакции, проведение которых зачастую недоступно. Такие расчеты позволяют дать сравнительную оценку аналогичным реакциям и найти оптимальные условия проведения процесса.
В то же время, подавляющее число процессов в химической технологии осуществляют в реакторах, которые являются главными элементами в химической тех схеме производства любого целевого продукта [1, с. 132].
Поэтому, сделав расчет химической термодинамики и определив зависимости термодинамических функций от температуры, можно подобрать оптимальные условия проведения процесса синтеза и подобрать реактор для проведения данного процесса.
Рассматриваемой реакцией является синтез акролеина. Акролеин — простейший ненасыщенный альдегид этиленового ряда. Акролеин применяется в промышленности в основном для получения метионина (аминокислота, добавка которой в корм домашней птицы ускоряет ее рост). Целевой продукт токсичен (пары его сильно раздражают слизистые оболочки глаз и дыхательных путей).
Основной является каталитическая реакция, осуществляемая в парогазовой фазе, на основе газообразного пропилена и воздуха в присутствии водяного пара:
СН2 = СН ––СН3 + О2 → CH2 = CH––CHO + H2O
Кроме неё протекают побочные реакции:
С3Н6 + 4,5О2 → 3CO2 + 3H2O
С3Н6 + 3О2 → 3CO + 3H2O
Все три реакции необратимы и протекают одновременно. Реакция окисления пропилена протекает при температуре 320–350 °С и давлении 0,3 до 2 МПа. Реакция каталитическая. Состав исходной смеси ограничивается пределами взрывоопасных концентраций. [2 с. 338].
На основании справочных данных по стандартным значениям были рассчитаны зависимости следующих термодинамических функций: энтальпии (∆Н), энергии Гиббса (∆G) и константы равновесия (Кр), которые представлены на рисунках 1, 2, 3. Термодинамические расчеты проводились в интервале температур 593–623°К с шагом изменения температуры 5°К. Это даст нам наиболее полное представление об изменении термодинамических параметров с ростом температуры. Расчет проводился по методикам [3–5].
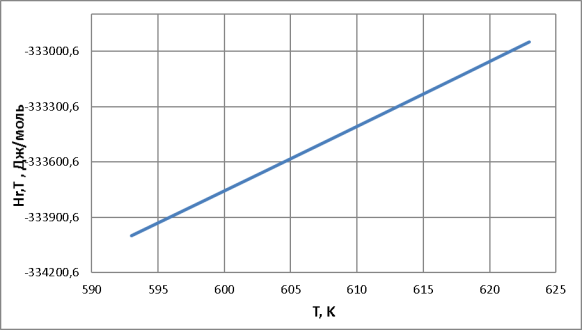
Рис. 1. Зависимость изменения теплового эффекта реакции от температуры
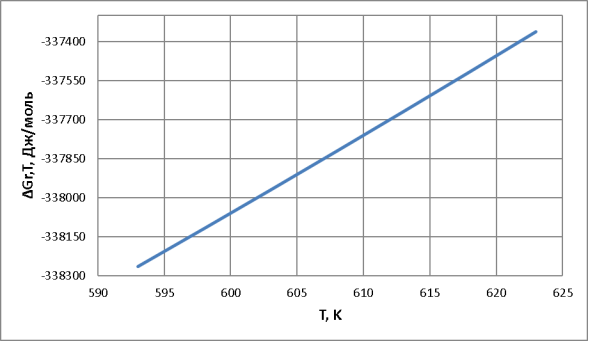
Рис. 2. Зависимость изменения энергии Гиббса от температуры
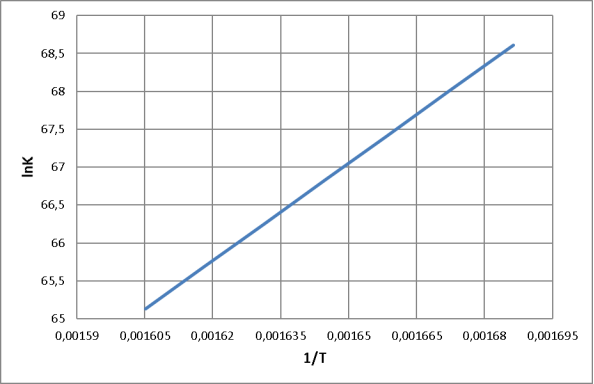
Рис. 3. Зависимость натурального логарифма константы равновесия от обратной температуры
На основании проведенных расчетов можно сделать ряд выводов.
– Так как ∆Н<0, тепловой эффект реакции отрицательный, что говорит об экзотермичности реакции, т. е. реакция идет с выделением тепла, и, согласно принципу Ле-Шателье, сдвигать равновесие в сторону образования продуктов можно за счет охлаждения системы.
– Из значений константы равновесия и ∆G (по графику) видно, что во всем интервале температур равновесие смещено в сторону прямой реакции. В то же время, в соответствии с уравнением![]() т. е. с ростом температуры Кр уменьшается, а значит, равновесие смещается в сторону обратной реакции.
т. е. с ростом температуры Кр уменьшается, а значит, равновесие смещается в сторону обратной реакции.
– Константа равновесия больше единицы. Это означает, что равновесие смещено вправо, т. е. в сторону получения целевого продукта, причем с увеличением температуры константа равновесия Кр снижается, что также говорит об экзотермичности процесса.
Из проведенных расчетов следует, что поскольку реакция высоко экзотермическая, а температурный интервал проведения процесса синтеза не велик, следует, что данный процесс необходимо вести при очень точном отводе тепла, дабы избежать повышенного выхода побочных продуктов и быстрого выхода из строя дорогостоящего катализатора.
Таким образом, на основании анализа рассчитанных термодинамических функций и литературных данных по данному процессу, оптимальным аппаратом для проведения исследуемого процесса будет являться кожухотрубный реактор с неподвижным слоем катализатора в трубном пространстве и отводом тепла из межтрубного пространства посредством расплава соли теплоносителя, например расплав смеси натриевой соли азотистой кислоты и калиевой соли азотной кислоты, состава:
– массовая доля нитрита натрия NaNО2 47 %,
– массовая доля нитрата калия KNO3 53 %.
Обычно соли для расплава берут в практически равном отношении из расчета на массовые доли.
Соль циркулирует между реактором и охладителем, где она потом охлаждается котловой водой. [6, с. 164].
Литература:
- Попов Ю. В. Химические реакторы: учебное пособие / Ю. В. Попов, Т. К. Корчагина, В. А. Панчехин; ВолгГТУ. — Волгоград, 2013. — 240 с.
- Лебедев, Н.Н. «Химия и технология основного органического и нефтехимического синтеза» М.: Химия, 1998. — 592 с.
- Киреев В. А. Методы практических расчетов в термодинамике химических реакций / В. А. Киреев. — М.: Химия, 1975. — 536 с.
- Джон Г. Перри. Справочник инженера-химика: В 3 т. / Пер. с англ.; под ред. Жаворонкова Н. М. — Т.1. — Л.: Химия, 1969. — 640 с.
- Равделя, A. A. Краткий справочник физико-химических величин: учеб. пособ. / под ред. A. A. Равделя и А. М. Пономаревой. — 9-е изд. — СПб.: Специальная Литература, 1998. — 232 с.
- Основные процессы и аппараты химической технологии: Пособие по проектированию. Под ред. Дытнерского, 2-е изд. М.: Химия, 1991. — 496 с.

