Для проверки возможности окисления винилморфолина (ВМ) и винилпиридина (ВП) в используемых протолитических средах и установления области потенциалов, наиболее подходящей для успешного проведения амперометрического титрования ионов металлов, были сняты анодные вольтамперограммы растворов выше указанных электроактивных веществ на различных по природе фонах, при числе оборотов дискового микроанода, равном 1085 об/мин [1].
На основании полученных экспериментальных данных установлено, что ВМ и ВП окисляясь на платиновом микроаноде дают вольтамперные кривые с четко выделенной площадкой предельного тока, начинающегося при потенциалах значения которых представлены в таблице.
Таблица
Значения потенциалов полуволн (E1/2) окисления ВМ иВП (2·10–4 моль/л) на платиновом микроаноде растворах
|
Протолитический растворитель |
Природа концентрация фонового электролита, моль/л |
Потенциал полуволн, В | ||
|
ВМ |
ВП | |||
|
Уксусная кислота |
CH3COOK |
0,25 |
0,96 |
0,93 |
|
LiNO3 |
0,15 |
1,08 |
1,21 | |
|
LiClO4 |
0,20 |
1,24 |
1,41 | |
|
LiClO4+HClO4 |
0,20 +0,07 |
1,39 |
1,53 | |
|
н-пропанол |
CH3COOK |
0,25 |
0,86 |
0,97 |
|
LiNO3 |
0,15 |
0,92 |
1,03 | |
|
LiClO4 |
0,20 |
1,13 |
1,19 | |
|
LiClO4+HClO4 |
0,20 +0,07 |
1,21 |
1,24 | |
|
ДМФА |
CH3COOK |
0,25 |
0,65 |
0,81 |
|
LiNO3 |
0,15 |
0,73 |
8,89 | |
|
LiClO4 |
0,20 |
1,04 |
1,13 | |
|
LiClO4+HClO4 |
0,20 +0,07 |
2,26 |
1,24 | |
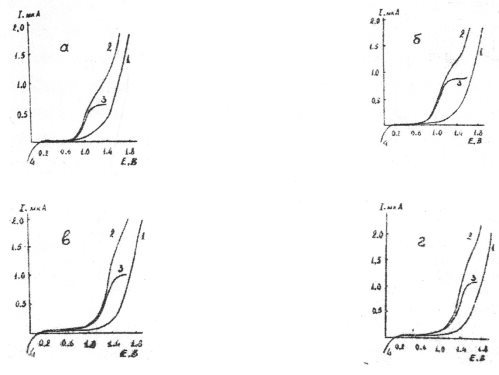
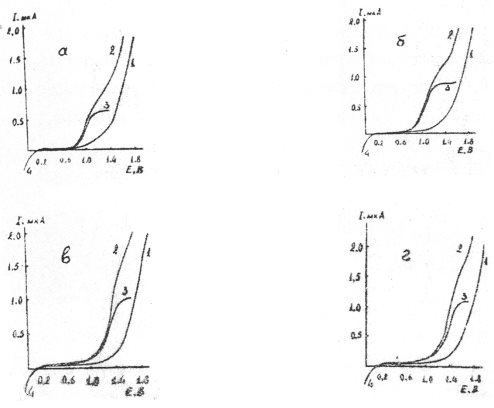
На рис. 1 и 2 иллюстрированы кривые вольтамперограммы ВМ на различных по кислотно-основным свойствам фоновых электролитах в н-пропаноле и ДМФА. Смесь хлорной кислоты и перхлората лития была использована в качестве фонового электролита для эффективного повышения избирательности амперометрического титрования ионов металлов.
Как видно из рис. 1 и 2, изученные реагенты в безводной уксусной кислоте, н-пропаноле и ДМФА на всех фоновых электролитах, а также в смеси перхлората лития и хлорной кислоты резко отличающихся по степени кислотности дают достаточно хорошо выраженные анодные волны.
|
|
Рис. 1. Анодные вольтамперограммы ВМ на платиновом дисковом микроаноде в н-пропаноле на фонах 0,25 М по ацетату калия (а); 0,15 М по нитрату лития (б); 0,20 М по перхлорату лития (в) и смеси 0,20 М перхлората лития и 0,07 М хлорной кислоты (г). 1-ток фона; 2-волна окисления реагента, неисправленная на ток фона; 3-волна окисления реагента, исправленная на ток фона; 4 волна восстановления кислорода
На фоне нитрата лития вольамперограммы реагентов имеет приблизительно такую же форму, как и на перхлорате лития, но E1/2 смешен в сторону менее положительных значений потенциалов приблизительно на 0,12–0,28 В. Эксперименты показали, что при переходе от ацетата калия, проявляюшего в протолитических средах свойства сильного основания, к фоновым электролитам с постепенно увеличивающимися кислыми свойствами (перхлорат лития), E1/2 смешается в сторону более положительных значений. Для наиболее сильно различающихся по степени кислотности фонов: ацетата калия и смеси перхлората лития с хлорной кислотой величина смещение (∆E1/2) достигает 0,35–0.45 В. Высота волны для одной и той же концентрации деполяризатора также зависит от природы фонового электролита: при переходе от менее к более кислотным электролитам она заметно увеличивается.
Как установлено, при меньших значениях кислотности среды (до достижения оптимального напряжения) предельный ток окисления деполяризатора выражен менее ярко, а при более высоких же ее концентрациях предельный ток становится четко выраженным, что связано с недостаточно полным окислением на электроде недиссоциированной молекулы реагента, стабилизирующейся при малой кислотности среды. Обнаруженный факт позволяет предположить еще раз, что в менее кислых растворах на положительной поверхности электрода окисляется не сама молекула, а анион реагента.
|
|
Рис. 2. Анодные вольтамперограммы ВМ на платиновом дисковом микроаноде в ДМФА на фонах 0,25 М по ацетату калия (а); 0,15 М по нитрату лития (б); 0,20 М по перхлорату лития (в) и смеси 0,20 М перхлората лития и 0,07 М хлорной кислоты (г). 1-ток фона; 2-волна окисления реагента, неисправленная на ток фона; 3-волна окисления реагента, исправленная на ток фона; 4 волна восстановления кислорода
Прямо пропорциональная зависимость между величиной предельного тока и концентрацией реагентов в изученных неводных растворителях и фоновых электролитах достаточно хорошо соблюдается не только в области предельного тока, но и при любом оптимальном потенциале платинового электролита в диапазоне 0,35–1,95 В. Это особенно наглядно видно из рис.1 на котором изображены графики зависимости предельного тока окисления ВМ от ее концентрации в исследуемом растворе на фонах 0,25 М по ацетату калия в уксусной кислоты. Из него также видно, что эта зависимость во всех случаях носит линейный характер вплоть до концентрации деполяризатора порядка n·10–3М. однако, при при более высоких ее концентрациях наблюдается отклонение от линейности и сила предельного тока начинает асимптотически приближаться к некоторому постоянному значению.
Подводя итог изучению вольтамперных кривых окисления ВМ и ВП на различных по кислотно-основным свойствам фоновых электролитах в анодной области поляризации платинового микроанода в различных по природе протолитических растворителях, можно заключить, что вольтамперограммы изученных реагентов схожи с вольтамперными кривыми, снятыми в кислых водных средах при рН 4 [2,3]. Однако, анодные волны их в неводных средах отличаются от вольамперных кривых, снятых в водных средах, прежде всего тем, что они располагаются в области более положительных потенциалов. Кроме того, при повышении кислотности фонового электролита высота волн деполяризаторов в изученных протолитических средах монотонно возрастают и не проходят через резко выраженный максимум, как в случае водных растворов.
Литература:
- Я.Гейровский, Я.Кута Основы полярографии. М.: Мир. — 1965. — 559 с.
- Геворгян А. М. и др. Электропроводность неводных и смешанных растворов, содержащих ионы металлов. Деп. В ГФНТИ ГКНТ РУз, № 1873 — Уз 93. -1993. — 9 с.
- Геворгян А. М. и др. Влияние добавок инертных растворителей на электропроводность неводных и смешанных сред. Деп. В ГФНТИ ГКНТ РУз, № 1872 — Уз 93. -1993. -13 с.