Для изучения взаимной системы KCI + NH4NO3 = KNO3 + NH4CI необходимо знание двойных систем H2O — KCI, H2O — NH4NO3, H2O — NH4CI, H2O — KNO3 и тройных систем KCI + NH4NO3 — H2O, NH4NO3 — NH4CI — H2O, KCI — KNO3 — H2O, NH4CI — KNO3 — H2O, сведение о которых подробно дано в литературных источников [1].
Система NH4NO3 — H2O. Кривая растворимости нитрата аммония слагается из четырех ветвей. Пологая ветвь кристаллизации льда простирается до криогидратной точки, лежащей при- 16,7 и 42,8 % NH4NO3 по весу. В этой точке берет свое начало ветвь кристаллизации £- модификации нитрата аммония NH4NO3•£, выделявшегося из растворов до концентрации 49,4 NH4NO3 по весу, где при температуре -9,8ºС лежит переходная точка в β-модификацию нитрата аммония NH4NO3• β, который простирается до 71,3 % по весу при температуре 32,5 ºС. Начиная с этой точки в системе кристаллизуется γ- модификация нитрата аммония NH4NO3• γ. Данные по растворимости приведены в справочниках.
Система KCI-H2O. Растворимость хлористого калия изучена многими авторами [2]. Согласно этим данным система изучена при температурах от полного замерзание до 80ºС. Определена состав и температура кристаллизации 15 фигуративных точек системы. Установлен количественный состав жидкой фазы и соответствующие им равновесных твердых фаз (таблица) на основе полученных данных построена диаграмма растворимости бинарной системы хлористый калий-вода. Из приведенных данных видно что, хлористый калий хорошо растворим в воде.
Система KNO3-H2O. Растворимость нитрата калия в воде изучена рядом авторов. Согласно этим данным кривые растворимости нитрата калия в воде характеризуется наличием двух ветвей, отвечающих за образование кристаллизации льда и нитрата калия.
Растворимость нитрата калия в воде изучены многими авторами при температурах от полного замерзания растворов до 80ºС. Определены состав и температура кристаллизации 17 фигуративных точек системы. Установлены качественный и количественный состав жидкой фазы и соответствующие им равновесные твердые фазы
Система NH4CI-H2O. Растворимость хлористого аммония изучена многими авторами. Растворимость хлористого аммония изучена от эвтектической точки до 80ºС. Хлористый аммоний, хорошо растворим в воде [3].
На основе производства нитрата калия конверсионным способом лежит физико-химические свойства многокомпонентных водных систем хлорид-нитратного типа. Наиболее важным из него является четверная взаимная система из хлоридов и нитратов калия и аммония и составляющих их тройных систем.
Система KNO3 — NH4NO3 — H2O изучена различными авторами. На диаграмме растворимости этой системе разграничены поля кристаллизации льда, нитратов аммония, калия и комплексного соединения 3KNO3·NH4NO3. Указанные поля сходятся трех тройных и пяты двойных узловых точках системы, для которых определены составы равновесного раствора и соответствующие им температуры кристаллизации.
Тройная система NH4CI — KNO3 — H2O было объектом исследований ряда авторов. Установлено, что химическое взаимодействие между компонентами системы отсутствует. В качестве кристаллической фазы в системе существует лед, KNO3 и NH4CI. В рассматриваемой системе поле кристаллизации нитрата калия заметно увеличивается при возрастании температуры, а поле кристаллизации хлористого аммония незначительно изменяется. Поэтому состав эвтонического раствора с повышением температуры значительно обогащается нитратом калия при одновременном снижении содержания нитрата калия. Компоненты системы оказывает высаливающее действие друг на друга, которое возрастает по мере увеличения температуры. Следует отметить, что нитрат калия оказывает в большей степени высаливающее действие на хлористый аммоний. При увеличение концентрации нитрата калия в системе выше 10 % растворимость хлористого аммония начинает уменьшатся.
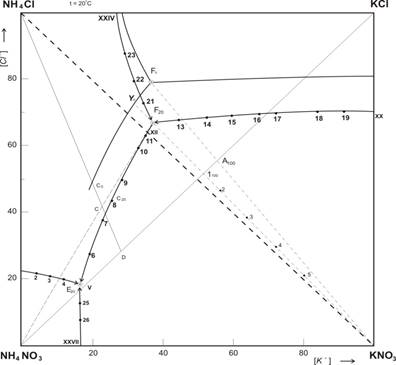
Рис. 1. Изотермическая диаграмма растворимости системы K+; NH4+ // CI–; NO3– H2O при 20 ºС.
Поведение компонентов в системе KCI — NH4CI — H2O изучена в интервале температур — 20–100°С [4]. При этом установлено, что химическое взаимодействие между компонентами системы отсутствует. Система относится простому эвтоническому типу, компоненты системы оказывают взаимное высаливающее действие друг на друга. Хлорид аммония оказывает возрастающее с ростом температуры высаливающее действие на хлорид калия. В то время как, в присутствии хлорида аммония растворимость хлорида калия при температурах 0; 10; 20; 30; 40; 50°С понижается в эвтонических растворах соответственно, 11,6; 12,6; 14,0; 14,8; 15,3; 15,6 % по сравнение с его первоначальной растворимостью в воде, а в присутствии хлорида калия растворимость хлорида аммония незначительно понижается при температурах 0; 10; 20; 30; 40; 50°С этот показатель соответственно составляет 3,4; 3,6; 3,8; 4,7; 4,9; 5,2 % по сравнению с его первоначальной растворимостью в воде.
Тройная система NH4NO3 — NH4CI — H2O, являющиеся составной частью взаимной водной системы K+; NH4+ // CI–; NO3– — H2O изучена при температурах -20до 190°С. Система простого эвтонического типа, без образования нового химического соединения. С повешением температуры расширяется ветвь кристаллизации хлорида аммония, а нитрата аммония наоборот сужается.
Четверная система K+; NH4+ // CI–; NO3– — H2O. Технологическая основа получения нитрата калия конверсией хлорида калия с нитратом аммония базируется на физико-химических свойствах четверной взаимной водной системы из хлоридов и нитратов калия, аммония и ее составляющих тройных систем.
Четверная система K+; NH4+ // CI–; NO3– — H2O состоит из четырех тройных водных систем.
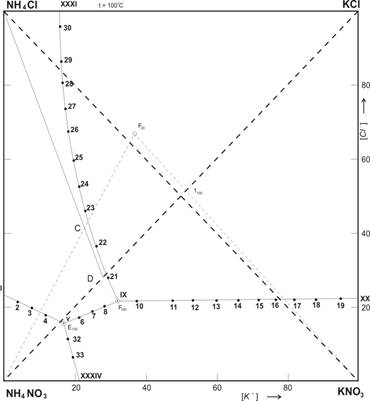
Рис. 2. Изотермическая диаграмма растворимости системы K+; NH4+ // CI–; NO3– H2O при 100 ºС.
Как видно из рисунках 1 и 2 — площадь диаграммы растворимости четверной взаимной системы K+; NH4+ // CI–; NO3– — H2O при 20 и 100 ºС разбита линиями раздела на четыре поля кристаллизации твердых фаз. Поле, разграниченное узловыми точками I — VI — XXIV, соответствует кристаллизации нитрата аммония. Точка VI- является тройной и отвечает совместной кристаллизации нитратов аммония и калия с хлоридом аммония. Втрое поле между точками VI- XII- XX- XXIV занимает наибольший объем при 20ºС, а наименьшей объем при 100ºС и соответствует выделению в твердую фазу нитрата калия. Третье поле принадлежит хлориду аммония, которое отделено от полей других солей точками VII- XII-XXIV. Четвертое поле, занимающие основную часть диаграммы 100ºС, находится между одной изотермическими нонвариантными (XII) и двумя моновариантными (XX-XXIV) точками и указывает на кристаллизацию хлорида калия. Таким образом, в четверной взаимной системе K+; NH4+ // CI–; NO3– — H2O при 20 и 100ºС образование новых соединений не наблюдается. Сопоставление данных изотерм показывает, что при переходе от 20ºС и 100ºС размеры полей исходных веществ изменяются, с повышением температуры поля насыщения нитратов резко уменьшаются, следовательно, растворимость нитратов повышаются. Кристаллизация нитратов калия при 100ºС несколько раз меньше чем при 20ºС. Полы кристаллизации хлорида калия при температуре 100ºС резко увеличивается по сравнению с полем кристаллизации его при 20ºС за счет уменьшения поля кристаллизации нитрата калия, по этом растворимость нитрата калия в несколько раз увеличивается и подобный раствор при охлаждение может выделят эту соль в осадок.
Литература:
1. Соколовский А. А., Яхонтова Е. Л. Применение равновесных диаграмм растворимости в технологии минеральных солей. — М.: Химия, 1982. -264с.
2. Вязавова В. В. Справочник по растворимости солевых систем. Л.: Госхимиздат,1980. — 86с.
3. Коган В. Б., Огородников С. К., Кафаров В. В. Справочник по растворимости. Наука, 1970. — 506с.
4. Методы анализа рассолов и солей / под ред. Морачевского Ю. В. и Петровой Е. М., ВНИИГаллургии. Химия, 1985. 404с.

