Калийно-аммиачная селитра, выпускаемая в довольно значительном количестве в ряде зарубежных стран, содержит 16–16,5 % N и 25 % К2О. Ее изготавливают следующими способами:
1) механическим смешением сухих или увлажненных нитрата аммония и хлорида калия;
2) совместным выпариванием растворов нитрата аммония и хлорида калия;
3) введением в концентрированный раствор или плавь аммиачной селитры тонкоизмельченного хлорида калия с последующим гранулированием плава в грануляционных башнях. Последний способ представляет наибольший интерес, так как позволяет получить более однородное по составу удобрение [1].
При получении калийно-аммиачной селитры по любому способу в той или иной мере протекает реакция обменного разложения:
КС1 + NH4N03 = KNO3 + NH4CI
Получаемый продукт содержит тесно сросшиеся кристаллы KNO3 и NH4C1. В результате образования KNO2 — почти не гигроскопичной соли, — калийно-аммиачная селитра имеет лучшие физические свойства, чем чистый нитрат аммония.
В зависимости от условий приготовления калийно-аммиачная селитра содержит различное количество KNO3. При механическом смешении увлажненных компонентов (2 % влаги) образуется около 7 % KNO3, в случае совместного выпаривания растворов нитрата аммония и хлорида калия реакция образования KNO3 протекает почти нацело.
При смешении плава аммиачной селитры, состоящего из 45 вес. ч. нитрата аммония и 5 вес. ч. воды, с 55 вес. ч. размолотого хлорида калия, около 88 % нитрата аммония превращается в KNO3. При этом получается сухое рассыпчатое удобрение, которое не слеживается и легко рассеивается.
Производство нитрата калия конверсионным способом основано на обменном разложении:
NH4NO3 + KCl = KNO3 + NH4C1
Диаграмма растворимости в системе NH4NO3 + KCl = KNO3 + NH4Cl показывает, что поле кристаллизации KNO3 сильно увеличивается при понижении температуры. Поэтому легко подобрать условия, обеспечивающие кристаллизацию большей части KNO3 при охлаждении концентрированного раствора, полученного смешением NH4NO3 и КСl. Использование этого способа затрудняется необходимостью после выделения KNO3 выпаривания раствора хлористого аммония, интенсивно разрушающего выпарные аппараты. Кроме того, потребность в хлористом аммонии относительно невелика, как удобрение хлористый аммоний имеет весьма ограниченное применение.
Изучено [2] взаимодействие нитрата аммония (NH4NO3), плава карбамида (CO(NH2)2) с хлоридом калия (KCI). Исследование проводили методом дифференциально-термического анализа (ДТА) от комнатной температуры до 400°С. Приготовлены механические смеси NH4NO3, CO(NH2)2, и KCI в различных соотношениях исходных компонентов, которые затем расплавляли на специальной установке. Температура плавления смесей была ниже по сравнению с температурой плавления исходных компонентов и составляла 80°С. Дериватограммы образцов с соотношением компонентов 1:1:1: и 1:3:1 (соотношение N:K 1:1) показали их стабильность вплоть до начала температуры плавления 75°С. Отсутствие фазовых переходов нитрата аммония IV ↔ III ↔ II объясняется образованием твердого раствора в системе нитрата аммония, нитрата калия (образующегося в плаве в результате обменной реакции между нитратом аммония и хлоридом калия) и образованием эвтектики в системе нитрата аммония-карбамид, что хорошо согласуется с литературными данными.
Физико-химической основой процесса конверсии послужила диаграмма растворимости системы K+; NH4+ // CI–; NO3– — H2O, из которой следует, что конверсия начинается при введении в систему насыщенного нитрата аммония и хлорида калия. Максимальной конверсии можно достичь лишь при повышенных температурных условиях.
Для исследования использовали кристаллический нитрат аммония и хлорид калия. Опыты проводили в круглодонной колбе, снабженной мешалкой, в которую загружали 7,11г KCl, 6,59г NH4NO3 и 11,30г H2O. Колбу с раствором помещали в термостат с заданной температурой и интенсивно перемешивали. Через определенный промежуток времени проводили анализы химического состава жидкой и твердой фаз. Из результатов анализов следует, что степень конверсии зависит от температуры и увеличивается с ее ростом [3].
Процесс в основном заканчивается в течение 60 минут, при этом степень конверсии при 50, 75 и 100 °С составляет соответственно 66,0, 74,8 и 95,6 %. Дальнейшее увеличение продолжительности процесса практически не приводит к повышению степени конверсии. При 100 °С выход по калию достигает 55,53 %.
Таблица
Зависимость степени конверсии нитрата аммония с хлоридом калия от температуры и продолжительности процесса
|
Температура, °С |
Время, мин |
Степень конверсии, % |
Содержания, нитрата калия в жидкой фазе, % |
|
50 |
30 |
45,6 |
40,41 |
|
50 |
60 |
66,0 |
48,81 |
|
50 |
90 |
67,2 |
49,48 |
|
75 |
30 |
50,8 |
43,56 |
|
75 |
60 |
74,8 |
51,66 |
|
75 |
90 |
75,0 |
53,82 |
|
100 |
30 |
80,9 |
54,00 |
|
100 |
60 |
95,6 |
58,76 |
|
100 |
90 |
96,3 |
59,14 |
Из таблицы видно, что температура и время конверсии нитрата калия из хлорида калия и нитрата аммония играет ключевую роль. При температуре 500С степень конверсии составляет в 30 мин 45,6 %, в 60 минут конверсия 66 % и 90 минут конверсия 67,2 %. При такой температуре проведение конверсии не дает экономический эффект. При температуре 750С степень конверсии составляет в 30 мин конверсии 50,8 %, в 60 минут конверсии 74,8 % и 90 минут конверсии 75 %. Здесь можно увидеть положительное влияние температуры на конверсию. При температуре 1000С степень конверсии составляет в 30мин конверсии 80,9 %, в 60 минут конверсии 95,6 % и 90 минут конверсии 96,3 %. Анализируя эти данные, можно сделать вывод, что получение нитрата калия в промышленных масштабах вполне приемлемо и нитрат калия имеет большой спрос как на отечественном, так и на зарубежном рынках.
Физико-химические свойства готовой продукции.
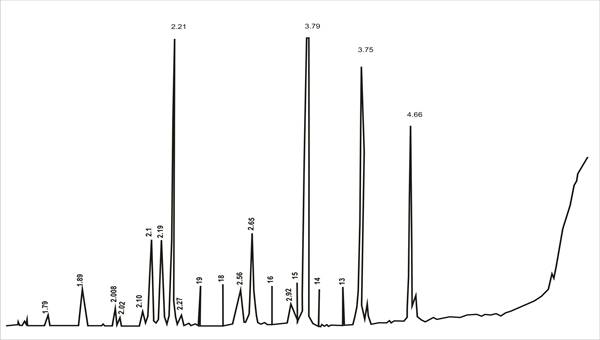
Рис. 1. Рентгеновская дифрактограмма нитрата калия, полученного конверсией хлорида калия с нитратом аммония
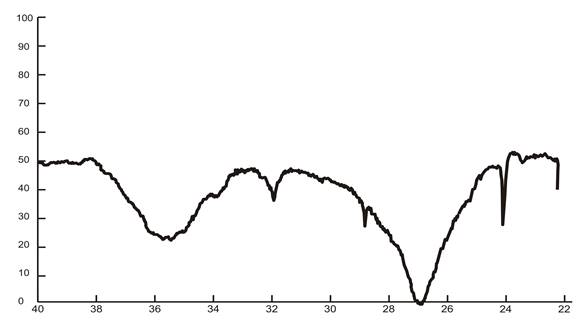
Рис. 2. ИК-спектр нитрата калия, полученного конверсией хлорида калия с нитратом аммония
На рис. 1 и 2 представлены дифрактограммы и ИК-спектры нитрата калия.
По лабораторным данным разработана принципиальная блок-схема технологии производства нитрата калия и составлен материальный баланс на производство 1-ой тонны нитрата калия конверсионным методом.
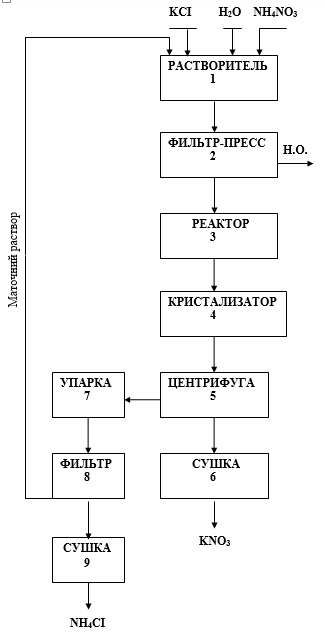
Рис. 3. Принципиальная блок-схема технологии производства нитрата калия конверсионным методом
Технологическая схема получения нитрата калия включает следующие операции:
1. Растворение хлористого калия в горячем растворе.
2. Фильтрация полученного раствора в целях отделения нерастворимых примесей.
3. Обменное разложение между KCI и NH4NO3 с получением раствора KNO3.
KCI + NH4NO3 = KNO3 + NH4CI.
4. Охлаждение полученного раствора в целях кристаллизации нитрата калия.
5. Отделение кристаллов нитрата калия методом центрифугирования.
6. Сушка полученного нитрата калия.
7. Маточный раствор после отделения нитрата калия подвергается упарке с целью отделения от маточника хлорида аммония.
8. Выделение из маточного раствора выпавших кристаллов NH4CI.
9. Сушка выделенного хлорида аммония.
Материальный баланс получения нитрата калия из хлорида калия и нитрата аммония
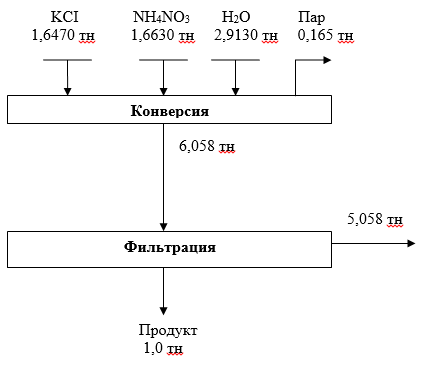
Рис. 4. Материальный баланс получения нитрата калия конверсионным методом из хлорида калия Тюбегатанского месторождения и нитрата аммония местного производства.
Литература:
1. Химическая энциклопедия: в 5 т., т. 3 // Под общ. ред. И. Л. Кнунянц. — М.: Сов. энцикл., 1992. — 639с
2. Исследование взаимодействия в системе плавкости карбамид-хлорид калия-нитрата аммония. Ершенко Н. А., Таранушич В. А. Всероссийская научно-техн. конф. По тех. ТНВ, Казан — Менделеевск, 19–22 июня, 2001.Казан. 211–212.
3. Самадий М., Мирзакулов Х. Ч., Кучаров Б., Хужамкулов С. Разработка технологии получения нитрата калия конверсионным методом на основе местного сырья. // Аналитик киме фанининг долзарб муаммолари- 2010: III-Республиканская научно-техническая конференция. 31–23 апреля 2010. — Термиз, 2010. с.226–227.

