Исследована взаимосвязь основных технологических параметров, получены новые сведения по растворимости и характеру твёрдых фаз в двух четверных и тройных взаимных систем. Установлено оптимальные условия конверсии, фильтрация нитрит-нитрата кальция и натрия
В условиях мирового финансово-экономического кризиса очень своевременным оказалось издание книги Президента Республики Узбекистан Ислама Каримова “Мировой финансово — экономический кризис и меры по его преодолению в условиях Узбекистана”, где убедительно показаны принципиальные возможности нашей Республики по преодолению кризиса за счет широкого внедрения инновационных технологий и организации производства продукций, в том числе и минеральных удобрений из местных сырьевых материалов. Так же в книге “Модернизация страны и построение сильного гражданского общества” отмечено, что одним из путей успешного преодоления кризиса является реализация стратегических проектов, направленных на модернизацию, техническое и технологическое обновление ведущих базовых отраслей [1].
Одним из главных направлений экономического развития Узбекистана является освоение природных ресурсов, их комплексное использование и создание конкурентоспособных, импортозаменяющих продуктов на базе местных сырьевых ресурсов.
К таким важным химическим продуктам относятся нитриты, нитраты натрия и кальция, потребность в которых неуклонно растёт в связи с развитием отраслей народного хозяйства, потребляющих нитрит-нитратные соли натрия и кальция.
Основные потребители нитрит-нитратных солей натрия и кальция – станко-машиностроительная, металлургическая, бумажная, резиновая, текстильная, фармацевтическая, пищевая промышленность, строительная индустрия, медицина и сельское хозяйство.
Нитрит натрия можно получить по двум вариантам: взаимодействием сульфата натрия с нитритом кальция или нитрит-нитратом кальция, образующегося после абсорбции нитрозных газов известковым молоком. По первому варианту нитрит кальция подвергается конверсии сульфатом натрия с получением раствора нитрита натрия и осадка сульфата кальция. По второму варианту для получения натриевых солей нитрит- нитратный раствор кальция подвергается конверсии сульфатом натрия с получением нитрит-нитратного раствора натрия. Полученный раствор подвергается выпарке и кристаллизации с выпадением в твердую фазу нитрита натрия. После отделения центрифугированием готового продукта — нитрита натрия, маточный раствор нитрита натрия вновь возвращается на стадию выпарки (по первому варианту). Попутно полученный по обеим вариантам и сульфат кальция может использоваться в качестве гипсового строительного материала [2].
Необходимо отметить, что для физико- химического обоснования и разработки технологии получения нитрит- нитратных солей натрия и кальция на основе нитрозных газов, известняка и сульфата натрия необходимо знание совместной растворимости нитратов, нитритов и сульфатов натрия и кальция в сложных водно- солевых системах. Изучение технологических параметров процесса получения предлагаемых нитрит — нитратных солей натрия и кальция необходимо для разработки технологии их производства.
В связи с отсутствием в литературе сведений по тройным системам нитрит кальция — сульфат кальция — вода и нитрит натрия — сульфат натрия — вода исследована их растворимость изотермическим методом при 250С.
Равновесие фаз в системах Ca(NO2)2 — CaSO4 — H2O и NaNO2 — Na2SO4 — H2O при 250С устанавливалось при постоянном перемешивании и термостатировании соответственно через 1,5 и 1,0 суток. При количественном химическом анализе жидких и твердых фаз использовали общеизвестные методы аналитической химии [4]. Полученные данные использовали для определения составов твердых фаз по Шрейнемакерсу [2] и для построения изотермических диаграмм растворимости тройных систем нитрит кальция — сульфат кальция — вода и нитрит натрия — сульфат натрия — вода при 250С (рис. 1 и 2).
Диаграмма растворимости тройной системы нитрит натрия — сульфат натрия-вода при 250С характеризуется наличием двух ветвей кристаллизации твердых фаз — нитрита натрия и десятиводного кристаллогидрата сульфата натрия (рис. 1). Ветвь кристаллизации нитрата натрия значительно больше, чем десятиводного сульфата натрия. Полученные данные показывают, что в изученной системе не происходит образования ни твердых растворов, ни новых химических соединении на основе исходных компонентов. Особенность изотермы растворимости в том, что сульфат натрия оказывает высаливающие действие на нитрит натрия. Поэтому растворимость последнего в присутствии сульфата натрия понижается до эвтонической точки системы.
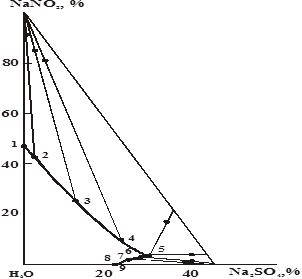
Рис. 1. Диаграмма растворимости системы нитрит натрия — сульфат натрия — вода при 250С
Как следует из рис. 1, первоначальная растворимость нитрита натрия в воде при 250С равна 46,7 %, а в присутствии 30,14–30,17 % сульфата натрия этот показатель составляет лишь 2,96–3,01 %.
Сульфат натрия в присутствии нитрита натрия при 250С повышает свою растворимость с 21,90 до 30,14–30,17 %, то есть в изученной системе наблюдается высаливающее действие нитрита натрия на сульфат натрия. В связи с этим эвтонический раствор системы обогащается сульфатом натрия при одновременном содержании нитрита натрия.
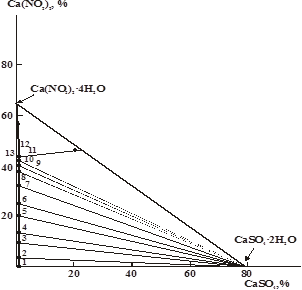
Рис. 2. Диаграмма растворимости системы нитрит кальция — сульфат кальция — вода при 250С
На изотермической диаграмме растворимости тройной системы нитрит кальция — сульфат кальция — вода установлено наличие двух ветвей, отвечающих кристаллизации Ca(NO2)2∙4H2O и CaSO4∙2H2O (рис 2) Ветвь кристаллизации двуводного сульфата кальция широкая и простирается до 44,23 % — ного содержания нитрита кальция в растворе. Ветвь кристаллизации Ca(NO2)2∙4H2O очень узкая и соответствует интервалу 44,23–45,20 % — ных концентрации нитрита кальция (таблица 1).
Таблица 1
Данные по растворимости в системе NaNO2-Na2SO4-H2O при 250С
|
№ |
Состав жидкой фазы, % |
Состав влажного “остатка”, % |
Твердая фаза | ||||
|
Са(NO2)2 |
Na2SO4 |
H2O |
Са(NO2)2 |
Na2SO4 |
H2O | ||
|
1 |
46,70 |
- |
53,30 |
96,3 |
- |
3,7 |
NaNO2 |
|
2 |
42,84 |
1,99 |
55,17 |
91,42 |
0,61 |
7,97 |
“ ” “ “ |
|
3 |
25,44 |
11,59 |
62,97 |
85,11 |
2,01 |
12,88 |
“ ” “ “ |
|
4 |
9,24 |
22,70 |
68,06 |
80,85 |
4,59 |
14,56 |
“ ” “ “ |
|
5 |
2,96 |
30,17 |
66,87 |
17,1 |
34,5 |
48,40 |
“ ” “ “ |
|
6 |
3,01 |
30,17 |
66,85 |
4,05 |
40,13 |
55,82 |
NaNO2 +Na2SO4·10H2O |
|
7 |
2,75 |
28,45 |
68,80 |
0,81 |
39,2 |
59,99 |
Na2SO4·10H2O |
Благодаря хорошей растворимости в данной системе, нитрит кальция оказывает высаливающее действие на сульфат кальция, в результате чего растворимость последнего по сравнению с его первоначальной растворимостью в воде понижается до эвтонической точки системы с 0,21 до 0,017 %.
Опыт проводился на лабораторной установке, состоящей из стеклянного реактора, снабжённого лопастной мешалкой, помещённого в термостат, скорость вращения электродвигателя регулировали реостатным устройством и измеряли тахометром ТМ-ЗМ, c использованием датчика Д-1 мм. Температуру водяного термостата, нагревающего реактор, поддерживали с помощью контактного термометра ТК — 300 и электронного реле РТ — 230 Гц
Методика эксперимента заключалась в следующем: расчётное количество Са(NO3)2 или Са(NO2)2 загружалось в реактор. Туда же добавляли Na2SO4 и приготовленный раствор нитрата или нитрита натрия, а затем дистиллированную воду.
После чего реактор помещали в термостат с заданной температурой и пульпу перемешивали в течение 2 часов.
Фильтрация пульпы проводилась на фильтровальной воронке, помещённой в колбу Бюнзена, которая присоединялась к вакуум-фильтру [4].
Эксперименты по получению нитрита и нитрата натрия проводили при температурах 25, 30, и 400С и концентрации оборотного раствора нитрита и нитрата натрия 25,0; 40,0; 50,0 %.
Полученные данные показывают, что с уменьшением концентрации оборотных растворов нитрата и нитрита натрия и с увеличением соотношения твёрдой и жидкой фаз с 1:2,5 до 1:3,5 скорость фильтрации пульпы с осадками гипса возрастает.
При концентрации оборотного растворов NaNO3 40 и 50 % и соотношении Т:Ж=1:2,5 скорость фильтрации пульпы с осадками гипса составляет 1003,5 и 820,1 кг/м2. час. При соотношении Т:Ж=1:3,5; 1:5 и концентрации оборотных растворов NaNO3 40 и 50 % скорость фильтрации колеблется соответственно в пределах 5006,4 ¸ 3520,2 и 9086,3 7451,6 кг/м2.час.
При соотношении Т:Ж=1:2,5; 1:3; 1:5 и концентрации оборотного раствора нитрита натрия 40,0 % скорость фильтрации составляет соответственно 1010,41; 5091,56; 91273,51 кг/м2.час. т. е. привело к увеличению скорости фильтрации на 44,6 %.
Уменьшение скорости фильтрации с увеличением концентрации объясняется увеличением вязкости раствора, что ухудшает ее фильтруемость.
При соотношении Т:Ж=1:3,5 и 1:5 уменьшение скорости фильтрации с увеличением концентрации жидкой фазы происходит не так резко как при соотношении Т:Ж=1:2,5, что также объясняется ухудшением фильтруемости при повышении количества твёрдой фазы.
Таким образом, в результате вышеприведенных исследований, выявлены следующие оптимальные технологические параметры процесса конверсии нитрита кальция сульфатом натрия: температура — 25–300С, концентрация оборотного раствора нитрита и нитрата натрия 40–50,0 %. Также усановлено, что конверсионные пульпы обладают достаточно хорошей фильтруемостью.
Литература:
1. Каримов И. А. «Мировой финансово- экономический кризис, пути и меры по его преодолению в условиях Узбекистана» Т., Узбекистан, 2009 г.
2. Справочник по растворимости. В 3-х. т. / Коган В. Б., Огородников С. К., Кафаров В. В., под ред. В. В. Кафарова Т. 3. Кн. 1.- Л.: Наука. — 1969. — с 944.
3. Шварценбах Г., Флашка Г. Комплексонометрическое титрование. — М.: Химия. — 1970. –360 с.
4. Атрошенко В. И. и др.Технология связанного азота. Киев. «Выш.школа».-1985.-327с.

