Методом электрофореза с иммобилизованным субстратом исследован рН-оптимум активности различных форм пищеварительных амилаз личинок Leptinotarsadecemlineata. Проведен денситометрический анализ результатов разделения, позволяющий количественно оценить активность ферментов. Показаны различия в характере и величине рН-оптимума активности различных форм фермента насекомых, что может являться одной из предпосылок молекулярной адаптации вредителей.
Ключевые слова:колорадский жук, амилазы, зимография, оптимум pH.
By electrophoresis with immobilized substrate was investigated pH optimum of activity of various forms of digestive amylases of Leptinotarsa decemlineata larvae. A densitometric analysis of gels that allowed quantifying the activity of enzymes wasperformed.The differences in the type and value of the pH optimum of various forms of insects’ amylases may be a theoretical background for molecular adaptation of pests.
Keywords: Leptinotarsa decemlineata, amylase, zymography, pH optimum.
Одной из актуальных задач современного сельского хозяйства является исследование гидролитических ферментов пищеварительного тракта насекомых-вредителей. Гидролитические ферменты играют ключевую роль во взаимодействии насекомых с растениями, позволяя насекомому эффективно перерабатывать растительную пищу. Особого внимания заслуживает изучение состава и свойств амилолитических ферментов, так как амилазы являются одними из наиболее активных карбогидраз колорадского жука [1].
Как известно из литературных данных, амилазы колорадского жука проявляют активность в относительно широком диапазоне значений кислотности среды [2]. Ранее в нашей лаборатории были проведены работы по выяснению молекулярного состава и оптимума рН суммарного препарата амилаз личинок, которые показали, что амилазы представлены тремя формами с различной молекулярной массой и рН-оптимумом от 5 до 7. В нашей работе были проведены эксперименты, направленные на уточнение и выяснение оптимумов рН отдельных форм амилаз насекомых. Для определения оптимума рН амилаз мы проводили электрофоретическое разделение ферментов в иммобилизованном субстрате (зимография) в денатурирующих условиях с последующей ренатурацией при различных значениях рН. Для получения экстрактов использовали супернатант гомогената личинок колорадского жука. К супернатанту добавляли равный объем буфера для образцов, содержащего однократный трис-глициновый электродный буфер, глицерин (20%), SDS (0,1%) и β-меркаптоэтанол (0,1%). Образцы прогревали в течение 20 минут при 70 ºС.
Полученные после окрашивания изображения гелей переводили в черно-белый режим и анализировали с использованием компьютерной программы для денситометрии, написанной в нашей лаборатории. Полученные числа переводили в единицы ферментативной активности (калибровка по амилазе Bacillus subtilis) и проводили статистическую обработку.
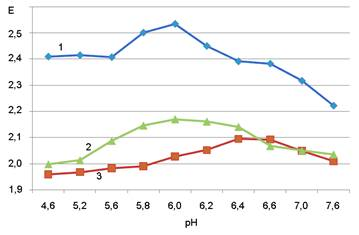
Рис. 1. Зависимость ферментативной активности амилаз личинок колорадского жука от величины рН. 1 – высокомолекулярная форма фермента, 2 – форма со средним значением молекулярной массы, 3 – низкомолекулярная форма.
Максимальная активность высокомолекулярной и низкомолекулярной форм фермента отмечена при рН 6,0, форма со средним значением молекулярной массы имеет оптимум активности при рН 6,4. По этому показателю амилазы жука существенно не отличаются от описанных в литературе амилолитических ферментов микроороганизмов и различных животных, в т.ч. насекомых и млекопитающих. Как известно, молекулярный состав гидролитических ферментов насекомых-вредителей может претерпевать изменения под действием факторов внешней среды, в частности, ингибиторов кормовых растений [3]. По-видимому, различия исследованных амилолитических ферментов по рН-оптимуму функциональной активности могут быть одним из факторов адаптации насекомых к защитным механизмам растений.
Литература:
1. Рябченко Н.А., Никитин Н.И. Влияние пищевого фактора на микроэволюцию колорадского жука. Вестн., Днепропетровск. ун-та., 2006. Т.1. С. 165-171.
2. Цветков В.О., Шпирная И.А., Валиахметова К.И., Яруллина Л.Г., Ибрагимов Р.И. Физико-химическая и экологическая характеристика амилолитических ферментов колорадского жука, Известия Самарского научного центра Российской академии наук, 2013, Т.15., №3 (5)., С. 1498-1501.
3. Brunelle F, Cloutier C, Michaud D // Arch Insect Biochem Physiol. 2004. № 55. Р. 103–113.

