Ключевые слова: вариабельность артериального давления, хроническая болезнь почек, скорость клубочковой фильтрации (СКФ), альбуминурия.
Key words: blood pressure variability, chronic kidney disease, glomerular filtration rate (GFR), albuminuria.
В настоящее время артериальная гипертония (АГ) является самым распространенным хроническим заболеванием в урбанизированных регионах мира, а заболеваемость АГ во всем мире сравнивают с пандемией. Существует линейная зависимость между уровнем артериального давления (АД) и риском развития осложнений: чем выше АД, тем больше вероятность развития инфаркта миокарда (ИМ), мозгового инсульта (МИ), хронической сердечной недостаточности (ХСН) и хронической почечной недостаточности (ХПН), причем эти последствия связаны не только с абсолютными показателями артериального давления (АД), но и с его вариабельностью. К настоящему времени накапливается все больше данных о взаимосвязи высокой вариабельности АД и поражений органов-мишеней при гипертонической болезни (ГБ). Основываясь на данных масштабных исследований [1] было установлено, что с увеличением вариабельности АД на протяжении суток возрастает риск сердечно-сосудистых осложнений, что сопровождается значимым утолщением стенок магистральных артерий и нарастанием степени гипертрофии левого желудочка. Вариабельность АД (ВАД) принято оценивать на основании расчета среднего квадратичного отклонения (СКО) от уровня среднего (SD) значения давления за определенный период времени (сутки, день или ночь) или коэффициента вариации (CV) — отношения СКО к величине усредненного за этот же период времени показателя давления [2]. Причины вариабельности АД многообразны, но их можно объединить в две основные группы. Первая из них отражает возможные погрешности в измерении (несоблюдение техники измерения, недостаточная квалификация измеряющего, неисправный прибор) [3]. Вторую группу можно рассматривать как биологическую ВАД (true biological variability) [4]. Биологическая ВАД многочисленна: на нее могу влиять изменения во время фаз сна, физическая активность в течение суток, психоэмоциональные факторы различной интенсивности и продолжительности, также к ВАД можно условно отнести возрастные изменения систолического (САД) и диастолического (ДАД) АД. Как известно, с возрастом САД увеличивается, а ДАД претерпевает характерные двухфазные изменения [5].
Различают несколько видов вариабельности:
1. Ритмические колебания АД (beat-to-beatvariability), связанные с автономным функционированием сердечно-сосудистой системы и дыхательным циклом. Этот вид ВАД интересен преимущественно для фундаментальных научных исследований. [6].
2. Вариабельность АД в рамках визита (within-visitvariability) — колебания АД при сравнении 3-х (нескольких) последовательных традиционных измерений в ходе одного визита к врачу. Такую вариабельность называют также краткосрочной вариабельностью [7]. На «внутривизитную» ВАД существенное влияние оказывает тревожная реакция на измерение. Феномен повышения артериального давления при его амбулаторном измерении, более известный как синдром белого халата или «гипертония белого халата» («white coat hypertension», ГБХ), является одним из клинических вариантов стресс-индуцированной артериальной гипертонии (СиАГ). В основе этого синдрома лежит чрезмерная реактивность системы регуляции АД при визите к врачу. Следовательно, у таких пациентов имеется достаточно высокий риск развития истинной АГ и, соответственно, более высокий риск развития сердечно-сосудистой и почечной патологии [8]. Другим методом для оценки краткосрочной вариабельности может служить метод самоизмерения АД пациентом.
3. Суточная вариабельность АД. Это колебания АД в течение суток (отдельно в периоды сна и бодрствования) по данным амбулаторного суточного мониторирования АД (СМАД), превышающие суточные физиологические колебания АД. В настоящее время наиболее актуальны два показателя суточной ВАД: рассчитанный с поправкой на фактическую продолжительность дневного и ночного периодов (SDdn), и средняя реальная ВАД (average real variability — ARV24). SDdn [9], рассчитывается по формуле:
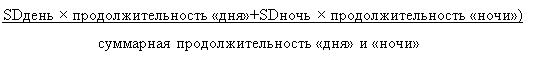 |
4. Вариабельность АД «от визита к визиту» (visit-to-visitvariability)- это различия по величине клинического («плечевого») АД между визитами, определение которой основано на повторных измерений АД с интервалами в несколько недель или месяцев. Ее часто называют долгосрочной вариабельностью АД [10]. Для описания ВАД «от визита к визиту» был выведен более точный коэффициент VIM (variation independent of mean). Он вычисляется по формуле: VIM=(SD/meanX). Величина возведения в степень (x) определяется для каждой выборки отдельно на основании подгонки кривой по следующему графику: по оси Y откладывается SD, по оси X — средние величины АД [11].
5. Вариабельность АД в разные дни (day-to-day variability). Определяется на основании самоконтроля АД (СКАД) (обычно 5–7 последовательных дней). ВАД рассчитывается как SD отдельно для утреннего и вечернего периодов. Измерения, выполненные в течение каждой «сессии» (по 3 утром или вечером) предварительно усредняются [12,13]. Преимущества такого способа оценки ВАД связаны с общими принципами СКАД (доступность, повышение приверженности больных лечению).
6. Одним из вариантов долгосрочной вариабельности АД является сезонная. Известно, что давление в разное время года не одинаковое. Так, например, наименьшие значения АД определяются в летнее время, наибольшие — в зимнее. Анализ сезонной ВАД должен сочетаться с изучением циркадного ритма АД в разные времена года [14,15].
Из этого следует, что наиболее значимыми разновидностями ВАД на данный момент являются: 24-часовая (определяется на основании СМАД), ВАД средней продолжительности (СКАД), долгосрочная ВАД «от визита к визиту» (традиционные измерения АД) [16]. По мнению многих авторов, приоритет в изучении следует отдать долгосрочной ВАД. При анализе данных III Национального исследования здоровья и питания в США (NHANES III) было показано, что высокая ВАД САД «от визита к визиту» взаимосвязана с повышенной смертностью в общей популяции [17].
В последние годы к вариабельности АД привлечено огромное внимание. В определенной мере это связано с результатами исследования ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial), согласно которым вариабельность АД влияет на риск инсульта и других осложнений артериальной гипертонии (АГ) [18]. Немаловажным на сегодняшний день становится вопрос о связи вариабельности АД и функционального состояния почек. Доказано, что независимо от среднего значения АД, краткосрочная и долгосрочная вариабельность АД связана не только с развитием и прогрессированием поражения органов-мишеней (сердце, сосуды, почки), но также является предиктором сердечно-сосудистых осложнений и смертности [19]. Заболевания сердца и почек имеют общие «традиционные» факторы риска (гипертонию, сахарный диабет, ожирение, дислипидемию и др.), а при их сочетании действуют и «нетрадиционные» почечные факторы (гипергидратация, анемия, нарушения фосфорно-кальциевого обмена, системное воспаление и гиперкоагуляция), которые также могут оказывать влияние на риск развития и патогенез сердечно-сосудистых заболеваний (ССЗ) [20].
Взаимосвязь между показаниями АД, сердечно-сосудистыми, почечными осложнениями и смертностью изучалась в большом числе обсервационных (наблюдательных) исследований [22]. Их результаты, можно кратко обобщить следующим образом:
1. Офисное АД находится в независимой непрерывной связи с частотой ряда сердечно-сосудистых событий [инсульта, инфаркта миокарда, внезапной смерти, сердечной недостаточности и периферическим поражением артерий (ППА)], а также с терминальной стадией болезни почек (ТСБП) [22, 23,24].
2. Отношение значений АД с сердечно-сосудистыми и почечными осложнениями характерно, как для высоких, так и относительно низких показаний — 110–115 мм рт. ст. для систолического АД (САД) и 70–75 мм рт. ст. для диастолического АД (ДАД). У лиц старше 50 лет САД оказывается лучшим предиктором клинических событий, чем ДАД [25, 26]. По имеющимся сообщениям, у лиц пожилого и старческого возраста возможную дополнительную прогностическую роль играет пульсовое давление (разность между САД и ДАД) [27]. На это указывает особенно высокий сердечно-сосудистый риск у пациентов с повышенным САД и нормальным или низким ДАД [изолированная систолическая АГ (ИСАГ)] [28].
3. В непрерывной связи с клиническими событиями находятся и значения АД, измеренные вне офиса, например, полученные в ходе СМАД и ДМАД [29, 30].
Связь между почками и АГ по современным взглядам представляет собой порочный круг, в котором почки являются одновременно и причиной АГ и органом-мишенью ее влияния [57]. Центральное место в патогенезе развития АГ занимает активация ренин-ангиотензин-альдостероновой системы (РААС), способствующая вазоконстрикции, гипертрофии, фиброзу и ремоделированию периферических сосудов, развитию эндотелиальной дисфункции, атеросклерозу. Немаловажное значение в течении АГ имеет почечная дисфункция, которая существенно усугубляет возможности контроля АГ и профилактики кардиоваскулярных осложнений. По современным представлениям, показателем ранней диагностики почечной дисфункции и независимым предиктором сердечно-сосудистых осложнений является скорость клубочковой фильтрации (СКФ) [21, 22, 23, 25, 27].
Диагноз обусловленного АГ поражения почек основывается на обнаружении сниженной функции почек и/или повышенной экскреции альбумина с мочой [31].
Хроническая болезнь почек (ХБП) диагностируется на основании выявления анатомического или структурного повреждения почек и/или снижения СКФ <60 мл/мин/1,73 м2, которые прослеживаются в течение 3 и более месяцев, независимо от их характера и этиологии [32, 33]. Согласно последним международным рекомендациям ХБП классифицируется с учетом категории СКФ и уровня альбуминурии, так как СКФ и определение экскреции альбумина с мочой имеют самостоятельное диагностическое и прогностическое значение. В зависимости от величины СКФ хроническая болезнь почек делится на 5 стадий. Показатель СКФ на уровне 90 мл/мин принят как нижняя граница нормы. Значение СКФ <60 мл/мин. (для диагностики ХБП) выбрано ввиду соответствия гибели более 50 % нефронов. Если признаков повреждения почек нет, а СКФ находится в диапазоне 60–89 мл/мин., то стадия ХБП не устанавливается. Такое состояние оценивается как снижение СКФ и обязательно отражют в диагнозе. У пожилых лиц (60 лет и старше) показатели СКФ в пределах 60–89 мл/мин без инициирующих факторов риска ХБП рассматривается как возрастная норма. При рСКФ менее 60 мл/мин/1.73 м2 выделяют три стадии ХБП: 3 стадию (СКФ 30–60 мл/мин/1.73 м2) и 4 и 5 стадии (СКФ менее 30 и 15 мл/мин/1.73 м2, соответственно). Кроме того, новые рекомендации предполагают разделение 3 стадии ХБП по уровню СКФ на стадии 3а и 3б, поскольку почечный и сердечно-сосудистый прогнозы не одинаковы в группах лиц с ХБП 3 стадии с СКФ от 59 до 45 мл/мин/1,73 м2 и от 44 до 30 мл/мин/1,73 м2. Если в подгруппе лиц с СКФ от 59 до 45 мл/мин/1,73 м2 весьма высоки сердечно-сосудистые риски при умеренных темпах прогрессирования ХБП, то у пациентов с уровнем СКФ в пределах от 44 до 30 мл/мин/1,73 м2 риск развития терминальной почечной недостаточности (ТПН) оказывается выше, чем риск летальных сердечно-сосудистых осложнений [32, 33].
Имеющиеся к настоящему времени данные, включая и метаанализ более 1.5 миллионов наблюдений [34] определенно указывают, что риски общей и сердечно-сосудистой смертности, развития ТПН, острого повреждения почек и прогрессирования ХБП существенно отличаются в зависимости от уровня мочевой экскреции альбумина в любом диапазоне СКФ. Выделяют три категории альбуминурии: А1 — отношение А/Кр <30 мг/г (<3 мг/ммоль) — норма или незначительное повышение; А2 — отношение А/Кр 30–300 мг/г (3–30 мг/ммоль) — умеренное повышение; А3 — отношение А/Кр >300 мг/г (>30 мг/ммоль) — значительное повышение [Levey A. S. и соавт., 2010]. Длительное время, «нормальным» уровнем альбуминурии считали мочевую экскрецию альбумина <30 мг/сут. В «Рекомендациях Научно-исследовательского института нефрологии…» в качестве нижней границы был предложен уровень мочевой экскреции альбумина 15 мг/г (15 мг/сут) [55]. Тем не менее результаты последних наблюдений делают более обоснованной нижнюю границу нормы экскреции альбумина почками 10 мг/сут (или 10 мг альбумина/г креатинина), поскольку уровень экскреции альбумина с мочой в диапазоне 10–29 мг/сут отчетливо ассоциируются с повышением рисков общей и сердечно-сосудистой смертности [51,52,53,54,34]. Проблема градации альбуминурии/протеинурии стала предметом дискуссии на последней Лондонской конференции KDIGO были оставлены текущие градации выраженности альбуминурии («стадии альбуминурии») — <30 мг альбумина/г креатинина, 30 -299 мг/г, >300 мг/г. Вместо традиционной терминологии «нормоальбуминурия — микроальбуминурия — макроальбуминурия/протеинурия» для описания градаций мочевой экскреции альбумина (МЭА) предложено использовать определения «оптимальный» (<10 мг/г), «высоконормальный» (10–29 мг/г), «высокий» (30–299 мг/г), «очень высокий» (300–1999 мг/г) и «нефротический» (>2000 мг/г). Использование терминов «нормоальбуминурия», «макроальбуминурия», «микоальбуминурия» в настоящее время представляется нежелательным [34]. Принимая во внимание то, что существует ряд факторов, приводящих к ложноположительным или ложноотрицательным результатам тестов на протеинурию/альбуминурию, трактовать результаты исследования экскреции белка с мочой следует с учетом результатов общего анализа мочи [33].
Использование категорий СКФ и альбуминурии позволяет стратифицировать больных ХБП по риску почечных исходов (снижение СКФ, прогрессирование альбуминурии, ОПП, ТХПН) и других осложнений (сердечно-сосудистая заболеваемость и смертность, эндокринные и метаболические нарушения, лекарственная токсичность) [32]. В то время как повышение концентрации креатинина в сыворотке или снижение рСКФ указывают на ухудшение функции почек, повышения мочевой экскреции альбумина или белка указывает, как правило, на поражение фильтрационного барьера клубочков. Показано, что микроальбуминурия служит предиктором развития явной диабетической нефропатии у больных диабетом 1 и 2 типов [35], в то время как наличие явной протеинурии в целом указывает на уже сформировавшееся поражение паренхимы почек [36]. Было показано, что у больных АГ с диабетом и без него микроальбуминурия, даже не превышающая обычные пороговые значения [37], является предиктором сердечно-сосудистых событий [38, 39, 40, 41]. Известно, что МАУ является отражением генерализованной дисфункции эндотелия (ДЭ). Имеются доказательства, что наряду с генерализованной ДЭ у пациентов нарушается функция гломерулярных эндотелиоцитов, что проявляется наличием альбумина в моче [58]. В связи с этим уже на стадии МАУ значительно возрастает не только вероятность прогрессирования поражения почек, но и риск развития ССО [59,60]. Исследования по проекту HOPE (Heart Outcome Prevention Evaluation) убедительно показали, что МАУ строго ассоциирована с риском развития клинических проявлений ИБС, смертностью и развитием сердечной недостаточности [61].
Расчет СКФ и определение микроальбуминурии (МАУ) у больных АГ являются доступными, воспроизводимыми маркерами поражения органов-мишеней с высокой прогностической значимостью, выгодным соотношением «стоимость-эффективность» [56]. Во многих исследованиях показано, что продукция креатинина существенно варьирует в зависимости от пола, возраста и этнической принадлежности. Согласно современным рекомендациям с целью диагностики и классификации ХБП необходимо рассчитывать СКФ по формуле CKD-EPI, которая на основании эмпирических данных учитывает все эти влияния на продукцию креатинина. Эта формула помогает выявить легкую степень нарушения функции почек, когда показатели креатинина все еще остаются в пределах нормы [42]. Кроме того, результаты исследований, выполненных в Научно-исследовательском институте нефрологии, показали, что стратификация стадий ХБП на основе CKD-EPI метода оценки СКФ очень близко совпадает с данными, полученными с помощью референтного метода с плазматическим клиренсом 99mTc-DTPA [43].
Ухудшение функции почек и возрастание сердечно-сосудистого риска подтверждается данными о повышении сывороточных уровней цистатина С [44]. Исследования показали, что уровень цистатина С является более точным маркером почечной функции, чем уровень креатинина. Цистатин C (наряду с инулином) на сегодняшний день рассматривается как «золотой стандарт» определения скорости клубочковой фильтрации как интегрального показателя функции почек. В отличие от креатинина, на темп синтеза цистатина C не влияют такие факторы, как возраст, пол, мышечная масса, характер питания, наличие воспалительных реакций. У человека нормальный уровень цистатина С в плазме крови в возрасте от 14 до 50 лет составляет 0,63–1,33 мг/л, в возрасте старше 50 лет — 0,74–1,55 мг/л. В ходе крупного длительного исследования было показано, что цистатин С является предиктором хронической почечной недостаточности и сердечно-сосудистых заболеваний у пожилых людей [44,45].
Следует отметить, что обнаружение нарушенной функции почек у больного АГ, выражающееся в виде любого из упомянутых выше нарушений, представляет собой очень мощный и часто встречающийся предиктор будущей сердечно-сосудистой заболеваемости и смертности [39,46,47, 48, 49, 50]. По этой причине рассчитывать СКФ и определять микроальбуминурию рекомендуется у всех больных АГ.
Заключение:
В настоящее время существует очевидная необходимость разработки исследований позволяющих найти связь между повышенной долгосрочной вариабельностью артериального давления и прогнозом поражения функций почек. Необходимо перспективно определить причины изменчивости вариабельности артериального давления «от визита к визиту», его влияние на сердечно-сосудистые осложнения и действительно ли лечение антигипертензивными препаратами снижает вариабельность АД и улучшает клинический исход.
Литература:
1. Mancia G, Parati G. Ambulatory blood pressure monitoring and organ damage. Hypertension. 2000; 36: 894–900.
2. Емельянов И. В. Вариабельность артериального давления у больных гипертонической болезнью, связь с состоянием вегетативной нервной системы и органов-мишеней: автореф. дис. … канд. мед. наук: 14.00.06/ Емельянов Игорь Витальевич-Санкт-Петербург, 2004 -22с.
3. Горбунов В. М. Современные представления о вариабельности артериального давления. Рациональная Фармакотерапия в Кардиологии 2012; 8(6): 810–818.
4. Poulter N. R. Can we improve BP control rates? Lessons from the Health Survey for England 2006. Medicogaphia2010; 32 (3): 227–234.
5. Mancia G., Bombelli M., Facchetti R. et al. Long-Term Prognostic Value of Blood Pressure Variability in the General Population Results of the Pressioni Arteriose Monitorate e Loro Associazioni Study. Hypertension2007; 49: 1265–70.
6. M. L. Appel, R. D. Berger, J. P. Saul, J. M. Smith, R. J. Cohen. Beat to Beat Variability in Cardiovascular Variables: Noise or Music? Journal of the American College of Cardiology. 1989; 14(5): 1139–1148.
7. J. H. Shin, J. Shin, B. K. Kim, Y-H Lim, H-C Park, S. I. Choi, S. G. Kim and J. H. Kim Within-visit blood pressure variability: relevant factors in the general population. Journal of Human Hypertension. 2013; 27 (5): 328–334.
8. Дроздецкий С.И, Глотова М.Е, Дружилов М. А. Гипертония белого халата: безобидный феномен или притаившаяся опасность? Кардиология, 2006; 1: 28–32
9. Bilo G., Giglio A., Styczkiewicz K. et al. A new method for assessing 24-h blood pressure variability after excluding the contribution of nocturnal blood pressure fall. J Hypertens 2007; 25: 2058–2066.
10. Остроумова О. Д. Вариабельность артериального давления и риск развития инсульта при гипертонической болезни. Журнал неврологии и психиатрии им. С. С. Корсакова, 2012; 10(2): 45–50.
11. Dolan E., O’Brien E. Blood pressure variability: Clarity for clinical practice. Hypertension 2010; 56: 179–81.
12. Kikuya M., Ohkubo T., Metoki H. et al. Day-to-day variability of blood pressure and heart rate at home as a novel predictor of prognosis: the Ohasama study. Hypertension 2008; 52: 1045–1050.
13. Johansson J. K., Niiranen T. J., Puukka P. J., Jula A. M. Prognostic value of the variability in home-measured blood pressure and heart rate: the Finn-home study. Hypertension 2012; 59: 212–218.
14. Cuspidi C., Ochoa J. P., Parati G. Seasonal variations in blood pressure: a complex phenomenon. J Hypertens2012; 30(1): 315–1320.
15. Talma Rosenthal. Seasonal Variations in Blood Pressure. Am J Geriatric Cardiology. 2004; 13(5): 267–272.
16. Stergiou G. S., Parati G. How to best assess blood pressure? The ongoing debate on the clinical value of blood pressure average and variability. Hypertension 2011; 57: 1041–1042.
17. Muntner P, Shimbo D, Tonelli M, Reynolds K, Arnett DK, Oparil S. The relationship between visit-to-visit variability in systolic blood pressure and all-cause mortality in the general population: findings from NHANES III, 1988 to 1994. Hypertension. 2011; 57: 160–166.
18. Dahlof B., Sever P. S., Poulter N. R.. et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in Anglo-Scandinavian Cardiac Outcomes Trial — Blood Pressure Lowering Arm(ASCOT-BPLA): a multicentral randomized controlled trial. Lancet 2005; 366: 895–906.
19. Parati G.1., Ochoa J. E., Bilo G. Blood pressure variability, cardiovascular risk, and risk for renal disease progression. CurrHypertens Rep. 2012; 14(5): 421–431.
20. Кобалава Ж. Д., Виллевальде С. В., Ефремовцева М. А. Хроническая болезнь почек: определение, классификация, принципы диагностики и лечения. Российский кардиологический журнал 2013; 4: 95–103.
21. Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, Germano G, et al. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007; 25: 1105–1187.
22. Lewington S., Clarke R., Qizilbash N., Peto R., Collins R. Age-specific relevance of usual blood pressure to vascular mortality: a metaanalysis of individual data for one million adults in 61 prospective studies. Lancet 2002; 360: 1903–1913.
23. Britton K. A., Gaziano J. M., Djousse L. Normal systolic blood pressure and risk of heart failure in US male physicians. Eur J Heart Fail 2009; 11: 1129–1134.
24. Kalaitzidis R. G., Bakris G. L. Prehypertension: is it relevant for nephrologists? Kidney Int 2010; 77: 194–200.
25. Franklin S. S., Gustin W. 4th, Wong, N.D., Larson M. G., Weber M. A., Kannel, W.B., Levy D. et al. Haemodynamic patterns of age-related changes in blood pressure. The Framingham Heart Study. Circulation 1997; 96: 308–315.
26. Vishram J. K., Borglykke A., Andreasen A. H., Jeppesen J., Ibsen H, J0rgensen T, et al., on behalf of the MORGAM Project. Impact of Age on the Importance of Systolic and Diastolic Blood Pressures for Stroke Risk: The MOnica, Risk, Genetics, Archiving and Monograph (MORGAM) Project. Hypertension 2012; 60:1117–1123.
27. Benetos A., Safar M., Rudnichi A., Smulyan H., Richard J. L., Ducimetieere P., Guize L. Pulse pressure: a predictor of long-term cardiovascular mortality in a French male population. Hypertension 1997; 30: 1410–1415.
28. Kannel W. B., Wolf P. A., McGee D. L., Dawber T. R., McNamara P., Castelli W. P. Systolic blood pressure arterial rigidity risk of stroke. The Framingham study. JAMA 1981; 245: 1225–1229.
29. Kannel W. B. Risk stratification in hypertension: new insights from the Framingham Study. Am J Hypertens 2000; 13: 3S–10S.
30. Thomas F., Rudnichi A., Bacri A M, Bean K, Guize L, Benetos A. Cardiovascular mortality in hypertensive men according to presence of associated risk factors. Hypertension 2001; 37: 1256–1261.
31. Stevens L. A., Coresh J., Greene T., Levey A. S. Assessing kidney function: measured and estimated glomerular filtration rate. N Engl J Med 2006; 354: 2473–2483.
32. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int (Suppl.) 2013; 3: 1–150.
33. Рабочая группа Научного общества нефрологов России. Национальные рекомендации. Хроническая болезнь почек: основные положения, определение, диагностика, скрининг, подходы к профилактике и лечению. Клиническая нефрология. 2012; 4: 4–26. Available at: http://journal.nephrolog.ru/ckd/
34. Levey A. S., de Jong P. E., Coresh J. et al. The definition, classification and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int 2010; 80: 17–28.
35. Parving H. H. Initiation and progression of diabetic nephropathy. N Engl J Med 1996; 335: 1682–1683.
36. Ruilope L. M., Rodicio J. L. Clinical relevance of proteinuria and microalbuminuria. Curr Opin Nephrol Hypertens 1993; 2: 962–967.
37. Redon J., Williams B. Microalbuminuria in essential hypertension: redefining the threshold. J Hypertens 2002; 20: 353–355.
38. Jensen JS, Feldt-Rasmussen B, Strandgaard S, Schroll M, Borch-Johnsen K. Arterial hypertension, microalbuminuria and risk of ischemic heart disease. Hypertension 2000; 35:898–903.
39. de Leeuw P. W., Ruilope L. M., Palmer C. R., Brown M. J., Castaigne A., Mancia G, et al. Clinical significance of renal function in hypertensive patients at high risk: results from the INSIGHT trial. Arch Intern Med 2004; 164: 2459–2464.
40. Sarnak M. J., Levey A. S., Schoolwerth A. C., Coresh J., Culleton B., Hamm L. L., et al. Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology and Epidemiology and Prevention. Circulation 2003; 108: 2154–2169.
41. Gerstein H. C., Mann J. F., Yi Q., Zinman B., Dinneen S. F., Hoogwerf B., et al. Albuminuria and risk of cardiovascular events, death and heart failure in diabetic and nondiabetic individuals. JAMA 2001; 286: 421–426.
42. Moe S., Drueke T., Cunningham J., Goodman W., Martin K., Olgaard K., et al. Definition, evaluation and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2006; 69: 1945–1953.
43. Levey A. S., Stevens L. A., Schmid C. H. et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150: 604–12.
44. Shlipak M. G., Katz R., Sarnak M. J., Fried L. F., Newman A. B., Stehman-Breen C, Seliger SL, Kestenbaum B., Psaty B., Tracy R. P., Siscovick D. S. Cystatin C and prognosis for cardiovascular and kidney outcomes in elderly persons without chronic kidney disease. AnnInternMed. 2006; 145(4): 237–246.
45. Pirttila T. J., Manninen A., Jutila L., Nissinen J., Kalviainen R., Vapalahti M., Immonen A., Paljarvi L., Karkola K., Alafuzoff I., Mervaala E., Pitkanen A. Cystatin C expression is associated with granule cell dispersion in epilepsy. Ann Neurol. 2005; 58(2): 211–223.
46. Zanchetti A., Hansson L., Dahlof B., Elmfeldt D., Kjeldsen S., Kolloch R., et al. Effects of individual risk factors on the incidence of cardiovascular events in the treated hypertensive patients of the Hypertension Optimal Treatment Study. HOT Study Group. J Hypertens 2001; 19: 1149–1159.
47. Ruilope L. M., Salvetti A., Jamerson K., Hansson L., Warnold I., Wedel H., Zanchetti A. Renal function and intensive lowering of blood pressure in hypertensive participants of the hypertension optimal treatment (HOT) study. J Am Soc Nephrol 2001; 12: 218–225.
48. De Leeuw P. W., Thijs L., Birkenhager W. H., Voyaki S. M., Efstratopoulos A. D., Fagard R. H., et al. Prognostic significance of renal function in elderly patients with isolated systolic hypertension: results from the Syst-Eur trial. J Am Soc Nephrol 2002; 13: 2213–2222.
49. Segura J., Ruilope L. M., Zanchetti A. On the importance of estimating renal function for cardiovascular risk assessment. J Hypertens 2004; 22: 1635–1639.
50. Rahman M., Pressel S., Davis B. R., Nwachuku C., Wright J. T. Jr, Whelton P. K., et al. Cardiovascular outcomes in high-risk hypertensive patients stratified by baseline glomerular filtration rate. Ann Intern Med 2006; 144: 172–180.
51. Schmieder R. E. Schrader J., Zidek W. et al. Low-grade albuminuria and cardiovascular risk: what is the evidence? Clin Res Cardiol 2007; 96(5): 247- 257.
52. Klausen K. P. Scharling H., Jensen G., Jensen J. S. New definition of microalbuminuria in hypertensive subjects: association with incident coronary heart disease and death. Hypertension. 2005; 46(1):33–37.
53. Brantsma A. H., Bakker S. J., Hillege H. L. et al. Urinary albumin excretion and its relation with C-reactive protein and the metabolic syndrome in the prediction of type 2 diabetes. Diabetes Care 2005; 28(10): 2525–2530.
54. Forman J. P., Brenner B. M. “Hypertension” and “microalbuminuria”: The bell tolls for thee. Kidney Int 2006; 69: 22–28.
55. Смирнов А. В., Добронравов В. А., Каюков И. Г. и др. Рекомендации Научно-исследовательского института нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова: определение, классификация, диагностика и основные направления профилактики хронической болезни почек у взрослых. Левша, СПб. 2008;51.
56. 2013 ESH/ESC Guidelines for the management of arterial hypertension Eur Heart J 2013; 34: 2159–2219.
57. Кутырина И. М. Современные аспекты патогенеза почечной артериальной гипертензии. Нефрология. 2000; 4: 112 -115.
58. Ochodnicky P., Henning R. N., van Dokkum R. P. et al. Microalbuminuria and endothelial dysfunction: emerging targets for primary prevention of end-organ damage. Cardiovasc Pharmacol 2006; 47: 151–162.
59. Hansson L., Hedner Т., Lund-Johansen P. et al. Randomised trial of effects of calcium antagonists compared with diuretics and (3-blockers on cardiovascular morbidity and mortality in hypertension: the Nordic Diltiazem (NORDIL) Study. Lancet 2000; 356: 359–365.
60. McQueen M. J. Evidence for the use of urinary albumin as marker of kidney involvement in unselected populations. Scand J Clin Lab Invest 2008; 241: 52–56.
61. Lever A. F., Brennan P. J. MRS trial of treatment in elderly hypertensives. Clin Exp Hypertens 1993; 15: 941–952.

