Азосоединения, синтезированные на основе пирогаллола, являются ценными органическими реагентами для спектрофотометрического определения некоторых элементов. Поэтому исследование разнолигандных комплексов скандия с азосоединениями, в присутствии гидрофобных аминов и разработка новых методик спектрофотометрического определения его микроколичеств в природных объектах представляет несомненный теоретический и практический интерес в аналитической химии.
Исследование разнолигандных комплексных соединений и разработка фотометричесикх методик на основе этих соединений дает возможность ответить на целый ряд вопросов экологической химии скандия. Среди разнолигандных комплексов особое место занимают комплексы, образованные ионами металла с гидрофобными аминами.
Как указано выше, из апробированных гидрофобных аминов только 1,10-фенантролин, дифенилгуанидин, трифенилгуанидин сильно влияют на комплексообразование скандия(III) c использованными реагентами 2,2/,3,4-тетраокси-3/-сульфо-5/-нитроазобензолом и 2,2/,3,4-тетраокси-3/-сульфо-5/-хлоразобензолом (R1-R2) и при их участии образуются следующие разнолигандные комплексы: Sc(III)-R1-Фен, Sc(III)-R1-ДФГ, Sc(III)-R1-ТФГ, Sc(III)-R2-ТФГ и Sc(III)-R2- ДФГ [1–2].
Для установления оптимальных условий комплексообразования были изучены спектры светопоглощения комплексов в интервале рН 0–10, в области длин волн λ=300–700 нм.
С образованием разнолигандных комплексов в спектрах поглощения наблюдается батохромный сдвиг по сравнению с соответствующими реагентами и бинарными комплексами. Изучение зависимости комплексообразования от рН среды показало, что разнолигандные комплексы скандия(III) в присутствии гидрофобных аминов также образуются в кислой среде (рН 0–7).
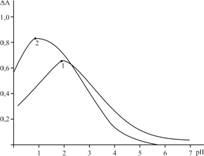
Рис. 1. Влияние рН на светопоглощение комплексов скандия(III) c R1 вприсутствии и в отсутствие ТФГ на фоне контрольного опыта. 1. Sc(III)-R1, 2. Sc(III)-R1-ТФГ, СSc=4×10–5M, СR=1,2×10–4M, CТФГ.= 1,6×10–4M, КФК-2, l=1 см. l=490 нм.
С образованием разнолигандных комплексов максимальный выход сдвигается в более кислую среду. Оптимальные значения рН комплексообразования для комплексов Sc(III)-R1-Фен, Sc(III)-R1-ДФГ, Sc(III)-R1-ТФГ, — рН 1,0 (0,1 М HCl), Sc(III)-R2-ТФГ и Sc(III)-R2- ДФГ рН 2.
Окраска реагентов и всех разнолигандных комплексов скандия(III) зависит от кислотности среды, поэтому изучение спектров поглощения комплексов проводилось на фоне «контрольного опыта» (реагент+гидрофобный амин), приготовленного в аналогичных условиях. Установлено, что максимальный выход всех разнолигандных комплексов наблюдается при длине волны 490 нм.
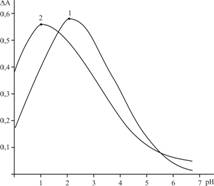
Рис. 2. Влияние рН на светопоглощение комплексов скандия(III) c R2 вприсутствии ДФГ и ФЕН на фоне контрольного опыта. 1. Sc(III)-R1-ФЕН, 2. Sc(III)-R1-ДФГ, СSc=4×10–5M, СR=1,2×10–4M, CДФГ.= 1,6×10–4M, КФК-2, l=1 см. l=490 нм.
Изучение зависимости оптической плотности от времени и температуры показало, что все разнолигандные комплексы скандия(III) образуются сразу после смешивания растворов компонентов и отличаются устойчивостью.
Спектрофотометрические характеристики бинарных и разнолигандных комплексов скандия(III) с реагентами R1-R2, образующихся в присутствии гидрофобных аминов, рассчитанные при оптимальных условиях комплексообразования, в виде сравнения, приведены в табл.1
Таблица 1
Некоторые спектрофотометрические характеристики комплексов скандия(III) среагентами R1-R2 в присутствии гидрофобных аминов
|
Комплексы |
рНопт |
λмах, нм |
ε·10–4 |
Состав комплексов | |
|
НR |
Sc -R-Т. к. | ||||
|
Sc(III)-R1 |
2,0 |
377 |
477 |
1,85 |
1:2 |
|
Sc(III)-R1-Фен |
1,0 |
377 |
480 |
2,90 |
1:2:1 |
|
Sc(III)-R1-ДФГ |
1,0 |
377 |
498 |
2,80 |
1:2:1 |
|
Sc(III)-R1-ТФГ |
1,0 |
377 |
487 |
2,70 |
1:2:1 |
|
Sc(III)-R2 |
3,0 |
405 |
457 |
1,65 |
1:2 |
|
Sc(III)-R2 ДФГ |
2,0 |
405 |
444 |
1,85 |
1:2:1 |
|
Sc(III)-R2-ТФГ |
1,0 |
405 |
450 |
1,75 |
1:1:1 |
|
Sc(III)-R2-фен |
1,0 |
424 |
470 |
1,95 |
1:1:1 |
Как видно, образование разнолигандных комплексов скандия(III) с реагентами R1-R2 в присутствии гидрофобных аминов сопровождается повышением чувствительности, т. е. молярного коэффициента светопоглощения, которые можно применить для определения микроколичеств скандия(III) в сложных объектах.
Литература:
1. Комиссарова Л. Н. Неорганическая и аналитическая химия скандия. М.:Эдиториал УРСС, 2001, с.510.
2. Гамбаров Д. Г. Дис…докт.хим.наук. М.: МГУ, 1984, с.38

