Введение
Кукуруза (Zea mays L.) — многофункциональная культура сельскохозяйственной промышленности. Объемы производства кукурузы в период 2024–2025 гг. составляют 1 286 225 тыс. метрических тонн в мире [1] и 13 956 тыс. метрических тонн в России [2]. В совокупности с высокой урожайностью возможность использования кукурузы в пищевой промышленности и животноводстве, делает ее одной из важнейших зерновых культур мирового масштаба.
Средняя урожайность кукурузы в России составляет 57 ц/га, однако потенциал производства этой культуры не реализован в достаточной степени. В целом, урожайность за последние 10 лет выросла на 60 %, что связано с более детальным изучением факторов производства кукурузы и с более активными исследованиями, направленными, в основном, на улучшение плодородности почвы [3].
Длительный цикл селекции новых сортов кукурузы (до 10 лет) является основным лимитирующим фактором для оперативного создания конкурентоспособных сортов, адаптированных к требованиям пищевой промышленности и кормопроизводства. В связи с этим, актуальным становится поиск и внедрение инновационных инструментов, позволяющих ускорить селекционный процесс. Выходом из этой ситуации является совместное применение классической селекции с современными биотехнологическими методами.
Микроклональное размножение in vitro является одним из наиболее эффективных инструментов, обеспечивая быстрое клонирование перспективных линий и основой для применения методов геномного редактирования [4]. В данной системе ключевым этапом, определяющим общую эффективность микроклонального размножения, является первичное введение экспланта в культуру, в частности достижение максимального процента стерильности.
Данные о стерилизующих агентах и стратегиях их применения
Тип стерилизующего вещества, его концентрация и продолжительность обработки экспланта подбираются индивидуально: даже сходные органы у разных растений (или разных сортов одной культуры) могут требовать существенной корректировки условий стерилизации. Требования, предъявляемые к стерилизующему агенту:
- максимальная бактерицидная и фунгицидная активность,
- минимальное повреждающее действие на меристематические и паренхимные ткани,
- способность к быстрому удалению или разложению [5]. Поэтому для каждого нового объекта методику заимствуют из литературных источников и оптимизируют экспериментально.
Наиболее распространёнными химическими агентами для поверхностной стерилизация эксплантов являются соединения активного хлора (гипохлорит натрия или кальция, хлорная известь), этанол, а также сулема (двухлористая ртуть) и диацид [6]. В частности, для стерилизации тканей кукурузы традиционно используются этанол и растворы сулемы. Например, обработка 0,1 % водным раствором сулемы в течение 10–20 минут считается стандартным методом для ряда культур. Однако литературные данные указывают на его неэффективность и нецелесообразность при работе, из-за ограничений, связанных с высокой токсичностью и сложностью утилизации [7].
Цель исследования: таким образом, целью данной работы является изучение эффективности практического использования различных схем стерилизации изолированных зрелых зерновок и зародышей кукурузы. В рамках исследования оценивались степень стерильности полученных культур и влияние применяемых химических реагентов на выживаемость и способность изолированных зародышей к дальнейшему развитию in vitro.
В научных исследованиях для поверхностной стерилизации растительных эксплантов широко применяются коммерческие препараты на основе гипохлорита натрия (например, «Белизна») в качестве источника активного хлора [8].
Альтернативным агентом является этиловый спирт, который часто применяют для предварительной стерилизации или самостоятельной обработки семян и генеративных органов. В некоторых исследованиях рекомендуется использование 96 % этанола [9], в ряде других другие указывается на большую эффективность 50–70 % растворов [10], что, вероятно, связано с лучшим проникновением в клетки микроорганизмов при умеренной концентрации. Описан также успешный опыт использования 75 % спирта для стерилизации тканей табака [11].
Материалы и методы исследования
В исследовании использовались зрелые зерновки раннеспелого трехлинейного гибрида кукурузы (Zea mays L.) Воронежский 192 СВ (урожай 2025 года) собственной селекции ФГБНУ ВНИИ кукурузы (Россия, Пятигорск). Извлеченные зерновки промывали в 5 % мыльном растворе детергента марки Synergetic в течение 2-х минут и замачивали в стерильной дистиллированной воде при температуре +4 °C в течение 24 ч для индукции набухания и метаболической активации.
Опыт включал семь вариантов обработки (табл. 1), по десять зерновок в каждой повторности.
Подготовка зародышей проводилась по двум схемам:
– Схема А: Стерилизация целых зерновок с последующей изоляцией зародышей.
– Схема Б: Изоляция зародышей из нестерильных зерновок с последующей прямой стерилизацией самих зародышей.
В качестве стерилизующих агентов использовали:
- 0,3 % водный раствор перманганата калия (KMnO 4 ), по методу дробной стерилизации, экспозиция 15 мин при температуре +23 °С;
- раствор коммерческого препарата «Чистин» (основное действующее вещество — Na-гипохлорит) в разведении 1:3, экспозиция 15 мин при температуре +23 °С;
- раствор коммерческого препарата «Чистин» (основное действующее вещество — Na-гипохлорит) в разведении 1:1, экспозиция 5 мин при температуре +23 °С;
- 70 % водный раствор этанола, экспозиция 30 с при температуре +23 °С.
После обработки стерилизующим веществом материал трижды промывали стерильной дистиллированной водой (по 5 мин на каждое промывание) и временно хранили в последней порции промывной воды до момента эксплантации.
Изолированные зрелые зародыши в стерильных условиях ламинар-бокса помещали на питательную среду. На этапе адаптации использовали упрощенную среду — 0,5 % водный агар (по 2 мл в пробирке). Запечатанные пробирки помещали в темноту при температуре + 22 °С.
Оценку состояния зародышей in vitro проводили на третьи сутки по отсутствию контаминации и наличию развития.
Неинфицированные проростки на 3-и сутки пересаживали в емкости для культивирования (стеклянные банки объемом 350 мл с биофильтрами) на полную питательную среду Мурасиге–Скуга (MS) [12] (по 30 мл среды на банку). Культуры выращивали в контролируемых условиях: температура +22…+24 °C, 16-часовой фотопериод, уровень освещенности 3000 люкс.
Мониторинг состояния культур (отсутствие латентной инфекции, оценка ростовых характеристик) проводили на 7-е и 10-е сутки.
Полученные количественные данные обрабатывали статистически с использованием программы Microsoft Excel (версия 2510).
Результаты и их обсуждения
Результаты эксперимента по подбору эффективного метода стерилизации для введения зрелых зародышей кукурузы в культуру in vitro представлены в таблице 1 и проиллюстрированы рисунками 1–3. Ключевыми критериями оценки стерилизующих растворов были всхожесть семян, отсутствие контаминации и общая эффективность стерилизации, а также последующий рост эксплантов.
Таблица 1
Эффективность различных методов стерилизации зрелых зародышей кукурузы в культуре in vitro
|
Способ стерилизации |
Марганец 0,3 %, 15 мин |
Хлор 1,7 % (чистин), 15 мин |
Хлор 2,5 % (чистин), 5 мин |
Спирт 70 % 30 с | |||
|
Целостность зерна |
зерно |
зерно |
зародыш |
зерно |
зародыш |
зерно |
зародыш |
|
Всхожесть семян (ВС) |
7/10 (70,0 %±9,3 %) |
9/9 (100,0 %± <1 %) |
6/9 (66,6 %±15,7 %) |
8/10 (80 %±12,6 %) |
6/9 (66,6 %±15,7 %) |
9/10 (90,0 %±9,5 %) |
8/9 (88,9 %±10,5 %) |
|
Отсутствие контаминации (ОК) |
0 %±0 % |
3/9 (33,3 %±15,7 %) |
6/6 (100,0 %± <1 %) |
5/8 (62,5 %±17,1 %) |
6/6 (100,0 %± <1 %) |
6/9 (66,6 %±15,7 %) |
7/8 (87,5 %±11,7 %) |
|
Общая эффективность стерилизации (ОЭ = ВС*ОК/100) |
0 % |
33,3 % |
66,6 % |
50,0 % |
66,6 % |
59,9 % |
77,8 % |
|
Морфологическое состояние на 3-й день культивации |
- |
Активный рост корневой системы, умеренный рост колеоптиле |
Активный рост корневой системы, умеренный рост колеоптиле |
Общий угнетенный рост, признаки стресса |
Общий угнетенный рост, признаки стресса |
Активный рост корневой системы |
Активный рост корневой системы |
|
Морфологическое состояние на 7-й день культивации |
- |
Колеоптиле ~ 4 см |
Колеоптиле ~ 3–4 см |
Колеоптиле ~ 6,5–7 см, корень ~ 1,5–2 см |
Колеоптиле ~ 6,5–7 см, корень тонкий ~ 2–3 см |
Колеоптиле ~ 6,5–7 см, корень ~ 4–5см |
Колеоптиле ~ 6,5–7 см, корень ~ 4–5 см |
Данные по ВС и ОК представлены как среднее значение ± стандартное отклонение (SD) для пропорции. Значения ОЭ приведены как расчётные точечные оценки на основе средних значений ВС и ОК.
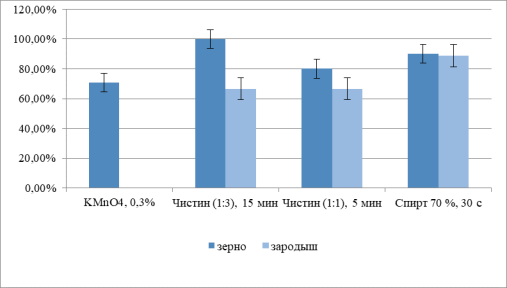
Рис. 1. Всхожесть семян после проведения разных вариантов стерилизации зерновок кукурузы через 3 сут. после обработки
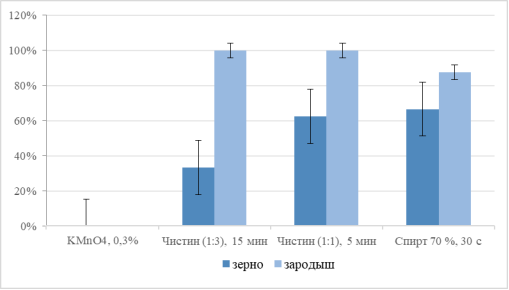
Рис. 2. Чистота семян после проведения разных вариантов стерилизации зерновок кукурузы через 7 сут. после обработки
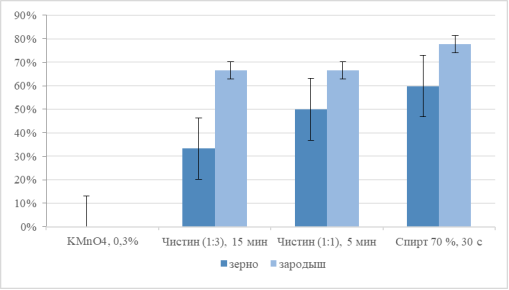
Рис. 3. Эффективность разных вариантов стерилизации зерновок кукурузы через 7 сут. после обработки
Данные таблицы 1 свидетельствуют о принципиальных различиях в эффективности применяемых стерилизующих агентов и стратегий их использования.
Анализ эффективности стерилизации целых зерновок (Группа А).
Обработка целых зерновок показала ограниченную эффективность. Дробная стерилизация 0,3 % перманганатом калия целых зерновок в течение 15 минут оказалась полностью неэффективной, приведя к 100 %-ной контаминации культур, несмотря на приемлемую лабораторную всхожесть (70,8 %). Раствор коммерческого препарата «Чистин» продемонстрировал дозозависимый эффект: увеличение концентрации с 1:3 до 1:1 при сокращении времени воздействия с 15 до 5 минут повысило асептичность с 33,3 % до 62,5 % и общую эффективность стерилизации с 33,3 % до 50,0 %. Однако даже для наиболее результативного режима для целых зерновок (70 % этанол, 30 с) общая эффективность стерилизации составляет лишь 59,9 %.
Анализ эффективности стерилизации изолированных зародышей (Группа Б).
Прямая стерилизация изолированных зародышей оказалась более эффективной стратегией. Оба режима использования коммерческого препарата «Чистин» обеспечили 100 %-ную асептичность культур. Однако это сопровождалось снижением всхожести (~66,6 %), указывающим на выраженную токсичность гипохлорита для нежных тканей зародыша, что ограничило общую эффективность стерилизации на уровне 66,6 %.
Наиболее сбалансированный результат был достигнут при стерилизации изолированных зародышей 70 % этанолом в течение 30 секунд. Данный метод сочетал высокую стерильность (87,5 %) с максимальной в группе всхожестью (88,9 %), что обеспечило статистически значимо более высокую общую эффективность стерилизации — 77,8 %.
Сравнительная оценка ростовой активности эксплантов.
Качественные наблюдения за динамикой роста полностью коррелировали с количественными данными. Экспланты после стерилизации этанолом (вариант Б-Этанол) демонстрировали наиболее активное и синхронное прорастание уже на третьи сутки, активно формируя корневую систему. На седьмые сутки они характеризовались наибольшим ростом колеоптиле и корня. В вариантах с гипохлоритом, особенно при обработке зародышей, наблюдались признаки стресса: замедленное начало роста, формирование тонкой, слаборазвитой корневой системы, что подтверждает его угнетающее действие на физиологию экспланта.
Таким образом, на основании проведенного исследования для эффективного введения зрелых зародышей кукурузы в культуру in vitro рекомендован следующий протокол: механическая изоляция зародыша из набухшей зерновки с последующей его поверхностной стерилизацией 70 % водным раствором этанола в течение 30 секунд. Данный метод обеспечивает воспроизводимый результат с максимальной общей эффективностью стерилизации и является предпочтительным для применения в процессе микроклонального размножения кукурузы.
Заключение
Стратегия прямой стерилизации изолированных зародышей превосходит обработку целых зерновок по показателю общей эффективности стерилизации. Устранение барьера в виде семенной оболочки позволяет достичь высокой асептичности с применением менее агрессивных режимов.
Литература:
- Министерство сельского хозяйства США. Зарубежная сельскохозяйственная служба. — Текст: электронный // USDA Foreign Agricultural Service: [сайт]. — URL: https://apps.fas.usda.gov/psdonline/app/index.html#/app/home/statsByCountry (дата обращения: 08.12.2025)
- Сельское хозяйство, охота и лесное хозяйство. — Текст: электронный // Федеральная служба государственной статистики: [сайт]. — URL: https://rosstat.gov.ru/enterprise_economy (дата обращения: 08.12.2025).
- Серов, К. Н. Современное состояние производства кукурузы / К. Н. Серов. — Текст: непосредственный // Молодой ученый. — 2021. — № 22 (364). — С. 78–79.
- Yadava, Pranjal. Advances in Maize Transformation Technologies and Development of Transgenic Maize / Pranjal Yadava, Alok Abhishek Singh, Reeva Reeva Singh [et al.] // Frontiers in Plant Science. — 2017. — 6 Jan. — Vol. 7 (2016). — Art. 1949. — P. 1–15. — DOI: 10.3389/fpls.2016.01949.
- Bhojwani S. S., Razdam M. K. Plant tissue culture: theory and practice — Elsevier Science: Netherlands, 1996. — 749 p.
- Тимофеева С. Н., Смольникова Ю. В., Апанасова Н. В., Юдакова О. И. Технологии микроразмножения in vitro: Учеб.-метод. пособие. — Саратов, 2016. — 38 с.
- Клейн Р. М., Клейн Д. Т. Методы исследования растений: Пер. с англ. / Ред. В. И. Мельгунова. — М.: Колос, 1974. — 528 с.
- Хумуд Б. М. Х., Апанасова Н. В., Юдакова О. И. Введение в культуру in vitro партеногенетических линий кукурузы // Известия Саратовского университета. Новая серия. Серия: Химия. Биология. Экология. — 2018. — Т. 18, вып. 3.
- Тюкавин Г. Б. Основы биотехнологии моркови: Монография. — М.: ВНИИССОК, 2007. — 480 с.
- A novel technique for the partial isolation of the maize embryo sacs and subsequent regeneration of plants / Laurie J. D., Zhang G., McGann I. E. et al. // In Vitro Cell. Dev. Biol. — Plant. — 1999. — Vol.35. — P.320–325.
- Hе Y., Sun M., Yang H. Regeneration of fertile plants from isolated tobacco zygotes by in vitro culture // Chinese Science Bulletin. — 2004. — Vol.49. — № 8. — Р.810–814.
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plant. 1962. Vol. 15. P. 473–497.

