Целью исследования является изучение накопления биологически активных веществ (БАВ) и антиоксидантной активности в культуральной жидкости чайного гриба. Также изучалась перспектива применения чайного гриба в лечебных и профилактических целях. По полученным данным выявлено интенсивное накопление БАВ на 5–7 сутки. В свою очередь антиоксидантная активность и содержание флавоноидов больше у образца с использованием зеленого чая. При этом значение pH находится в диапазоне 6,25–3,25, являющимся оптимальным для напитка.
Ключевые слова: чайный гриб, культуральная жидкость, медузомицелла, ферментация, биологически активные вещества, флавоноиды, антиоксидантная активность.
Введение
Чайный гриб, известный во всем мире также как китайский, маньчжурский или японский гриб, гриб морской, комбуча, чайная медуза, фанго и грибной квас — это все обобщенные названия симбиоза разновидностей культуры дрожжей с бактериями в форме блина. Гриб размножается отрастающей слоистой светлой пленкой, которая в последующем времени способна превращаться в цельный самостоятельный чайный гриб.
Чайный гриб по форме похож на медузу со слизистой молочной пленкой. Именно за поразительное сходство с медузой в 1913 году немецкий миколог Густав Линдау присвоил ему научное название Medusomyces Gisevi (Медузомицет) [3]. Ее видовой состав разнообразен и зависит от условий, места и времени культивирования. Симбионт M. Gisevii состоит из культуральной жидкости, зооглеи, мезоглеи и осадок [6]. Напиток получается из заваренных в сладкой воде чайных листьев с использованием медузомицета, все вместе называют комбуча, по звучию с японским «кобутя» (напиток) и «комбу» (водоросли). Вкус кисло-сладкий, газированный, отдаленно напоминающий квас из-за процесса ферментации гриба. Многочисленные исследования по оптимизации процесса брожения, определению влияния технологических факторов на физико-химические свойства, формирование вкусо-ароматического профиля напитков, связаны с растущей популярностью чайного гриба [10].
Статья направлена на изучение содержания биологически активных веществ, находящихся в культуральной жидкости, представляющих большое разнообразие (БАВ), положительно влияющих на организм человека по сравнению с другими напитками.
Medusomyces Gisevi состоит из слизистой пленки, которая представляет две основные части: внутренняя и внешняя. Внутренний слой содержит бактерии Acetobacter xylinum , а наружный слой — дрожжевые грибы [2]. Нижняя часть гриба способна образовывать длинные дрожжевые нити, свисающие вдоль емкости, отвечающие за процесс ферментации и сбраживания. Точный биологический состав чайного гриба варьируется в зависимости от происхождения. Наиболее часто встречаются бактерии, принадлежащие к родам Acetobacter и Gluconobacter , включённым в семейство Acetobacteraceae , но наблюдаются и бактерии других семейств ( Bacterium gluconicum , Torula , Dekkera , Pichiaspecies ), при этом обычно в чайном грибе смешаны бактерии разных видов. Кворум сенсинг — это механизм, который устанавливает баланс между микроорганизмами симбионта [6]. Он позволяет симбиотическому сообществу формироваться в зависимости от в зависимости от сочетания определенных факторов. Сами дрожжевые грибы также разнообразны и могут принадлежать к более чем десятку разных родов ( Saccharomycodes ludwigii , Zygosaccharomyces sp ) [8].
Химический состав чайного гриба: Состоит из разнообразных витаминов, органических кислот, макроэлементов, микроэлементов, флавоноидов, аминокислот, сахаров и других органических веществ, влияющих на организм. Также исследования показали наличие антибактериальных свойств раствора гриба [7]. Среди разнообразных чайных листьев, зеленый чай характеризуется более высоким содержанием полифенолов по сравнению с черным чаем [5]. Анализ состава микрофлоры чайного гриба с помощью масс-спектрометра, выявил 8 видов бактерий и 7 видов дрожжей. Исследования in vitro подтверждают бактерицидные и бактериостатические свойства напитков из ферментированного чайного гриба, при этом напитки из белого и зеленого чая демонстрируют самую высокую антибактериальную активность [9]. Дрожжевые грибы гидролизуют сахарозу на глюкозу и фруктозу в присутствии фермента инвертазы, а также производят этанол в процессе гликолиза, используя фруктозу как субстрат. Бактерии используют глюкозу для синтеза глюконовой кислоты, а этанол для уксусной кислоты [8]. При этом основной процесс, который происходит, по своему характеру является брожением: дрожжевые грибы образуют спирт и углекислый газ из сахара сладкого чая, а бактерии переводят спирт в уксусную и другие органические кислоты [1].
Цель работы
Целью научной работы является изучение способности накопления биологически активных веществ (флавоноидов, витаминов, белков) и антиоксидантной активности в культуральной среде чайного гриба для применения в профилактических и лечебных целях. Изучение динамики изменения кислотности напитка чайного гриба в процессе его культивирования для определения наиболее оптимального рН. Чайный гриб, ферментированный напиток, недавно стал популярным как часть движения за функциональную пищу, поэтому его исследование несет популярный и научный характер. Помимо типа чая, используемого для ферментации чайного гриба, существенное влияние на содержание биоактивных соединений и антиоксидантную активность, оказывают параметры заваривания чая, время и температура [5].
Методы исследования
В качестве исследуемого материала использовалась культуральная жидкость чайного гриба с промежутками во времени биосинтеза. Исследования проводились на 1, 3, 5, 10 и 15 сутки ферментации. В качестве питательной среды первого опыта использовались: 100 г — сахарозы; 20 г — магазинного черного листового чая; 1 л — дистиллированной воды. В качестве питательной среды второго опыта использовались: 100 г — сахарозы; 20 г — магазинного зеленого листового чая; 1 л — дистиллированной воды. Проводилось определения нахождения в культуральной жидкости: витаминов B1 (тиамин), B2 (рибофлавин), B6 (пиридоксин), B12 (кобаламин), C (аскорбиновая кислота); белка; ароматических аминокислот; флавоноидов. Изучалась динамика антиоксидантной активности КЖ и динамика изменения pH (рис. 2).
Наличие витамина B1 (тиамин) в культуральной жидкости чайного гриба определялось с помощью качественной реакции на тиамин. Одну каплю КЖ гриба смешивают в пробирке с 5–10 каплями 10 %-го раствора гидроксида натрия (NaOH) и добавляют две капли раствора железосинеродистого калия (гексацианоферрат(III) калия (K3 [Fe(CN)6])) и нагревают. При наличии витамина раствор окрашивается в оранжевый цвет.
Наличие витамина B2 (рибофлавин) определялось при помощи качественной реакции на рибофлавин. К 5 мл КЖ добавляют 5–8 капель концентрированной соляной кислоты (HCl) и кусочек металлического цинка (Zn). При наличии витамина происходит изменение окраски.
Содержание витамина B6 (пиридоксин) находили с использование качественной реакции на пиридоксин. В пробирку вносят 2,5 мл КЖ чайного гриба, затем добавляют 1 мл 3 %-ного раствора хлорного железа (FeCl3). Раствор встряхивают и при наличии витамина раствор окрашивается в красный цвет.
Для определения витамина B12 (кобаламин) использовали качественную реакцию на кобаламин. На беззольный фильтр наносят 2–3 капли 10 %-ного раствора тиомочевины (CS(NH2)2), высушивают над горелкой, после чего наносят 1–2 капли КЖ и высушивают беззольный круг. При наличии витамина на фильтре образуется зеленый круг.
Наличие витамина C (аскорбиновая кислота) определялось с помощью качественной реакции на витамин C. В пробирку вносят 5–8 капель раствора гриба. В пробирку с КЖ приливают по 1 капле 10 %-го раствора гидроксида калия (KOH), добавляют 1 каплю 5 %-го раствора железосинеродистого калия (гексацианоферрат(III) калия (K3 [Fe(CN)6])), затем вносят по 4 капли 10 %-го раствора соляной кислоты (HCl) и 2 капли 3 %-го раствора хлорида железа(III) (FeCl3). При наличии витамина С выпадает темно-синий осадок берлинской лазури.
Осуществлялось исследование на наличие белка с помощью Биуретовой реакции — это качественная реакция на обнаружение всех белков. К 5 каплям раствора КЖ чайного гриба добавляют 5 капель 10 %-го раствора гидроксида калия (KOH) и 1–2 капли раствора медного купороса (CuSO4). При наличии белка раствор окрашивается в фиолетовый цвет.
Проводилось исследование на присутствие белка с ароматическими аминокислотами благодаря ксантопротеиновой реакции. К 5 каплям раствора КЖ чайного гриба приливают 3 капели концентрированной азотной кислоты (HNO3), и нагревают на горелке. После охлаждения пробирки к раствору добавляют 1–5 капель 10 %-го раствора гидроксида натрия (NaOH). Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
К методам анализа флавоноидов относятся ВЭЖХ, хроматоспектрофотометрия, спектрофотометрия, фотоэлектроколориметрия, денситометрия [4]. Проводились качественные реакции на фенольные соединения чайного гриба. После чего происходило определение содержания фенольных соединений в культуральной жидкости чайного гриба фотоколориметрическим методом. В колбу на 250 мл приливают 50 мл КЖ разогретой до 80–90 градусов, после чего дают настояться 5 минут. Суспензию фильтруют через бумажный фильтр. Полученный фильтрат разбавляют в 25 раз. Для этого отбирают пипеткой 4 мл раствора КЖ, переносят в мерную колбу на 100 мл и добавляют дистиллированную воду до метки, перемешивают. В пробирке смешивают 0,4 мл разбавленного раствора, 2 мл 0,5М раствора Na2CO3 и 0,2 мл реактива D (разбавленного реактива Фолина). Через 5 минут определяют оптическую плотность окрашенного раствора на ФЭК-60. Контролем является раствор 0,4 мл воды, 2 мл 0,5М раствора Na2CO3 и 0,2 мл реактива D.
Концентрацию фенольных соединений в КЖ находят по градуировочному графику (рис. 1). Для построения градуировочного графика готовят растворы танина разной концентрации, используя рабочий раствор (1) с концентрацией танина 2 мг/мл (0,2 %). Рабочий раствор разбавляют в 4 раза дистиллированной водой, получают раствор (2) с концентрацией 0,5 мг/мл. Раствор (2) используют для приготовления остальных растворов танина. В таблице 1 присутствуют результаты разведений раствора.
Таблица 1
Результаты разбавления раствора танина
|
Раствор танина |
Концентрация раствора |
|
Рабочий раствор (1) |
2 мг/мл |
|
Раствор (2) |
0,5 мг/мл |
|
5 мл раствора (2) и 5 мл воды |
0,25 мг/мл |
|
3 мл раствора (2) и 7 мл воды |
0,15 мг/мл |
|
2 мл раствора (2) и 8 мл воды |
0,1 мг/мл |
|
1,5 мл раствора (2) и 8,5 мл воды |
0,075 мг/мл |
|
1 мл раствора (2) и 9 мл воды |
0,050 мг/мл |
|
0,5 мл раствора (2) и 9,5 воды |
0,025 мг/мл |
Далее для каждого раствора танина проводят реакцию с реактивом Фолина. В пробирку вносят 0,4 исследуемого раствора, добавляют 2 мл 0,5М раствора Na2CO3, перемешивают и прибавляют 0,2 мл реактива D (разбавленного реактива Фолина). В результате реакции раствор окрашивается в синий цвет. В контрольной пробе смешивают 0,4 мл воды, 2 мл 0,5М раствора Na2CO3 и 0,2 мл реактива D. Через 5 минут определяют на ФЭКе оптическую плотность окрашенного раствора. В таблице 2 представлена оптическая плотность и концентрации растворов танина.
Таблица 2
Оптическая плотность и концентрация растворов танина
|
N , раствора танина |
C , мг/мл |
Оптическая плотность ( A )1 |
Оптическая плотность ( A )2 |
|
8 |
0,025 |
0,07 |
0,07 |
|
7 |
0,05 |
0,11 |
0,08 |
|
6 |
0,075 |
0,24 |
0,15 |
|
5 |
0,10 |
0,26 |
0,18 |
|
4 |
0,15 |
0,27 |
0,32 |
|
3 |
0,25 |
0,46 |
0,34 |
|
2 |
0,5 |
0,48 |
0,54 |
|
1 |
2 |
0,85 |
0,76 |
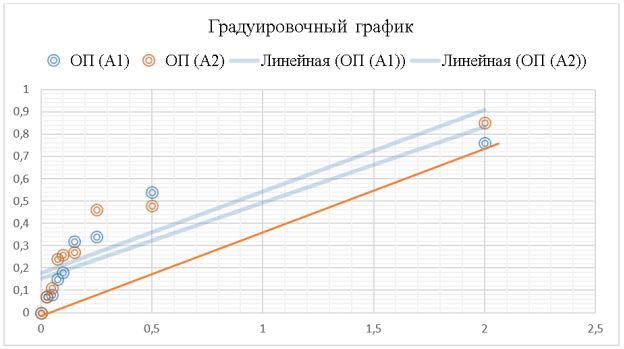
Рис. 1. Градуировочный график — зависимости оптической плотности от концентрации раствора танина
Массовую долю фенольных соединений, перешедших из навески чая в водную культуральную жидкость, X в % сухого вещества чайного гриба рассчитывают по формуле:
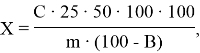
где C — концентрация фенольных соединений в разбавленном растворе чайного гриба, мг/мл;
25 — кратность разведения исходной культуральной жидкости чайного гриба;
50 — общий объем исходной культуральной жидкости гриба;
m — масса навески чая, мг;
В — влажность чая %.
Полученное значение X следует рассматривать не как общее содержание фенольных соединений в образце, а как ту их часть, которая переходит в экстракт в результате заваривания. Этот показатель можно назвать выходом фенольных соединений.
Значения pH за каждый период времени определялись при помощи лабораторного настольного тестера Milwaukee MW150 MAX. Был построен график зависимости pH за временной отрезок в течении 15 дней (рис. 2).
Антиоксидантную активность продукта можно оценить по суммарному редуцирующему действию, содержащихся в нем веществ-восстановителей. В качестве индикатора действия антиоксидантов используется 2,6-дихлорфенолиндофенолят натрия (Реактив Тильмана). Применяемый метод основан на измерении степени понижения оптической плотности раствора 2,6-дихлорфенолиндофенолят натрия под действием антиоксидантов. Степень обесцвечивания 2,6-дихлорфенолиндофенолят натрия выражается в процентах от первоначальной величины его оптической плотности. Процент обесцвечивания индикатора X %, рассчитывают по уравнению:
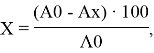
где: A0 — исходная оптическая плотность раствора индикатора;
Ax — оптическая плотность индикатора через 5 минут после добавления КЖ чайного гриба.
Контрольный опыт. В пробирку вносят 6 мл дистиллированной воды, добавляют 0,75 мл 0,001М раствора 2,6-дихлорфенолиндофенолят натрия и перемешивают. После измеряют на ФЭКе оптическую плотность при длине волны 520 нм. Рабочий опыт. В колбу на 250 мл приливают 50 мл КЖ разогретую до 80–90 градусов, после чего дают настояться 5 минут. Суспензию фильтруют через бумажный фильтр. Полученный фильтрат разбавляют в 10 раз. Для этого отбирают пипеткой 10 мл КЖ, переносят в мерную колбу на 100 мл, добавляют дистиллированную воду до метки и перемешивают. В пробирку вносят 6 мл разбавленной КЖ и 0,75 мл 0,001М раствора 2,6-дихлорфенолиндофенолят натрия, содержимое перемешивается. Через 5 минут происходит измерение оптической плотности на ФЭК. На основании полученных результатов рассчитывают антиоксидантную активность.
Результаты исследований
По результатам проведенной работы, по изучению накопления биологически активных веществ и антиоксидантной активности, было выявлено содержание различных классов БАВ в культуральной жидкости чайного гриба. В таблице 3 указаны результаты реакций на наличие БАВ.
Таблица 3
Результаты реакций на наличие различных БАВ
|
Биологически активные вещества |
Реакция |
Результат |
|
B1 (тиамин) |
Качественная реакция на витамин B1 |
Раствор окрашивается в интенсивно желтый цвет |
|
B2 (рибофлавин) |
Качественная реакция на витамин B2 |
Происходит обильное выделение водорода и изменение окраски до бурого цвета |
|
B6 (пиридоксин) |
Качественная реакция на витамин B6 |
Происходит образование красного цвета в пробирке |
|
B12 (кобаламин) |
Качественная реакция на витамин B12 |
На фильтре не образовался зеленый круг |
|
C (аскорбиновая кислота) |
Качественная реакция на витамин С |
Происходит выпадение синего осадка |
|
Белок |
Биуретовая реакция |
Раствор окрашивается в фиолетовый цвет |
|
Ароматические аминокислоты |
Ксантопротеиновая реакция |
Раствор окрашивается в желтый цвет |
Было выявлено, что на третий день ферментации происходит приспособление микроорганизмов к среде обитания и начинается процесс накопления БАВ. На 5–7 день роста происходит самый интенсивный прирост БАВ, именно в этот период времени были обнаружены большинство витаминов. Было установлено присутствие витаминов с помощью качественных реакций. Наличие ароматических аминокислот было выявлено только на пятые сутки проведения опыта. Наличие белка было выявлено на пятые сутки ферментации гриба. Флавоноиды изначально присутствуют в культуральной жидкости чайного гриба, так как в чайных листьях уже имеются биологически активные вещества, такие как катехины (органические вещества, входящие в группу флавоноидов). В таблице 4 указаны результаты наличия флавоноидов. По ним можно сделать вывод о повышенном содержании флавоноидов именно в зеленом чае.
Таблица 4
Результаты исследования на наличие флавоноидов в черном и зеленом чае
|
Культуральная жидкость чайного гриба с марками чая |
Оптическая плотность |
Выход фенольных соединений (X), % |
|||
|
Первая проба |
Вторая проба |
(X 1 ), % в первой пробе |
(X 2 ), % в второй пробе |
Влажность |
|
|
Черный чай |
0,220 |
0,210 |
7,986 |
7,569 |
10 |
|
Зеленый чай |
0,300 |
0,315 |
11,805 |
12,056 |
10 |
Черный чай:
A1 = 0,220; C1 = 0,0575 мг/мл;
A2 = 0,210; C2 = 0,0545 мг/мл;
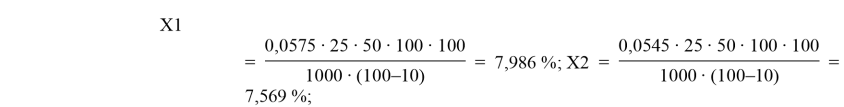
Зеленый чай:
A1 = 0,300; C1 = 0,0850 мг/мл;
A2 = 0,315; C2 = 0,0870 мг/мл;
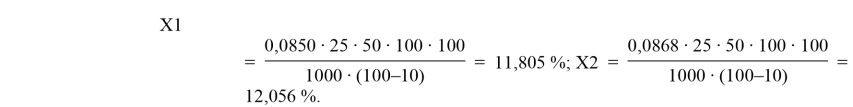
На рисунке 2 приведены результаты изменения водородного показателя за 15 суток ферментации. Значение pH играет важную роль, оно не должно опускаться ниже определенного значения, в следствии чего напиток может наносить вред организму человека. Так на первые сутки первого опыта показатель pH составлял 5,67, а второго опыта 6,25 и постепенно начинал снижаться, так как шел процесс не только спиртового брожения, но и процесс подготовки среды к жизнедеятельности чайного гриба.
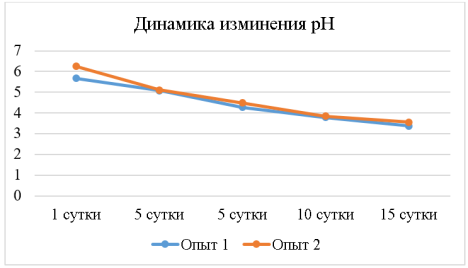
Рис.2. Динамика показателей pH культуральной жидкости чайного гриба
Результаты антиоксидантной активности указаны в таблице 5. По полученным данным можно сделать вывод о большей активности напитка с зеленым чаем.
Таблица 5
Результаты исследования на антиоксидантную активность КЖ чайного гриба
|
Культуральная жидкость чайного гриба с марками чая |
Оптическая плотность раствора индикатора |
Антиоксидантная активность чайного гриба ( X ), % |
|
|
Контрольная проба |
Рабочая проба |
||
|
Черный чай |
0,75 |
0,46 |
38,67 |
|
Зеленый чай |
0,75 |
0,34 |
54,67 |
Черный чай:
A0 = 0,75; Ax = 0,46
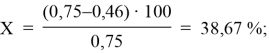
Зеленый чай:
A0 = 0,75; Ax = 0,34
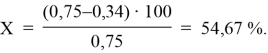
Вывод
В ходе проведенной работы можно сделать вывод, что напиток камбуча имеет большое содержание разнообразных биологически активных веществ, положительно влияющие на витаминный, минеральный и антиоксидантный баланс организма. Интенсивное накопление БАВ происходит на пятые сутки ферментации гриба, и именно в этот период потребление напитка более эффективно. Антиоксидантная активность и содержание флавоноидов в более преимущественном количестве наблюдается в напитке с использованием зеленого чая. Важным фактором является контроль pH, так как при снижении показателя до 2,5, Medusomyces gisevi может наносить вред организму. Все факторы говорят о том, что чайный гриб можно использовать в лечебных и профилактических целях в умеренных дозах при ухаживании за медузомицеллой.
Литература:
- Алиев Р. К., Аллахвердибеков Г. Б., Тагдиев Д. Г. К характеристике химического состава и некоторые фармакологических свойствах настоя чайного гриба// Известия АН Азербайджанской ССР, Баку. -1955. — № 7. — С. 285–287.
- Веревкина М. Н. Содержание минеральных элементов и соединений в культуральной жидкости и теле «чайного гриба» -Актуальные вопросы микробиологии и биотехнологии XXI века и инновационные пути их решения — Научно-практическая конференция к 100-летию СГАУ им. Н. И. Вавилова. 2012, 10–13.
- Сокольский И. Н. Медузомицет или комбуча? // Наука и жизнь 2020; — № 11 — С. 98–101.
- Федосеева Г. М., Мирович В. М., Горячкина Е. Г., Переломова М. В. Фитохимический анализ растительного сырья, содержащего флавоноиды. // Методическое пособие по фармакогнозии. Иркутск: Типография ИГМУ Минсоцзравразвития РФ. 2009. С. 67.
- Antolak H, Piechota D, Kucharska A. Kombucha Tea-A Double Power of Bioactive Compounds from Tea and Symbiotic Culture of Bacteria and Yeasts (SCOBY). Antioxidants (Basel). 2021 Sep 28;10(10):1541. doi: 10.3390/antiox10101541. PMID: 34679676; PMCID: PMC8532973.
- Flyurik, Elena & Ermakova, Olga. (2022). Medusomyces gisevii: cultivation, composition, and application. Foods and Raw Materials. 152–161. 10.21603/2308–4057–2023–1–563.
- Greenwalt C. J., Steinkraus K. H., Ledford R. A. Kombucha, the fermented tea: microbiology, composition, and claimed health effects — J. Food Prot. — 2000, Jul., 63 (7), 976–981.
- Jayabalan Rasu, Malbasa Radomir V., Loncar Eva S., Vitas Jasmina S., Sathishkumar Muthuswamy. A Review on Kombucha Tea—Microbiology, Composition, Fermentation, Beneficial Effects, Toxicity, and Tea Fungus // Comprehensive Reviews in Food Science and Food Safety. — 2014. — Vol. 13. — P. 538–550.
- Kluz MI, Pietrzyk K, Pastuszczak M, Kacaniova M, Kita A, Kapusta I, Zaguła G, Zagrobelna E, Struś K, Marciniak-Lukasiak K, Stanek-Tarkowska J, Timar AV, Puchalski C. Microbiological and Physicochemical Composition of Various Types of Homemade Kombucha Beverages Using Alternative Kinds of Sugars. Foods. 2022 May 23;11(10):1523. doi: 10.3390/foods11101523. PMID: 35627093; PMCID: PMC9141729.
- Vorobyeva VM, Vorobyeva IS, Sarkisyan VA, Frolova YV, Kochetkova AA. [Technological features of fermented beverages production using kombucha]. Vopr Pitan. 2022;91(4):115–120. Russian. doi: 10.33029/0042–8833–2022–91–4–115–120. Epub 2022 Jul 1. PMID: 36136953.







