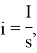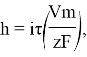В статье автор описывает применениеэлектрохимических покрытий и электрохимической металлизации.
Ключевые слова: металлизация, гальваника, травление.
В зависимости от области применения, поставленных целей и задач существует классификация покрытий. Гальванические покрытия представляют из себя тончайшие пленки от долей мкм до десятых долей мм, нанесенные на металлические и некоторые другие изделия. Гальванизация наделяет детали и конструкции, обработанные таким методом, антикоррозийными, износостойкими и декоративными свойствами.
Изменение характеристик поверхностных слоев металлических изделий приобретает все большую актуальность. Из-за увеличения нагрузок на оборудование, повышаются требования к его надежности, к тому же существует необходимость сохранения деталей от внешних воздействий: химического, биологического или климатического. Совокупность этих факторов стимулирует расширение области применения гальванических покрытий.
С помощью электрохимических технологий добиваются определенных условий, например, модификация медных покрытий наноструктурированными добавками.
Функциональные покрытия играют роль модифицирования поверхности с целью придания необходимого эффекта — например, увеличение твердости, поверхностной электропроводности, улучшения электроконтактных свойств, паяемости, изменение коэффициента трения (в любую сторону), увеличения износостойкости, придания электроизоляционных, магнитных или каких-либо специальных свойств.
Коррозионно-защитные покрытия предотвращают появления коррозии в процессе их эксплуатации, например в помещении, либо на открытом воздухе, либо в каких-либо особых климатических условиях.
Защитно-декоративные покрытия имеют косвенное влияние на защитную функцию, чаще главной целью является придание поверхности внешнего вида, требуемого дизайном изделия.
Гальваническая металлизация — метод нанесения металлических материалов на поверхности, основанный на электрохимическом процессе осаждения из электролита под действием электрического тока [6]. Основой для электрохимической металлизации является водный раствор солей металла, который содержит осаждаемый материал в виде положительно заряженных ионов. Необходимые для восстановления электроны поступают от внешнего источника постоянного тока. Под действием источника тока ионы металла движутся к катоду, присоединяют электроны, осаждаясь на нем как нейтральные атомы.
На рисунке 1 представлен принцип гальванической металлизации. Катодом является материал, подлежащий металлизации. Анодом является преимущественно осаждаемый материал.
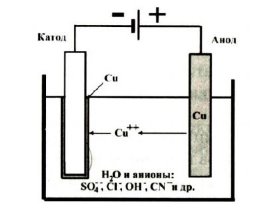
Рис. 1. Гальваническая метализация
Количественно процессы электрохимической металлизации описываются законами Фарадея, согласно которым масса вещества, выделившегося при электролизе, прямо пропорциональна количеству прошедшего электричества, а осажденные равным количествам электричества массы вещества соотносятся, как химические эквиваленты этих веществ. Таким образом, можно выразить зависимость толщины полученного слоя металла от величины плотности тока:
|
|
(1) |
где i — плотность тока, I — общий ток, S — площадь покрываемой поверхности.
|
|
(2) |
где h — толщина слоя металла, τ — длительность электролиза, V m — объем одного моля металла, z — валентность, F- постоянная Фарадея.
Плотность тока определяет скорость процесса. Эта величина изменяется при перемещении вдоль поверхности электрода. Чаще всего электрохимическое осаждение происходит при постоянном токе. Но так как в ходе металлизации реальной площади поверхности может изменяться, то также может меняться и плотность тока.
Необходимость достаточно быстрого нанесения покрытия определяет применяемая рабочая плотность тока. Но повышение плотности тока приводит к ускорению образования дендритов и росту шероховатости покрытия, именно поэтому используют плотность тока, которая составляет не больше половины диффузионной плотности тока.
Ток электролиза чаще всего включается после погружения деталей в электролит. Однако иногда загружают детали под током, например, при осаждении никеля и хрома на медь и ее сплавы. Загрузка под током производится, когда потенциал осаждаемого материала положительнее потенциала основы поэтому возможно его контактное осаждение.
Для улучшения свойств структуры и увеличения адгезии можно подавать в начале процесса повышенную плотность тока в 2–4 раза в течение 0,5–1 минуты — это называется толчком тока. При данном толчке образуется большое число мелких кристаллов, которые сцеплены друг с другом и с подложкой. Длительный толчок тока может быть вреден, так как электролит у пластины катода истощается и может начаться рост шероховатости.
При изучении процессов электрохимической металлизации определяют величину электродного потенциала. Между плотностью тока и потенциалом есть взаимосвязь, которая при установившемся режиме взаимно однозначна.
Чтобы найти зависимость плотности тока от потенциала задаются различные значения потенциала и измеряются значения плотности тока, получая ВАХ процесса. Происходит быстрое изменение потенциала, ток устанавливается постепенно — 10–100 секунд.
Задав некоторую конкретную плотность тока, можно измерить потенциал электрода и наоборот. При нулевой плотности тока регистрируется равновесный потенциал. Величина отклонения потенциала под током от равновесной величины для заданной реакции носит название перенапряжение. Перенапряжение тесно связано с характером основных стадий процесса. Оно определяет структуру осадка покрытия, его свойства. Поэтому важно изменение электродного потенциала в гальванической металлизации.
При высоком перенапряжении формируются мелкие зерна, беспористые и плотные покрытия. При увеличении абсолютной величины от потенциала по плотности тока (т. е. поляризационное сопротивление) улучшается равномерность распределения толщины покрытия.
Перенапряжение зависит от типа раствора электролита, температуры, перемешивания, добавок.
При теоретическом рассмотрении записывается зависимость плотности тока от потенциала, и тогда первая трактовка оказывается более удобной. Тот или другой фактор способствует или ускорению, или замедлению процесса. Но с другой стороны иногда оказывается возможным вклад этого фактора в перенапряжение. Например, при введении в раствор добавки повышается перенапряжение, но снижается скорость осаждения.
Еще одним важным условием является электросопротивление раствора. Общее падение напряжения на ванне складывается из величин катодного и анодного перенапряжений, падений напряжения в контактах и омического падения напряжения в растворе. Омическое падение напряжения в электролите определяется электросопротивлением и величиной тока по закону Ома.
Величина сопротивления зависит от геометрии электролизера, удельного электросопротивления раствора.
Удельная электропроводность сульфатных растворов меднения в зависимости от их составов находятся в пределах 15–25 Ом -1 м- 1 , цианидных растворов меднения — 6–16, растворов хромирования — 40–60, растворов никилирования — 37, серно-кислых растворов цинкования и кадмирования — 8–12 при температуре 20 о С.
Причиной изменения электропроводности могут служить непроводящие частицы или пузырьки газа в электролите.
Осаждение гальванопокрытий происходит из водных растворов, поэтому рабочий температурный интервал — от 15 до 70 о С. При повышении температуры снижается пассивация анодов, повышается растворимость компонентов, возрастает проводимость раствора, однако высокие температуры усложняют эксплуатацию ванн, укоряют испарение электролита, коррозионные процессы, осадки становятся крупнозернистыми и шероховатыми, перестают эффективно работать ПАВ, а снижение температуры влечет к потребности уменьшения рабочей плотности тока. Также из холодных растворов часто осаждаются напряженные покрытия, которые склонны к растрескиванию, температура должна быть оптимизированной.
Каждый электролит имеет свою рабочую температуру. Иногда необходимо поддерживать температуру с точностью до 1–2 о С, но часто отклонение на 3–5 о С является допустимым и может быть возмещено изменение плотности тока. Также нужно учитывать, что скорость процессов переноса веществ увеличиваются при увеличении температуры на 1 о С приблизительно на 2 %, скорость электрохимических и химических реакций увеличивается приблизительно на 10 %.
Перемешивание раствора является желательным в большинстве случаев, но иногда оно может нарушить образуемый тонкий слой на поверхности катодной пластины. Перемешивания обычно приводит к потребности фильтрации раствора. Перемешивают раствор сжатым воздухом, механическими мешалками, качанием катодных штанг, ультразвуком. Однако не всегда можно использовать перемешивание сжатым воздухом, так как углекислый газ и кислород могут взаимодействовать с компонентами раствора.
Перемешиванию способствует и выделяющийся на катоде водород. При электрохимической металлизации выделяется водород, когда достигается достаточно отрицательный потенциал (заметно отрицательнее потенциала водородного электрода, т. е. нулевого потенциала).
В начальном периоде выделения металла водород выделяется на металле основы. Сначала на подложке при низком перенапряжении водорода будет выделяться в основном водород, а когда осадится тонкий слой покрытия, водород начнет выделяться на металле покрытия, и скорость его выделения уменьшается.
В кислых растворах скорость выделения водорода особенно высока при низких рН. В щелочных растворах зависимость от рН намного слабее, так как водород в них выделяется не из ионов водорода, а из молекул воды или из недиссоциированных молекул органической кислоты.
На начало осаждения влияет материал подложки. Влияние будет минимальным, если поверхность основы подвергнуть механической обработке, влияние будет максимальным при химическом травлении.
Литература:
- Капица М. Гальваническая металлизация в производстве печатных плат / Технологии в электронной промышленности. № 2’2006.
- Гамбург Ю. Д. Гальванические покрытия. Справочник по применению. / Мир материалов и технологий / 2006.
- Гаврилов, С. А. Электрохимические процессы в технологии микро- и наноэлектроники. Учебное пособие для вузов. — М.; Высшее образование — М., 2009.