Статья посвящена обзору работы «Природные индикаторы». В результате анализа нами переосмыслены вопросы изучения природных индикаторов, история открытия, основная терминология. Также в работе в табличной форме представлены природные элементы, — сырье для приготовления индикаторов. На основе рассмотренного исследования автором определена возможность использования экстрактов плодов растений в качестве химических индикаторов и даны рекомендации для дальнейшего исследования.
Ключевые слова: индикатор, раствор, кислая среда, нейтральная среда, щелочная среда, качество индикаторов
В природе каждый день мы соприкасаемся с различными веществами, окружающими нас. Год назад мы начали свое знакомство с таким предметом, как химия. И возникло множество вопросов. Сколько веществ в нашем мире можно насчитать? Какие они? В чем заключается их значение и какую пользу они несут в себе? Особый интерес вызывают такие вещества, как индикаторы. Что же это такое?
На занятиях в процессе изучения темы «Важнейшие классы неорганических соединений» мы работали со следующими индикаторами: лакмус, фенолфталеин и метилоранж. Отметим, что индикаторы широко применяют в химии, в том числе и в школе. Любой ученик общеобразовательной школы сможет ответить на вопрос о том, что такое фенолфталеин, лакмус или метилоранж. К использованию индикаторов прибегают для определения реакции среды.
Как мы отмечали выше, при помощи индикаторов мы можем определить среду раствора. Их значение заключается в том, что в лаборатории или на заводе индикаторы способны продемонстрировать нам, прошла до конца химическая реакция или нет, достаточно ли добавлено одного реактива к другому и т. п.Актуальность рассматриваемой работы заключается в том, что под рукой может не оказаться необходимого химического индикатора, в связи с чем возникает необходимость знания аналогов — того из чего можно приготовить определенный индикатор. В работе выдвинут основной вопрос: можно ли в качестве индикаторов использовать природные материалы, окружающие нас?
Для начала рассмотрим сущность понятия индикатор и его основные виды. Это химическое вещество, которое изменяет окрас, люминесценцию или образует осадок в зависимости от среды и концентрации компонента в растворе [1].
Водородный показатель, pH — мера активности ионов водорода в растворе, количественно выражающая его кислотность. Это понятие ввел датский химик Серенсен для точной числовой характеристики среды раствора и предложил математическое выражение для его определения: pH= -lg [H+]. [2]
Индикаторная бумага — бумага, пропитанная химическими реактивами, предназначенная для ориентировочного определения концентрации веществ [10].
Кислотно-основные индикаторы — растворимые органические соединения, которые меняют свой цвет или люминесценцию в зависимости от концентрации ионов Н+ (pH среды). Такие индикаторы резко изменяют свой цвет в достаточно узких границах pH [11].
Универсальные индикаторы — это смесь нескольких индикаторов, подобранных так, что их раствор поочередно меняет окраску, проходя все цвета радуги при изменении кислотности раствора в широком диапазоне pH [10].
Характер среды имеет большое значение в химических и биологических процессах, в зависимости от типа среды эти процессы могут протекать с различными скоростями и в разных направлениях. Поэтому во многих случаях важно как можно более точно определять среду раствора. Существует нейтральная среда — рН = 7, рН < 7 — кислотная, при рН > 7– щелочная [5]. Среду исследуемого раствора можно приблизительно определить по окраске индикаторов.
В рассматриваемой работе также представлен опрос, который проводился в нескольких группах респондентов, целью которого было определение знаний об индикаторах среди обучающихся в школе (см. рис.1). Рассмотрим результаты двух вопросов, которые представляют наибольший интерес. Так на вопрос: «Знаете ли вы что такое индикаторы?», который включал три варианта ответа: знаю, не знаю, слышал, ярко демонстрирует, что среди 76 опрошенных 42 % уверенно знаю, что это такое, 47 % слышали, и лишь оставшиеся 11 % не знают.
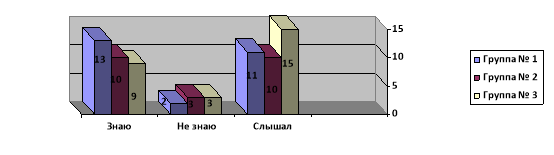
Рис. 1. Опрос «Знаете ли вы что такое индикаторы?»
А ведь красящие вещества (которые выделялись из растений) были известны и популярны уже в Древнем Риме и Древнем Египте. Активное их применение в качестве индикаторов берет свое начало в 17 веке и связанно с именем ученого физика и химика — Роберта Бойля. Однажды, когда ученый проводил исследование, вошел садовник, который принес фиалки. Цветы были оставлены на столе, и к моменту окончания работы исследователь увидел, что они дымились. С целью их спасения он опустил цветы в стакан с водой, где фиолетовые лепестки фиалок стали красными. Так, Бойль был заинтересован и продолжил опыты. Исследователь сделал вывод о том, что цвет лепестков зависит от того, какой раствор находится в стакане, какие вещества содержатся в растворе. Лучшие результаты дали опыты с лакмусовым лишайником. Бойль опустил в настой лакмусового лишайника обыкновенные бумажные полоски. Дождался, когда они пропитаются настоем, а затем высушил их. Так, впервые была изготовлена лакмусовая бумажка, которой Бойль дал название — индикатор.
Выделим индикаторы производственные и самодельные. И как же быть в том случае, если в наличии нет «настоящих» химических индикаторов? Здесь на помощь придут самодельные индикаторы из природного сырья. Они окружают нас, просто мы не задумываемся об этом. Это растительные индикаторы, которые пригодны для использования в быту. Сок свеклы, например, в кислой среде меняет свой рубиновый цвет на ярко-красный, а в щелочной — на желтый, обладая знаниями о свойствах свекольного сока, можно сделать цвет борща ярким, для этого нужно добавить немного столового уксуса или лимонной кислоты. Если в стакан с крепким чаем добавить сок лимона или растворить немного лимонной кислоты, то чай станет намного светлее. А при растворении в чае питьевой соды, наоборот, потемнеет.
В качестве природных индикаторов чаще всего используют соки или отвары ярко окрашенных плодов или других частей растений. Такие растворы нужно хранить в темной посуде. Но у природных индикаторов есть определенный недостаток: они достаточно быстро приходят в негодность — скисают или плесневеют, также трудно или невозможно отличить, например, нейтральную среду от слабокислой или слабощелочную от сильнощелочной. Поэтому в химических лабораториях используют синтетические индикаторы, которые резко меняют свой цвет в достаточно узких границах рН.
Вернемся к вопросу о том, какие индикаторы применимы дома и применяются ли они респондентами. Исходя из данных опроса больше половины, а именно 60 % респондентов не прибегают к применению индикаторов, в отличии от них 40 % опрашиваемых пользуются индикаторами (см. рис. 2).
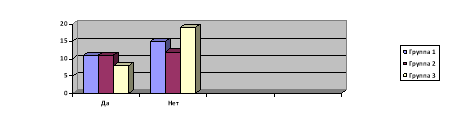
Рис. 2. Опрос «Применяете ли вы индикаторов в быту?»
Для ответа на вышеозначенный вопрос было проведено исследование отваров плодов и растений, таких как, морковь, раствор порошка куркумы, смородина (ягода), свекла, клюква (ягоды), малина (ягоды). Были приготовлены отвары обозначенных растений и плодов. Отвары готовились непосредственно перед опытом следующим образом: к 30 граммам ягод добавляли 1 столовую ложку горячей воды, доводили раствор до кипения, охлаждали, давали раствору отстоятся, отфильтровывали, готовым отваром были пропитаны полоски фильтровальной бумаги, которые высушивались, хранили в темной посуде, испытывалось действие приготовленных индикаторов в растворах со щелочной средой (раствор соды), с кислой средой (раствор уксусной кислоты). Все взятые для исследований растворы меняли или не меняли свой цвет в зависимости от среды. Результаты полученных исследований были занесены в таблицу (см. таблицу 1).
Таблица 1
Изменение цвета
|
Сырье для приготовления индикатора |
Естественный цвет индикатора |
Цвет врастворе | ||
|
В кислой среде pH<7(70% уксусная кислота) |
В щелочной среде pH>7 (пищевая сода) |
В нейтральной среде pH=7 (вода) | ||
|
Морковь (плоды) |
Светло-оранжевый pH=6 |
Желтый |
Светло-голубой |
Прозрачный |
|
Свёкла (плоды) |
Рубиновый pH=4 |
Ярко-красный |
Светло-оранжевый |
Светло-розовый |
|
Куркума (порошок) |
Оранжевый pH=5 |
Жёлто-зелёного |
Бордового |
Оранжевый |
|
Черная смородина (плоды) |
Бордовый pH=0 |
Темно-красный |
Тёмно-синий |
Зеленоватый |
|
Клюква (плоды) |
Малиновый pH=1 |
Зелёный |
Розовый |
Зелёно-желтый |
|
Малина (плоды) |
Розовый pH=3 |
Голубой |
Красноватый |
Зеленоватый |
Данный опыт демонстрирует, что при отсутствии производственных индикаторов, можно использовать самодельные индикаторы из природного сырья. Так, в качестве сырья могут выступать цветы герани, лепестки пиона или мальвы, ирис, темные тюльпаны или анютины глазки, а также ягоды малины, черники, черноплодной рябины, соки вишни, смородины, винограда, плоды крушины и черемухи. Эти природные индикаторы содержат вещества, способные менять свой цвет в ответ на то или иное воздействие. И, попадая в кислую или щелочную среду, они наглядным образом сигнализируют об этом. Во всех растворах результаты тестирования совпали с универсальными, отметим, что у индикаторов из черной смородины и малины они были более точными.
Результаты рассматриваемой исследовательской работы принимали участие в школьной научно-практической конференции учащихся в секции географии, биологии и химии, где были отмечены дипломом за 2 место, а также в X открытой городской межпредметной научной конференции «За страницами учебника», где были отмечены дипломом 2 степени (см. рис.3).

Рис. 3. Участие в конференциях
Также выделим, некоторые выводы, представленные в исследовании:
- В качестве природных индикаторов можно использовать ярко окрашенные цветы и плоды растений;
- Растворы природных индикаторов можно приготовить и использовать в домашних условиях;
- Пигменты растений могут использоваться в качестве индикаторов, они обладают достаточной чувствительностью особенно ярко окрашенные, как и наиболее «профессиональные» индикаторы: лакмус, фенолфталеин и метиловый оранжевый;
- Интенсивность окраски индикаторов от концентрации используемых растворов, позволяет приблизительно оценить агрессивность среды;
- Растворы растительных индикатор могут быть использованы в качестве кислотно-основных индикаторов для определения среды растворов школьной химической лаборатории. Легкость приготовления и безопасность делают подобные индикаторы легкодоступными, а значит хорошими помощниками в работе с кислотами и основаниями;
Подводя итог, отметим, что поставленные цели и задачи исследовательской работы «Природные индикаторы» были решены. Опытным путем была определена возможность использования экстрактов плодов растений в качестве химических индикаторов, что представляет особую ценность исследования. Это было отмечено призовыми местами на конференциях. Данное исследование автором будет продолжено, в качестве корректировки было принято решение расширить опрос и провести среди студентов 1 курса КНИТУ, также в дальнейшем исследовании будет проведен сравнительный анализ натуральных и производственных индикаторов.
Литература:
- Аванта. Энциклопедия для детей. Том 17. Химия. — М.: Аванта+, 2000. — 640 с.
- Аликберова Л. Ю. Занимательная химия. — М.: АСТ-Пресс, 2012. — 560 с
- Аликберова Л. Ю., Степин Б. Д. Занимательные задания и эффектные опыты по химии. — М.: Дрофа, 2009. — 432 с.
- Алхимик // «Добрые советы». URL: www.alhimik.ru (дата обращения: 19.05.2018).
- Байкова В. М. Химия после уроков. — Петрозаводск: Карелия, 1984. — 198 с.
- Габриелян О. С., Сладков С. А. Химия. 8 класс. — М.: Дрофа, 2017. — 208 с.
- Леенсон И. А. Занимательная химия. — М.: Росмэн-Пресс, 2001. — 104 с.
- Леенсон И. А. Язык химии. Этимология химических названий. — М.: Corpus (АСТ), 2017. — 464 с.
- Савина Л. А. Я познаю мир. Детская энциклопедия. Химия. — М.: АСТ, 1996. — 448с.
- Свердлова Н., Радугина О., Карташов С. Химия. Справочник для школьников и поступающих в вузы. — М.: АСТ-Пресс, 2017. — 576 с.
- Штремплер Г. И. Домашняя лаборатория (Химия на досуге). — М.: Просвещение, 2007. — 97 с.

