В мировой практике с нарастающей интенсивностью ведутся работы по созданию новых биологически активных веществ. Основу таких работ обычно составляют исследования по синтезу и выявлению эффективности их использования, а также по разработке простых и экологически привлекательных методов получения таких веществ.
Азольные гетероциклические соединения являются элементами структуры большого числа разнообразных биологически активных веществ (метамизол натрия, флуконазол, кетоконазол, метронидазол и т. д.), обладающих обезболивающей, противовоспалительной, противогрибковой, противопротозойной, антибактериальной и другими видами активности.
На основании литературных данных было предположено, что соединения, содержащие в своей структуре два азотсодержащих гетероцикла, могут обладать ценными свойствами. Так, роль химии в производстве сельскохозяйственной продукции велика, и применение химических препаратов пока неизбежно и необходимо. Поэтому требования сегодняшнего дня — поиск, синтез и внедрение на поля новых регуляторов роста, обладающих минимальной токсичностью и мутагенной активностью. В настоящей работе представлена схема синтеза новых структур, потенциально обладающих рострегуляторными свойствами по отношению к растениям.
Общая схема синтеза состоит из трех основных стадий:
− Синтез азотсодержащих гетероциклических соединений (пиразолонов)
− Галогенирование (хлорирование или бромирование)
− Синтез натриевой соли азола и замена галогена на азол.
Но не все варианты комбинаций представленных стадий приводят к надлежащим результатам. Были исследованы три представленных на схеме пути синтеза:
- На первой стадии получается пиразолон, затем он галогенируется и на третьей стадии вступает в реакцию с натриевой солью азола с получением целевого продукта.
- На первой стадии галогенируется дикарбонильное соединение, затем в реакции с гидразин гидратом получаем галогенированный пиразолон и на последней стадии реакция с солью азола.
- На первой стадии галогенируется дикарбонильное соединение, затем заменяем галоген на азол и на третьей стадии в реакции с гидразин гидратом получаем целевое соединений.
Выбор способа галогенирования зависел от выбранного пути синтеза:
- В 1 и 3 галогенирование можно было проводить путем действия сульфурилхлорида в четыреххлористом углероде или хлороформе, предварительно охлаждая реакционную массу до 0ОС, и перемешивая в течение 4 часов. После чего, целевой продукт может быть выделен перегонкой в вакууме водоструйного насоса. Выход составляет 70–75 %. [1, 2]
- Универсальным является метод галогенирования с использованием N-бромсукцинимида или N-хлорсукцинимида в тетрагидрофуране. Выход целевого продукта можно повысить до 80–90 % используя хлорид алюминия или тетрагидроборат лития. Целевой продукт может быть выделен перегонкой в вакууме водоструйного насоса. [3, 4, 5, 6]
Метод А нельзя использовать в 1 пути синтеза, так как целевой продукт оказывается сильно загрязнен и выход падает до 30–40 %. Метод Б — более затратный и характеризуется большим количеством побочно образующихся продуктов реакции (они легкоотделимы и не влияют на выход целевого продукта, но необходимость их утилизировать в будущем может привести к дополнительным затратам).
Таким образом, был выбран метод галогенирования А и отклонен путь синтеза 1.
Получение пиразолонов осуществляется путем кипячения дикарбонильных соединений с гидразин гидратом в этаноле с обратным холодильником в течение 24 часов. Целевые пиразолоны выпадают в осадок и отфильтровываются по окончании реакции. Получение пиразолонов из а-хлордикарбонильных соединений проходит с низким выходом, и целевые продукты сильно загрязнены, из-за чего второй путь синтеза не подходит. [7, 8, 9, 10]
В итоге был принят за прототип путь синтеза 3 (рис. 1).
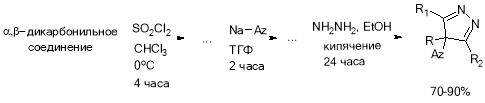
Рис. 1. Разработанная схема синтеза
Отделение целевых продуктов от примесей оказалась весьма тривиальной задачей, так как все вещества оказались достаточно устойчивыми, то был выбран способ перегонки в вакууме масляного насоса. Однако целевые продукты могут быть выделены также методом фильтрации с последующим промыванием небольшим количеством воды и петролейного эфира.
В связи с тем, что целевые продукты представляют собой сложные органические соединения с двумя гетероциклами в структуре, их идентификация — сложная задача. На основании какого-либо одного метода исследования невозможно с уверенностью утверждать о структуре продуктов. Необходимо проведение ряда стандартных аналитических работ: регистрация спектров ЯМР на ядрах 1H и 13С, регистрация масс-спектров в заданном интервале m/z, анализ пиков в режиме высокого разрешения и математическая обработка, регистрация элементного состава соединения, определение температуры плавления. Таким образом, подтверждается идентичность структуры соединений и определяется степень чистоты.
Литература:
- Atkins E. F. et al. Pseudohalogen chemistry. XI. Some aspects of the chemistry of α-thiocyanato-β-dicarbonyl compounds // Tetrahedron. — 1994. — Т. 50. — №. 24. — С. 7253–7264.
- Brasil E. M. et al. Azo-hydrazo conversion via [1,5]-hydrogen shifts. A combined experimental and theoretical study // Tetrahedron. — 2012. — Т. 68. — №. 34. — С. 6902–6907.
- Sreedhar B., Surendra Reddy P., Madhavi M. Rapid and Catalyst‐Free α‐Halogenation of Ketones using N‐Halosuccinamides in DMSO // Synthetic Communications. — 2007. — Т. 37. — №. 23. — С. 4149–4156.
- Tanemura K. et al. A mild and efficient procedure for α-bromination of ketones using N-bromosuccinimide catalysed by ammonium acetate // Chemical communications. — 2004. — №. 4. — С. 470–471.
- Yang D., Yan Y. L., Lui B. Mild α-halogenation reactions of 1,3-dicarbonyl compounds catalyzed by Lewis acids // The Journal of organic chemistry. — 2002. — Т. 67. — №. 21. — С. 7429–7431.
- Meshram H. M. et al. A green approach for efficient α-halogenation of β-dicarbonyl compounds and cyclic ketones using N-halosuccinimides in ionic liquids // Tetrahedron letters. — 2006. — Т. 47. — №. 6. — С. 991–995.
- Rodgers J. et al. Tetracyclic inhibitors of Janus kinases: заяв. пат. 11/115,702 США. — 2005.
- Abdel Hafez A. A. et al. Synthesis of some new 8-quinolinyloxy-5-sulfonamide derivatives // Collection of Czechoslovak chemical communications. — 1994. — Т. 59. — №. 4. — С. 957–977.
- Abdel-Rahman T. M. Heterocyclic compounds from 4h-3, 1-benzoxazin-4-one derivatives as anticancer agent // Journal of heterocyclic chemistry. — 2005. — Т. 42. — №. 7. — С. 1257.
- Granberg I. I., Nam N. L., New type of condensation of 5-pyrazolones unsubstituted at the nitrogen. // Chem. Heterocycl. Comp. — 30. — 5. — C. 540–543.
[1] Работа поддержана грантом «УМНИК» 9750ГУ2/2015.

