В статье автор исследует потенциальную биологическую активность азометинов камфоры и о-, м-, п-(1,2,3-тиадиазол-4-ил)-анилинов. В синтезе N-(-4-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имина был использован нитроимин камфоры в качестве агента для ввода борнилиденового фрагмента в молекулу.
Ключевые слова: потенциальная биологическая активность, азометины, камфора, 1,2,3-тиадиазол.
Введение
Терпены и терпеноиды, будучи природными соединениями, обладают широким спектром биологической активности, который открывает возможности для их применения в медицине и фармакологии, в частности, в качестве иммуномодуляторов, антивирусных и противораковых агентов. Имины камфоры также представляют интерес как соединения имеющие антивирусную и антимикобактериальную активность [1]. Ряд соединений, содержащих фрагмент 1,2,3-тиадиазола также обладает высокой биологической активностью по отношению к растениям, благодаря чему препараты на их основе применяются в сельском хозяйстве [2]. Присоединение субстрата, содержащего фрагмент 1,2,3-тиадиазола, к молекуле камфоры позволяет расширить биологическую активность ее производных.
Материалы и методы
Спектры ЯМР 1 H, 13 С получены на приборе Bruker DPX-400, внутренний стандарт — тетраметилсилан, растворитель — CDCl 3 химические сдвиги в δ-шкале. Для колончатой хроматографии использовали силикагель марки Chemapol 40/100. Контроль над ходом реакций осуществляли методом ТСХ на пластинах Silica gel 60 F254, проявление осуществляли ультрафиолетом или парами иода. Оксим и нитроимин камфоры получали по описанным ранее методикам [4, 5].Для предсказания потенциальной биологической активности была использована программа «PASSonline».
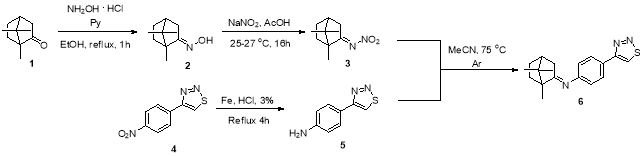
Синтез 1,7,7-триметилбицикло [2.2.1]-бициклогептан-2-он оксима (2) [4]
В круглодонную колбу, снабженную обратным холодильником и магнитным якорем, добавили 15 г (98.68 ммоль) камфоры 1 , после чего в колбу приливали 75 мл этанола при перемешивании. После полного растворения камфоры в этаноле в колбу добавили 15 г (214.29 ммоль) гидрохлорида гидроксиламина и 75 мл (930.38 ммоль) пиридина. Реакционную массу перемешивали при нагревании 1 ч с момента приготовления, затем на роторном испарителе отогнали этанол (45 о С) и пиридин (80 о С) до выпадения белого кристаллического осадка. Осадок перенесли в керамическую чашу и растирали с 20 мл воды и оставили упариваться до получения постоянной массы продукта. Выход 13,5 г (76 %), бесцветные кристаллы, t пл = 118 -119 o C. Спектр ЯМР 1 H (CDCl 3 , 400 MHz), δ, м.д.: 0.80 (s, 3H), 0.92 (s, 3H), 1.01 (s,3H), 1.16–1.28 (m, 1H), 1.42–1.52 (m, 1H), 1.70 (td, 1H), 1.79–1.90 (m, 1H), 1.92 (t, 1H), 2.06 (d, 1H), 2.55 (dt, 1H), 8.93 (s, 1H). Спектр ЯМР 13 C (СDCl 3 , 101 MHz) δ, м.д.: 11.1, 18.5, 19.4, 27.2, 32.6, 33.0, 43.7, 48.3, 51.8, 169.9.
Синтез N -(1,7,7-триметилбицикло [2.2.1]гептан-2-илиден)нитрамида (3) [5]
В круглодонную колбу на 50 мл, снабженную магнитным якорем и капельной воронкой добавили 2,3 г (13.77 ммоль) оксима камфоры 2 и 11.5 мл уксусной кислоты. Затем при помощи капельной воронки добавляли 11 мл 15 %-го NaNO 2 (28.41 ммоль). Реакционную смесь перемешивали при комнатной температуре (24–27 o C). Ход реакции контролировали с помощью ТСХ спустя 16 ч (примечание 2). По окончании реакции смесь подщелачивали водным раствором NaOH до pH 12, водный раствор экстрагировали этилацетатом (4x10 мл), органический слой сушили над Na 2 SO 4 , раствор упаривали на роторном испарителе с получением маслообразного продукта, кристаллизующегося при 5 o C. Выход 2.1 г (87 %). 1 H ЯМР (CDCl 3 , 400 MГц): 0.89 (s, 3H), 0.99 (s,3H), 1.05 (s, 3H), 1.27–1.37 (m, 1H), 1.51–1.62 (m, 1H), 1.80–1.99 (m, 2H), 2.04 (t, 1H), 2.13 (d, 1H), 2.69 (ddd, 1H). 13 C ЯМР (CDCl 3 ,101 MГц): 10.3, 18.6, 19.4, 26.7, 31.5, 35.1, 43.4, 48.8, 54.1, 189.4.
Синтез 4-( 1,2,3-тиадиазол-4-ил )анилина (5)
В круглодонную двугорлую колбу на 100 мл, снабженную обратным холодильником и магнитным якорем поместили 2 г (9.66 ммоль) 1-нитро-4-(1,2,3-тиадиазол-4-ил)бензола 4 и 7,5 г (133.93 ммоль) железных опилок. В колбу при нагреве и перемешивании добавили 50 мл воды и каплю концентрированной соляной кислоты для активации железа. Затем, через капельную воронку добавляли 15 мл 3 % HCl (12.32 ммоль) небольшими порциями с интервалом 3–5 минут. Контроль реакции проводили спустя три часа после последнего прибавления 3 % HCl при помощи тонкослойной хроматографии (примечание 1). По окончании реакции смесь охлаждали до комнатной температуры и подщелачивали до pH 8 водным K 2 CO 3 . Продукт экстрагировали этилацетатом (4x10 мл), экстракт фильтровали на бумажном фильтре. Для удаления примесей исходного компонента экстракт промывали 3 % HCl (4x5 мл). Полученный раствор обрабатывали водным K 2 CO 3 до pH 7 и наблюдали выпадение светло-коричневого осадка амина. Осадок отфильтровывали на фильтре Шотта. Остаток поместили в сушильный шкаф для выпаривания влаги. Выход продукта составил 0.7 г (39 %). Спектр ЯМР 1 H (CDCl 3 , 400 MГц), δ, м.д.:3,91 (s, 2H NH 2 ), 6.82 (d, C 1 Ar H, C 5 Ar H), 7.88 (d, C 3 Ar H, C 4 Ar H), 8.46 (s, C-S 1H). Спектр ЯМР 13 C (СDCl 3 , 101 MГц) δ, м.д.: 115.3, 127.4, 128.7.
Синтез N -(-4-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имина (6)
В пробирку с магнитным якорем добавили 0.050 г (0.255 ммоль) нитроимина камфоры 3 , 0.068 г (0.384 ммоль) 4-(1,2,3-тиадиазол-4-ил)анилина и 10 мл ацетонитрила. Реакцию проводили 7 дней в атмосфере аргона при 75 о С. Ход реакции контролировали с помощью ТСХ (примечание 3). Очистку продукта осуществляли с помощью колончатой хроматографии. Выход
0.034 г (43 %). 1 H ЯМР (CDCl 3 , 400 MГц): 0.92 (s, 3H), 1.01 (s,3H), 1.13 (s, 3H), 1.27 (m, 2H), 1.57 (m, 1H), 1.72 (m, 1H), 1.77–1.86 (m, 2H), 1.90–1.95 (m, 2H), 2.24–2.28 (d, 1H), 6.89–6.91 (d, 2H), 7.99–8.01 (d, 2H), 8.59(s, 1H). 13 C ЯМР (CDCl 3 ,101 MГц): 11.2, 19.1, 19.6, 27.4, 32.1, 36.3, 43.8, 47.3, 54.2, 120.3, 125.8, 128.22, 128.76, 153.5, 163.0, 185.57.
Примечания
- Реакционную смесь контролировали с помощью ТСХ на силикагеле с пластиковой подложкой. Элюент: хлороформ / метанол (9:1). R f 4-(1,2,3-тиадиазол-4-ил)нитробензола 4 и амина 5 0.80 и 0.50 соответственно.
- Реакционную смесь контролировали с помощью ТСХ на силикагеле с пластиковой подложкой. Элюент: гексан / этилацетат (10:1). R f оксима 2 инитроимина камфоры 3 0.16 и 0.46 соответственно. Пятно оксима камфоры 2 проявляли, при помещении пластинки в иодную камеру.
- Реакционную смесь контролировали с помощью ТСХ на силикагеле с пластиковой подложкой. Элюент: гексан / этилацетат (4:1). R f азометина 6 , амина 5 и нитроимина 3 0.30, 0.082 и 0.62 соответственно.
Результаты и обсуждение
В данной работе был осуществлен синтез N -(-4-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имина 6 путем взаимодействия нитроимина камфоры 3 с 4-(1,2,3-тиадиазол-4-ил)анилином 5 в атмосфере аргона при 75 о C. Нитроимин камфоры 3 в силу высокой электрофильности атома углерода при атоме азота способен взаимодействовать с различными нуклеофилами в мягких условиях, благодаря чему борнилиденовый фрагмент можно вводить в различные нуклеофильные субстраты. Нитроимин камфоры 3 для конденсации с 4-(1,2,3-тиадиазол-4-ил)анилином 5 получали из оксима 2 , обработав его ледяной уксусной кислотой и 15 % водным раствором NaNO 2 . Амин 5 был получен восстановлением 1-нитро-4-(1,2,3-тиадиазол-4-ил)бензола железом в присутствии 15 % соляной кислоты в водной среде. Строение промежуточного и конечного продуктов было подтверждено ЯМР 1 H и 13 С-спектроскопией.
С помощью программы PASS online для производных камфоры и п -, м - и о -(1,2,3-тиадиазол-4-ил)анилина была рассчитана потенциальная биологическая активность, данные по расчету потенциальной активности сведены в таблице 1.
Таблица 1
Расчетная биологическая активность азометинов камфоры
|
№ |
Формула |
Антагонист гестогеновых рецепторов |
Ингибитор протеинки-назы | |
|
1 |
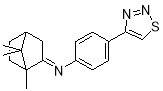
N -(-4-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имин |
|
0.613 |
0.589 |
|
2 |
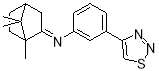
N -(-3-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имин |
|
0.597 |
0.578 |
|
3 |
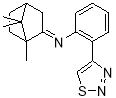
N -(-2-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имин |
|
0.606 |
0.582 |
Анализ расчета биологической активности показал следующие данные:
— азометины камфоры и (1,2,3-тиадиазол-4-ил)анилинов обладают потенциальной биологической активностью в качестве антагонистов гестогеновых рецепторов и ингибиторов протеинкиназы;
— согласно проведенным расчетам, наибольшей потенциальной активностью обладает N -(-4-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имин.
Заключение
- Был осуществлен синтез N -(-4-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имина, путем взаимодействия нитроимина камфоры 3 и 4-(1,2,3-тиадиазол-4-ил)анилина 5 в атмосфере инертного газа (аргон).
- Анализ расчетной биологической активности азометинов камфоры и п -, м - и о -(1,2,3-тиадиазол-4-ил)анилина показал, что данные производные обладают потенциальной активностью как антагонисты гестогеновых рецепторов и ингибиторы протеинкиназы.
- Из данного ряда азометинов наибольшей потенциальной биологической активностью обладает N -(-4-(1,2,3-тиадиазол-4-ил)фенил)-1,7,7-триметилбицикло [2.2.1]гептан-2-имин.
Литература:
- Sokolova, A. S., Yarovaya, О. I., Shernyukov, А. V. et. al. New quaternary ammonium camphor derivatives and their antiviral activity, genotoxic effects and cytotoxicity. Bioorganic & Medicinal Chemistry.: 2013, P. 6690–6698.
- Kalinina, T. A, Balandina, V. I., Obydennov, K. L. et. al. Synthesis, Fungicidal Activity and Plant Protective Properties of 1,2,3-Thiadiazole and Isothiazole-Based N -acyl- N -arylalaninates. Molecules.: 2023, V. 28, № 1, P. 1–19.
- Emerson Teixeira da Silva, Luciano da Silva Santos, Gabriel Fernandes de Andrade, et. al. Camphor nitroimine: a key building block in unusual transformations and its applications in the synthesis of bioactive compounds. Molecular Diversity.: 2022, V.26, P. 3463–3483.
- Hill, R. K., Gary McKinnie, B., Conley, R. T. et. al. Novel products from Beckmann fragmentation of camphor oxime in polyphosphoric acid. Tetrahedron.: 1988, V. 44, № 11. P. 3405–3412.
- Emerson T. da Silva. Preparation of N-(1,7,7-Trimethylbicyclo [2.2.1]heptan-2-ylidene)nitramide / Emerson T. da Silva, Adriana M. Moraes, Adriele da S. Araújo, Marcus V. N. de Souza // Org. Synth. — 2018. — V. 95. — P. 192–204.