В статье представлены результаты химического эксперимента по получению полисахаридных пленок на основе хитозана и пектина. Рассмотрены методики микробиологического посева на плотные среды и фиксации колоний микроорганизмов нагреванием. Определен видовой состав микроорганизмов, осуществляющих процесс биодеструкции.
Ключевые слова: пектины, хитозан, микробиологический посев, фиксация колоний микроорганизмов, видовой состав микроорганизмов.
В настоящее время резко возросла востребованность в природных полимерах благодаря их возобновляемости как источников сырья, способности к биодеградации и присущему только им комплексу свойств. Полисахариды, обладающие широким спектром биологической активности, нашли широкое применение в целом ряде областей промышленности. Их использование легло в основу создания технологии водоочистки, переработки различных видов техногенных отходов и др. Перспективным направлением является разработка биодеградируемых упаковочных материалов на их основе.
Цель работы: получить полисахаридные пленки и изучить процесс их биодеструкции.
Методы исследования: теоретические (анализ учебной и научно-популярной литературы по данной теме); экспериментальные (получение пектина и пектин-хитозановых пленок; микробиологический посев; фиксация колоний микроорганизмов, определение видового состава микроорганизмов).
Организация исследования.
На первом этапе был проведен анализ научно-популярной литературы по выбранной теме.
Пектиновые вещества, или пектины-полисахариды, образованные остатками главным образом галактуроновой кислоты. Они присутствуют в растворимой и нерастворимой формах практически во всех наземных растениях, особенно во фруктах, и в некоторыхводорослях.
Пектины, являясь структурным элементом растительных тканей, способствуют поддержанию в нихтургора, повышают засухоустойчивость растений, устойчивостьовощейи фруктов при хранении. Эти свойства пектинов нашли широкое применение данных полисахаридов в различных отраслях промышленности [3]. Структурная формула пектина представлена на рисунке 1.

Рис.1. Структурная формула пектина
Для характеристики пектина, полученного из различного растительного сырья, определяют ряд показателей и свойств: влажность, массовую долю пектина, сопутствующие вещества, свободные карбоксильные группы, степень ацетилирования, рН 1 %-го раствора пектина, а также его студнеобразующую и комплексообразующую способность. Комплексообразующая способность основана на взаимодействии молекулы пектина с ионами тяжелых и радиоактивных металлов.
Хитин — важный структурный полисахарид беспозвоночных животных (главным образом членистоногих). Из него, в частности, построен наружный скелет ракообразных и насекомых. Хитин также частично или полностью замещает целлюлозу в клеточных стенках сапрофитных растений, например, грибов [1].
Структуру хитина составляют N-ацетил-В-глюкозаминовые звенья, соединенные р-(1,4)-гликозидными связями. При деацетилировании хитина получается хитозан. Структурная формула хитозана представлена на рисунке 2.
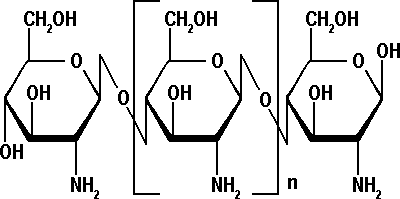
Рис.2. Структурная формула хитозана
Полисахариды хитин и хитозан, а также их производные считаются перспективными биоматериалами будущего. Проведенные исследования показали особые сорбционные свойства хитозана. Структура молекулы хитозана обусловливает проявление ряда полезных свойств, а также его низкую токсичность и способность к биодеградации [4].
Второй этап был связан с проведением эксперимента по получению яблочного пектина в домашних условиях и формованию пектин-хитозановых пленок.
Выделение пектина в домашних условиях было проведено из яблок методом экстракции. Для получения пектин-хитозановых пленок использовали полифракционный хитозан из панциря ракообразных (изготовитель — ЗАО «Биопрогресс»). Для растворения хитозана использовали 4 % уксусную кислоту. Во время сливания раствора пектина с раствором хитозана происходило образование сгустка. Сгусток имел гелеобразную структуру. Для придания прочности добавляли порошок хлорида лития. Для придания пластичности пленке в композицию вводили пластификатор (глицерин). Раствор наливали на заранее очищенное и обезжиренное стекло [6]. Компоненты подбирали, варьируя их процентное содержание для получения биодеградируемой пленки с наилучшими показателями (целостная структура, пластичность, способность отделяться от носителя, прозрачность). Оставляли пленку сохнуть при комнатной температуре на 7–10 дней. Полученные показатели представлены в таблице 1.
Таблица 1
Влияние процентного соотношения хитозана ипектина на отдельные показатели пленок
|
№п/п |
Состав пленки |
Показатели | ||||||
|
Хитозан,% |
Пектин,% |
LiCl, г |
Глицерин, мл |
Структура |
Пластичность |
Способность отделяться от носителя |
Прозрачность | |
|
1 |
70 |
30 |
0,5 |
0,5 |
однородная |
пластичная |
хорошо отделяется |
непрозрачная |
|
2 |
80 |
20 |
0,5 |
0,5 |
однородная |
хрупкая |
плохо отделяется |
прозрачная |
|
3 |
50 |
50 |
1 |
1 |
неоднородная |
пластичная |
хорошо отделяется |
непрозрачная |
|
4 |
30 |
70 |
1 |
1 |
неоднородная |
хрупкая |
хорошо отделяется |
непрозрачная |
После получения пленок был произведен микробиологический посев на плотную питательную среду и фиксация колоний микроорганизмов нагреванием.
Посев — один из стационарных методов культивирования микроорганизмов на питательных средах, применяемый для культуральной диагностики в медицинской микробиологии, а также для исследования биохимических и биологических свойств в различных биотехнологических целях. В зависимости от содержания исследуемых бактерий в образце, проводят посев на плотные питательные среды (для получения изолированных колоний и определения чистоты культуры). Если в исследуемом материале содержание микроорганизмов незначительное, то посев проводят на жидкие среды обогащения [5].
В данном эксперименте использовалась простая питательная среда — мясо-пептонный агар (МПА) на чашках Петри, на эту питательную среду помещались полученные полисахаридные пленки на основе пектина и хитозана (использовались образцы пленок с наилучшими свойствами). Затем делался посев воздуха в учебной аудитории на полученную питательную среду — открывали чашки Петри и оставляли на 5 минут. После этого закрытые чашки Петри помещали в термостат на 7 суток. По истечении 7 суток производили фиксацию колоний микроорганизмов нагреванием.
Фиксация — обработка образца, предназначенного для микроскопирования, с целью сохранить, насколько это возможно, их структуры в неизменном состоянии. В микробиологии часто применяется фиксация нагреванием [5]. При помощи микробиологической петли из чашки Петри на предметное стекло в каплю воды перемещали часть колонии микроорганизмов, оставляли на несколько минут до полного высыхания. Далее зажигали спиртовку и над пламенем спиртовки проводили несколько резких движений предметным стеклом, давая ему нагреться. После нагревания проводили окраску препаратов фуксином или метиленовой синью, оставляя на несколько минут. Зачем промывали предметное стекло водой и оставляли на воздухе до полного высыхания. Готовые фиксированные препараты рассматривали под микроскопом.
Полученные результаты микробиологического исследования полисахаридных пленок прошли обработку для определения видового состава микроорганизмов, осуществляющих процесс биоразложения. Для этого были сформированы образцы пленок на основе пектина и хитозана (с %-м содержанием 50:50 и 70:30), и образцы с добавлением йода, обладающего антисептическими свойствами (с %-м содержанием пектина и хитозана 50:50 + йод и 70:30 + йод). Эти образцы были помещены в чашки Петри на безуглеродную среду Чапека-Докса и опрыскивались суспензией отдельных видов спор гостированных тест-культур грибов Aspergillus terreus и Penicillium cyclopium. Далее чашки Петри помещались в термостат. Продолжительность испытаний — 10 суток при температуре 29° ± 2° и влажности > 90° C. Исследования показали, что данные грибы могут активно участвовать в биодеградации данных образцов (степень обрастания составляла 5 баллов, т. е. наблюдалось обрастание образца более 25 %).
Для выделения диких штаммов, которые могли бы разрушать данные полимеры, последние помещали в чашки Петри на полную питательную среду Чапека-Докса с сахарозой на 28–30 суток. Далее чашки Петри помещались в термостат при температуре 29° ± 2° и влажности > 90° C. Через 28–30 суток выросшие на образцах микромицеты пересевали методом укола для выделения чистой культуры и идентификации на полную питательную среду Чапека-Докса с сахарозой. Через 7–10 суток проводилась идентификация данных микромицетов по анатомо-морфологическим и физиологическим признакам с помощью определителей грибов.
Чистые культуры для хранения пересевались в пробирки на скошенную агаровую поверхность и после выращивания в термостате помещались в холодильник. Были идентифицированы следующие микромицеты: образец № 1 — Penicillium sp.; образец № 2 — Aspergillusniger, Penicilliumpalitans, Penicilliumsp.1, Aspergillussp.1, Aspergillussp.2; образец № 3 — не обнаружено; образец № 4 — Penicillium palitans [2].
Основные результаты работы:
был получен раствор яблочного пектина, который использовался для получения полисахаридных пленок;
на основе выделенного пектина и полифракционного хитозана из панциря ракообразных (изготовитель — ЗАО «Биопрогресс»), взятых в разных процентных соотношениях, были получены полисахаридные пленки;
выяснили, что образец пленки № 1 с процентным соотношением хитозана и пектина — 70:30 обладает наилучшими показателями;
на испытуемых образцах была доказана способность полисахаридных комплексов с препаратами йода задерживать рост микромицетов;
был определен видовой состав микроорганизмов, осуществляющих процесс биоразложения (Penicillium sp., Aspergillus niger, Penicillium palitans, Aspergillus sp.).
В перспективе работы состоит изучение антибактериальных свойств полученных образцов полисахаридных плёнок.
Литература:
- Бочков Д. Ф. Углеводы / Д. Ф.Бочков. — М.: Наука, 1980–176 с.
- Билай В. И., Элланская И. А. Микромицеты почв / В. И. Билай, И. А. Элланская. — Киев: Наук. думка, 1984. — 264 с.
- Кочеткова А. А. Некоторые аспекты применения пектина / А. А.Кочеткова // Пищевая промышленность, 1992. — № 7. — С.27–32.
- Каблов В. Ф., Агаянц, И. М. Получение полимолекулярных комплексов хитозана с биоразлагаемыми полимерами и исследование их свойств / В. Ф. Каблов, И. М. Агаянц // Вестник МИТХТ, 2006. — № 5. — С.17–23.
- Прозоркина Н. В., Рубашкина Л. А. Основы микробиологии, вирусологии и иммунологии / Н. В. Прозоркина, Л. А. Рубашкина. — Ростов-на-Дону: «Феникс», 2002. — 135 с.
- Скрябин Г. К. Хитин и хитозан: Получение, свойства и применение / Г. К. Скрябин. — М.: Наука, 2002. — 368 с.

