В статье представлен обзор литературы по вопросам метаболизма аминокислоты гомоцистеина, возникновения рисков развития ряда заболеваний в связи с избыточной кумуляцией гомоцистеина в организме человека, возможных способов коррекции гипергомоцистеинемии.
Ключевые слова: гомоцистеин, метаболизм гомоцистеина, гипергомоцистеинемия, гемокоагуляция, диметилизация ДНК, окислительный стресс, витамины группы В.
Известно, что современная наука заинтересована в поиске биохимических маркеров, которые могли бы отображать риски развития и характер течения различных заболеваний, а также прогнозировать их исход. В последние годы было обнаружено множество соединений, способных отражать и влиять на биохимический профиль организма. Продукт метаболизма метионина, гомоцистеин, является одним из них и привлекает к себе внимание множества исследователей различной специализации.
Гомоцистеин. Основные сведения.
Гомоцистеин (![]() ) — серосодержащее небелковое соединение, которое синтезируется в организме в процессе катаболизма метионина. Это соединение необходимо для организма, однако в избытке, оно может вызывать окислительный стресс, быть причиной генетических мутаций, индуцировать апоптоз клеток, способствовать развитию атеросклероза, причем независимо от наличия других атерогенных факторов [3, 6, 10, 11, 14].
) — серосодержащее небелковое соединение, которое синтезируется в организме в процессе катаболизма метионина. Это соединение необходимо для организма, однако в избытке, оно может вызывать окислительный стресс, быть причиной генетических мутаций, индуцировать апоптоз клеток, способствовать развитию атеросклероза, причем независимо от наличия других атерогенных факторов [3, 6, 10, 11, 14].
Путь синтеза и утилизации гомоцистеина
Гомоцистеин синтезируется из метионина в печени, при этом образуется SAM, который является донором метильной группы в реакциях трансметилирования. Оптимальная концентрация гомоцистеина в крови составляет 5–16 мкмоль/л и поддерживается на данном уровне двумя основными метаболическими путями: транссульфированием с образованием цистеина либо реметилизацией, т. е. превращением гомоцистеина в метионин под действием фермента метионинсинтазы [15].
Для протекания данных реакций необходимы витамины B6, B12 и фолиевая кислота (Рис. 1). Именно дефицит этих веществ может приводить к гипергомоцистеинемии. [13, 15]
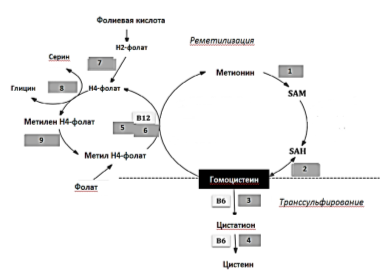
Рис. 1. Упрощенная схема метаболизма гомоцистеина: ферменты: 1 — метионинаденозилтрансфераза; 2 — s-аденил-L-гомоцистеин гидролаза; 3 — цистотион β-синтаза; 4 — цистотион γ-лиаза; 5 — редуктаза метионин синтазы; 6 — метионинсинтаза; 7 — дигидрофолат редуктаза; 8 — серингидроксиметилтрансфераза; 9 — метилен тетрагидрофолат редуктаза
Гипергомоцистеинемия
Гипергомоцистеинемия — состояние, характеризующееся повышенным уровнем гомоцистеина в крови.
Причины гипергомоцистеинемии:
наследственные ферментопатии;
недостаток в организме фолиевой кислоты и витаминов группы B;
полиморфизм генов;
курение и употребление алкоголя;
гормонозависимые заболевания;
чрезмерное употребление кофе;
нарушение функций почек;
малоподвижный образ жизни [3, 4, 6, 9, 15].
Гомоцистеин повышает риск развития тромбозов, вызывает метилизацию ДНК и окислительный стресс, оказывает повреждающее действие на нервные клетки и митохондрии (Рис. 2). [10, 12, 14]
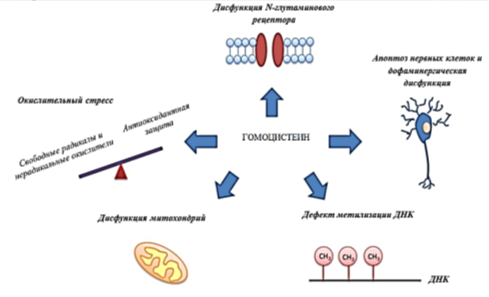
Рис. 2. Механизм действия гомоцистеина
По данным литературы, гипергомоцистеинемия способна вызывать резистентность V фактора к действию активированного протеина С за счет связывания V фактора с гомоцистеином. Гомоцистеин блокирует и взаимодействие тромбомодулина с тромбином, что препятствует активации протеина С. Наряду с этим, гомоцистеин нарушает связывание антитромбина III с гепарансульфатом, который находится на эндотелии сосудов, приводя к еще большему подавлению антикоагулянтной системы (Рис. 3) [3, 6, 7, 8, 11].
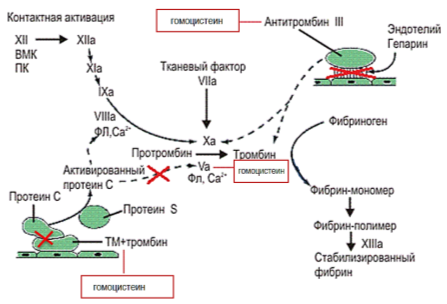
Рис. 3. Влияние гомоцистеина на процесс гемокоагуляции
В норме аннексин II стабилизирует рецептор плазминогена S100A10 и облегчает его перемещение на поверхность клетки, где рецептор связывается с плазминогеном и регулирует образование плазмина. Гомоцистеин, связываясь с одним из доменов аннексина II, блокирует активацию плазминогена, что способствует формированию прочных тромбов, устойчивых к лизису, а также увеличению риска возникновения тромбозов. [5]
Более того, согласно исследованиям McCullyKS, гомоцистеин повреждает эндотелий артерий, инициируя процесс активации цитокинов, циклинов и других медиаторов воспаления и клеточной пролиферации [9].
Под действием гомоцистеина образуются активные формы кислорода, которые оказывают окислительное действие на ЛПНП и липиды мембран клеток эндотелия, приводя к их разрушению. [2,6, 14, 16]
Повышение концентрации гомоцистеина может приводить к диметилизации гена CpG и таким образом подавлять активность метил-CpG-связывающего белка. В результате уменьшается активность гистон-дицитилазы и происходит ацетилирование гистонов H3, H4, что ведет к уменьшению экспрессии гена. Данные процессы происходят в отношении пассивного транскрипционного хроматина, изменение конформации которого может увеличивать связывание белками-репрессорами и подавлять транскрипцию. [10]
При пониженной концентрации глицина, гомоцистеин действует как его частичный антагонист за N-глутаматный рецептор, в результате чего наблюдается гипофункция глутаматергической трансмиссии, что приводит к депрессивным расстройствам (Рис. 4). [12]
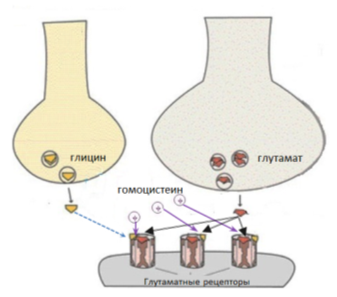
Рис. 4. Взаимодействие гомоцистеина с глутаматными рецепторами
Предотвращение повреждающего действия гомоцистеина
Особую роль в защите эндотелиальных клеток от повреждающего действия гомоцистеина играет параоксоназа. Этот фермент локализуется на ЛПВП и обладает лактоназной активностью, которая предотвращает окисление липопротеинов и осуществляет детоксификацию белков, подвергшихся реакции с гомоцистеином. Витамины группы В и фолиевая кислота, присутствующие в достаточном количестве в организме и поступающие с такими продуктами питания, как зелень, крупы, орехи, цельнозерновой хлеб, печень участвуют в обмене гомоцистеина, катализируя реакции превращения его в нетоксичные продукты, и таким образом предотвращают развитие гипергомоцистеинемии. [1, 9, 13, 15, 16]
Перспективы в исследованиях
Уже на данном этапе изучения влияние гомоцистеина на биохимические и патофизиологические процессы в организме человека является безусловным. Доказано, что гипергомоцистеинемия может указывать на нарушения течения многих метаболических путей и являться фактором риска возникновения таких заболеваний, как болезнь Альцгеймера, деменция, инфаркт миокарда, сердечная недостаточность, почечная недостаточность, атеросклероз и другие заболевания, связанные с повреждением сосудов и ишемией тканей. Однако механизм повреждающего действия этого соединения на митохондрии и на нервные клетки не достаточно изучен, что является актуальной темой для дальнейших исследований. [2, 3, 6, 11, 12, 13]
Литература:
- Андрианова М. Ю., Ройтман Е. В., Исаева А. М., Колесникова И. М., Нуреев М. В. Патогенетическое и клиническое обоснование комплексной профилактики гипергомоцистеинемии // Архивъ внутренней медицины. 2014. № 4. URL: http://cyberleninka.ru/article/n/patogeneticheskoe-i-klinicheskoe-obosnovanie-kompleksnoy-profilaktiki-gipergomotsisteinemii (дата обращения: 12.12.2015).
- Вильчук К. У. Роль гомоцистеина и окислительного стресса в патогенезе дисфункции эндотелия у детей с пиелонефритами // Проблемы здоровья и экологии. 2013. № 1 (35). URL: http://cyberleninka.ru/article/n/rol-gomotsisteina-i-okislitelnogo-stressa-v-patogeneze-disfunktsii-endoteliya-u-detey-s-pielonefritami (дата обращения: 12.12.2015).
- Грабан А. Ю., Рыглевич Д. Гипергомоцистеинемия — независимый фактор риска атеросклероза // Вестник ВГМУ. 2003. № 3. URL: http://cyberleninka.ru/article/n/gipergomotsisteinemiya-nezavisimyy-faktor-riska-ateroskleroza (дата обращения: 12.12.2015).
- Шевчук В. В., Малютина Н. Н. Ассоциация гипергомоцистеинемии с функциональным состоянием щитовидной железы у подростков в йоддифецитном регионе // Современные проблемы науки и образования. 2012. № 2. URL: http://cyberleninka.ru/article/n/assotsiatsiya-gomotsisteinemii-s-funktsionalnym-sostoyaniem-schitovidnoy-zhelezy-u-podrostkov-v-yoddefitsitnom-regione (дата обращения: 12.12.2015).
- Bharadwaj A., Bydoun M., Holloway R. and Waisman D. Annexin A2 Heterotetramer: Structure and Function // International Journal of Molecular Sciences. 2013, 14(3), 6259–6305. URL: http://www.mdpi.com/1422–0067/14/3/6259/htm (датаобращения: 02.12.2015)
- Ganguly P., Sreyoshi Fatima Alam. Role of homocysteine in the development of cardiovascular disease. Nutrition Journal 2015, 14:6 (датаобращения: 05.12.2015)
- Glueck, C.J. Myocardial infarction in a 35-year-oldman with homocysteinemia, high plasminogen activator inhibitor activity, and resistance to activated proteinC. /C. J. Glueck, R.N.Fontaine, A. Gupta, M. Alasmi// Metabolism. 1997. Vol. 46, № 12. P. 1470–1472. (датаобращения: 30.11.2015)
- Gugliucci A. Antithrombin activity is inhibited byacrolein and homocysteinethiolactone: Protection bycysteine // Life Sci. 2008. Vol. 82, № 7–8. P. 413–418. (датаобращения:09.12.2015)
- Eren E., Ellidag H. Y., Aydin O., Yilmaz N. Homocysteine, Paraoxonase-1 and Vascular Endothelial Dysfunction: Omnibus viis Romam Pervenitur // Journal of Clinical and Diagnostic Research. 2014 Sep, Vol-8(9): CE01-CE04. Р. 1–4. (датаобращения: 10.12.2015)
- Mandaviya Pooja R., Stolk L., Heil S. G.. Homocysteine and DNA methylation: A review of animal and human literature // Molecular Genetics and Metabolism 113 (2014) 243–252 (датаобращения: 15.12.2015)
- Monnerat, C.Homocysteine et maladie thrombo- embolique veineuse / C. Monnerat, D. Hayoz// Schweiz. Med. Wochenschr. 1997. Vol. 127, № 36. P.1489–1496. (датаобращения: 05.12.2015)
- Moustafa Ahmed A., Doaa H. Hewedi, Abeer M. Eissa, Dorota Frydecka and Błazej Misiak. Homocysteine levels in schizophrenia and affective disorders—focus on cognition // Frontiers in Behavioral Neuroscience. October 2014. Volume 8. Article 343. Р. 1–10. (датаобращения: 10.12.2015)
- Obersby D., Chappell D. C., Dunnett A., Tsiami A. A.. Plasma total homocysteine status of vegetarians compared with omnivores: a systematic review and meta-analysis // British Journal of Nutrition (2013), 109, 785–794. (датаобращения: 29.11.2015)
- Perla-Kajan J., Twardowski1 T., and Jakubowski H.. Mechanisms of homocysteine toxicity in humans // Amino Acids (2007) 32: 561–572 (датаобращения: 07.12.2015)
- Perła-Kajan J., Jakubowski H.. Paraoxonase 1 and homocysteine metabolism // Amino Acids (2012) 43:1405–1417 (датаобращения: 02.12.2015)
- Yilmaz N. Relationship between paraoxonase and homocysteine: crossroads of oxidative diseases // Arch Med Sci 1, February / 2012. Р. 138–153. (датаобращения: 01.12.2015)

