Сформированные в результате добычи и переработки медно-колчеданных руд техногенные воды по качественно-количественным показателям сопоставимы с забалансовыми рудами и образуют техногенное гидроминеральное сырьё. Вовлечение такого сырья в переработку связано с необходимостью совершенствования уже имеющихся и с разработкой новых инновационных комплексных технологий, обеспечивающих максимальное извлечение ценных компонентов и предотвращение сброса токсичных стоков в природные водоемы. Учитывая, что техногенные воды отличаются многокомпонентностью состава, различным фазовым состоянием и токсичностью соединений, соотношением и концентрацией загрязняющих примесей, понятно, что их качественная переработка может быть достигнута только с применением комплекса методов, включающих процессы флотации, сорбции, экстракции, коагуляции и флокуляции. Одним из наиболее перспективных для извлечения металлов из техногенных вод является метод ионной флотации.
Разработке физико-химических основ очистки промышленных сточных вод от истинно- и коллоидно-растворённых веществ и созданию новых реагентов для ионной флотации посвящены работы Л. Д. Скрылёва и его учеников. В работах [1, с. 24; 2, с. 386; 3, с. 458; 4, с. 14; 5, с. 2574] показана принципиальная возможность извлечения ионов тяжелых металлов (Pb, Hg, Cr, Ni, Cu, Zn и др.) из техногенных вод путем их осаждения ферроцианидом калия с последующей пенной сепарацией осадка желатином. Те же авторы предложили способ выделения Zn2+ из технологических растворов предварительным осаждением цинка в виде сульфида с последующей флотацией в присутствии хлористого лауриламмония. Кроме того, в работах Л. Д. Скрылёва, Т. Ф. Полтораниной, К. А. Разумова [6, с.78; 7, с. 11; 8, с. 14], Н. Н. Тетериной [9, с. 6], R. E. Baarson и C. L. Ray [10, с. 656] показано, что, используя в качестве собирателя натриевые и калиевые мыла синтетических жирных кислот фракции С10–26, методом ионной флотации можно извлекать Сu, Fе, Zn, Ni, Coидругие металлы. Так флотационная очистка растворов, содержащих от 80 до 380 мг/дм3 ионов Ni2+, с помощью лаурата калия снижает их концентрацию в среднем до 0,4 мг/дм3 [11, с. 79].
Т. Ф. Полторанина, К. А. Разумов разработали схему, включающую флотацию железа при рН 2,2–2,6 и последующую флотацию цветных металлов в коллективный концентрат при повышении рН до 8,5–9,0 с регенерирацией высокомолекулярных карбоновых кислот.
Е. Маhne и N. Pinfold [12, с. 140] продемонстрировали принципиальную возможность извлечения Сu, Fе, Zn, Рb, Mn, Ni, Co, Pd, V, Ce, Cr, Se из разбавленных (10–5-10–4 М)растворов методами флотации гидрофобных осадков. В качестве осадителей использовались диаминобензиин, гидроксихинолин, α-нитрозо-β-нафтол, купферрон, оксимы, в качестве собирателей — хлористый додецилпиридиний и Arquad 2HT (R(CH3)2NCl, где R — длинноцепочечный алкил).
В работах [8, с. 14; 9, с. 6] предложены схемы глубокой переработки технологических растворов, содержащих ионы тяжелых металлов Cu2+, Co2+, Ni2+, Zn2+, Fe3+, Cr+3, включающие стадию ионной флотации.
В работе Н. Н. Тетериной и С. М. Адеева исследованы флотационные свойства собирателя ЭМКО, представляющего собой смесь натриевых мыл карбоновых кислот с длиной радикала более С21 [9, с. 7]. Установлено, что при извлечении ионов Cu2+, Ni2+, Cr3+, Fe3+, после предварительного переведения их в нерастворимые гидроксиды, эффективнее применять ЭМКО совместно с пенообразователем НК-82. Степень извлечения металлов в пенную фракцию при оптимальных условиях процесса флотации составляет для Fe3+ — 99,5 %; Cu2+ — 93,3 %, Ni2+ — 97,9 %, Cr3+ — 100 %.
R.E Baarson. и C. L. Ray [10, с. 656; 13, с. 254] сообщают о возможности концентрирования и разделения металлов (Сu, Fе, Zn, Mg, Ni, Co, Cr) путем ионной флотации предварительно осажденных гидроксидов этих металлов. Установлено, что гидроксид меди (II) может быть сфлотирован как анионными, так и катионными собирателями. Наиболее эффективными оказались жирные кислоты, алифатические первичные амины и диамины, содержащие 12–14 атомов углерода в углеводородной цепи. Во всех случаях оптимальным для флотации гидроксида меди (II) является интервал рН 7 ÷ 8. Авторы подчеркивают, что селективное выделение металлов возможно путем ступенчатого повышения рН.
А. Рубин с сотрудниками [14, с. 298; 15, с. 357; 16, с. 1133] изучали раздельное извлечение СuиFе из растворов методами, сочетающими флотацию растворенных в растворе ионов и флотацию предварительно осажденных гидроксидов. Было установлено, что флотация гидроксидов имеет ряд преимуществ: меньший расход собирателя, высокую скорость процесса, низкую чувствительность к присутствующим электролитам и др.
Распространен метод удаления ионов тяжелых металлов из сточных вод сульфгидрильными собирателями, такими, как ксантогенаты, дитиофосфаты, тиокарбаматы, диалкилдитиофосфаты, первичные алифатические амины, алкиларилсульфокислоты, додецилбензосульфонат натрия [17, с. 975; 6, с. 78].
В Пражском институте исследования руд был разработан процесс флотации гидрофобных осадков, позволяющий концентрировать и разделять находящиеся в растворе металлы [18, с. 45]. В качестве собирателей использовали органические вещества, имеющие полярно-аполярную структуру молекул (алкилксантогенаты, алкил- и арилдитиокарбаматы, дитизон), осаждающие катионы большинства цветных и редких металлов в виде труднорастворимых соединений (ПР = 10–6÷10–40), обладающих высокой гидрофобностью.
T. Sasaki [19, с. 273] изучал возможность применения метилового и этилового ксантогенатов для извлечения Co и Ni из растворов выщелачивания пиритного огарка. После цементации железом, раствор, содержащий 0,25 г/дм3Co, 6,50 г/дм3Fе, 3,00 г/дм3Zn,
0,17 г/дм3Al и 0,22 г/дм3Mn, перемешивался с метиловым ксантогенатом при рН 4,5. Извлечение кобальта составило 90 %. Разделение Co и Ni осуществлялось при обработке концентрата раствором аммиака, который селективно растворяет ксантогенат никеля.
Д. Б. Холикулов, Н. М. Рахмонов, С. И. Кодиров и др. рекомендуют использовать в качестве собирателей катионов меди и молибдена амиловый, этиловый, изопропиловый ксантогенаты, диэтилдитиокарбомат натрия [20, с. 34; 21, с. 187]. Достоинством перечисленных собирателей является образование «сухого» сублата, сочетающееся с высоким извлечением Cu и Mo. Установлено, что извлечение Cu, Mo, Fe и Zn из раствора происходит в определённом интервале рН. При рН~5,0–5,5 флотируется Cu и Fe, при рН~3,0–3,5 — Mo.
В работе [22, с. 285] для флотации катионов рекомендуется применение собирателей анионного типа: например, R-COO-(карбоксилат), R-SO3- (сульфонат), R-OSO3- (сульфат), R-C6H5-SO3--(бензосульфат), R-OPO32- (фосфат), R-CHSO3COO- (сульфокарбоксилат), где R — углеводородный радикал CnH2n+1 (n=10–16).
В работе Н. Н. Воронина [23, с. 22] подробно изучены закономерности ионной флотации меди и цинка с помощью раствора нафтеновой кислоты в керосине.
Специалисты института технической химии Уральского отделения РАН (г. Пермь) занимаются разработкой комплексообразующих реагентов для ионной флотации Cu2+, Ni2+, Co2+иFe3+. Так,А. В. Радушев и Л. Г. Чеканова с сотрудниками [24, с. 75] установили возможность применения 1,2-диацилгидразинов (ДАГ) в качестве собирателей ионов Cu2+, Ni2+, Co2+и Fe3+. В работах Г. И. Зубаревой, С. М. Адеева, А. В. Радушева [25, с. 46; 26, с. 13] исследованы закономерности извлечения ионов тяжелых металлов из кислых сточных вод флотацией с применением в качестве собирателя гидразина октановой кислоты. А в работе [27, с. 51] рассмотрено использование ДАГ, 1,2-дибензоил- и 1-бензоил-2-ацетилгидразинов как реагентов-собирателей.
Наиболее перспективными для ионной флотации считаются хелатообразующие реагенты: они селективны, обеспечивают глубокую очистку растворов в одну ступень, при правильной дозировке не требуют дополнительной очистки. Известен способ извлечения металлов в виде хелатов с водорастворимым гидразидом полиакриловой кислоты.
Для извлечения из водных растворов ионов 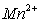 методом ионной флотации в качестве собирателя используется анионное ПАВ − сульфанол. При этом максимальные показатели извлечения ионов
методом ионной флотации в качестве собирателя используется анионное ПАВ − сульфанол. При этом максимальные показатели извлечения ионов 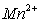 наблюдаются при рН > 2,0. Концентрирование
наблюдаются при рН > 2,0. Концентрирование 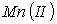 в пену происходит в виде соли состава
в пену происходит в виде соли состава 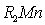 по реакции [28, с. 1428] (где
по реакции [28, с. 1428] (где 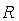 — анион
— анион 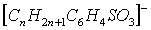 ):
): 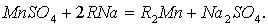
Ограниченность применения ионной флотации для извлечения ионов 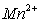 из техногенных растворов объясняется токсичностью флотореагентов. Кроме того, данный метод эффективен только для низкоконцентрированных растворов (
из техногенных растворов объясняется токсичностью флотореагентов. Кроме того, данный метод эффективен только для низкоконцентрированных растворов (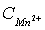 — до 5 мг/дм3).
— до 5 мг/дм3).
В работах Н. Л. Медяник, Х. Я. Гиревой, И. А. Варламовой, Н. Л. Калугиной для извлечения меди и цинка из техногенных вод рекомендуется комплексный флотореагент, в состав которого входят моно- и диэтиленгликольтерефталат, терефталевая кислота [29, с. 87]. Кроме того, в работах данных авторов рассмотрена возможность селективного извлечения металлов из сточных вод методом известкования [30, с. 191].
На основе вышесказанного можно сделать следующие выводы: 1) Ионная флотация является технологичным процессом переработки гидроминеральных месторождений. 2) В настоящее время развитие метода ионной флотации для извлечения тяжелых металлов из техногенных вод горных предприятий тормозится тем, что ассортимент реагентов ограничен солями высших жирных кислот, сульфгидрильными и азотсодержащими соединениями, которые, являются дорогостоящими веществами с низкими значениями ПДК. Методы регенерации этих реагентов практически не разработаны. 3) Процесс ионной флотации может быть применен для разделения металлов. 4) Флотация хорошо сочетается с другими способами извлечения тяжелых металлов.
Литература:
1. Скрылев Л. Д., Cазонова В. Ф. О расчете оптимальных значений рН для ионной флотации поливалентных металлов // Изв. Вузов. Цв. металлургия. 1980. № 3. С. 24–27.
2. Скрылев Л. Д., Cазонова В. Ф., Скрылева Т. Л. Влияние растворимости сублата на эффективность флотационного выделения ионов тяжелых металлов, собранных с помощью жирнокислотных собирателей // Химия и технология воды. 1992. Т. 14. № 5. С. 386–389.
3. Скрылев Л. Д., Аманов К. Б. Некоторые закономерности флотационного выделения ионов тяжелых металлов с помощью лаурата калия // Коллоидн. журн. 1972. Т. 34. № 3. С. 458–461.
4. Скрылев Л. Д., Лопатенко Л. М., Синькова Л. А. Калиевые соли жирных кислот как флотационные собиратели ионов свинца // Химия и технология воды. 1985. Т. 7. № 3. С. 14–18.
5. Скрылев Л. Д., Невинский A. F., Пурин А. Н. О влиянии электролитов на кинетику флотационного выделения веществ коллоидной и полуколлоидной степени дисперсности // Журн. прикл. химии. 1985. Т. 58. № 11. С. 2574–2578.
6. Полторанина Т. Ф. Выделение тяжелых цветных металлов из разбавленных растворов ионной флотацией // Записки ЛГИ. Т. 42. Вып. 3. 1963. С. 78–84.
7. Полторанина Т. Ф., Иллювиева Г. В., Разумов К. А. Выделение металлов из разбавленных растворов методом ионной флотации // Обогащение руд. 1964. № 3. С. 11–18.
8. Разумов К. А., Иллювиева Г. В., Полторанина Т. Ф. Селективная флотация железа из растворов // Обогащение руд. 1965. № 6. С. 14–18.
9. Способ очистки сточных вод от ионов тяжелых металлов / Тетерина Н. Н.,
10. Адеев С. М., Зубарева Г. И., Радушев А. В. // Изв. вузов. Цв. металлургия. 1997. № 3. С. 6–10.
11. Baarson R. E., Ray C. L. Precipitate flotation, a new metal extraction and concentration technique // Hydrometallurgy. N. Y.-London: Cordon and Breach Sci. Publ, 1964. P. 656–677.
12. Ласкорин Б. Н., Гольман A. M., Гвоздева Н. Е. Извлечение молибдена, меди и цинка из промышленных растворов методом ионной флотации и флотации осадков // Физ.-технологич. горные проблемы. 1972. С. 79–85.
13. Mahne E. J., Pinfold N. A. Precipitate flotation. II. Separation of palladium from platinum, gold, silver, iron, cobalt and nickel // J. Appl. Chem. 1968. V. 18. № 5. Р. 140–142.
14. Баарсон P. E. Осадительная флотация — новый метод извлечения и концентрирования металлов. // Гидрометаллургия. М.: Металлургия, 1971. 332 с.
15. Rubin A. I., Johnson J. D. Effect of pH on ion and precipitate flotation systems // Analyt. Chem. 1967. V. 39. № 3. Р. 298–302.
16. Rubin A. J., Lapp W. L. Foam fractionation and precipitate flotation of zinc (II) // Separ. Sci. 1971. V. 6. № 3. P. 357–363.
17. Rubin A. J., Lapp W. L. Foam separation of lead (II) with laurylsulfate // Analyt. Chem., 1969. V. 41. № 8. P. 1133–1135.
18. Walkowiak W., Bhattacharyya D., Grieves R. B. Selektive foam fractionation of chloride complexes of zinc (II), cadmium (II), mercury (II), qold (III) // Anal. Chem. 1976. V. 48. Р. 975–979.
19. Cap M., Mazacek I. Pouziti flotace hydrofobnich srazeni kovu v hydrometalurgii // Rudy. 1960. R. 8. № 2. Р. 45–49.
20. Sasaki T. Separation of particles, molecules and ions by foaming. Studies in Japan // Absorptive bubble separation techniques. N. Y.-London: Acad. Press, 1972. Р. 273–278.
21. Исследование гидродинамических характеристик колонной флотомашины / Стрижко В. С., Шехерев Д. В., Абрютин Д. В., Бернацкая А. В. // Изв. вузов. Цв. металлургия 2000. № 1. С. 34–35.
22. Холикулов Д. Б., Рахмонов Н. М., Кодиров С. И. Возможности применения ионной флотации для извлечения металлов из различных растворов // Научные основы и практика переработки руд и техногенного сырья: Матер. междунар. научн.-техн. конф. Екатеринбург: Форт-Диалог-Исеть, 2007. С. 187–193.
23. Сазонова В. Ф. Физико-химические основы процесса флотационного выделения и разделения ионов тяжёлых металлов: дис. … докт. хим. наук. Одесса, 1995. 469 с.
25. Радушев А. В., Чеканова Л. Г., Гусев В. Ю. Гидразиды и 1,2-диацилгидразиды. Получение, свойства и применение в процессах концентрирования металлов. Екатеринбург: Уральский центр академического обслуживания, 2010. 140 с.
26. Зубарева Г. И. Выбор высокоэффективных собирателей различных классов для флотационного извлечения ионов металлов из промышленных сточных вод // Хим. промышленность. 2001. № 10. С. 46–48.
27. Зубарева Г. И. Технологические схемы глубокой очистки гальваностоков от ионов тяжелых металлов с применением высокоэффективных собирателей // Хим. промышленность. 2002. № 8. C. 13–16.
28. Чеканова Л. Г. Равновесия в растворах при комплексообразовании симметричных 1,2-диацилгидразинов с ионами меди (II) и некоторых d-элементов: дис. … канд. хим. наук. Пермь: ИТХ УрО РАН, 2002. 143 с.
29. Панов В. А. Особенности процесса очистки воды методом электрофлотации // Электрохимия. 1974. Т. 10. № 9. С. 1427–1431.
30. Прогнозирование флотационной активности реагентов для извлечения цинка и меди (II) по квантово-химическим дескрипторам / Медяник Н. Л., Варламова И. А., Калугина Н. Л., Строкань А. М. // Известия высших учебных заведений. Горный журнал. 2011. № 3. С. 83–89.
31. Медяник Н. Л., Калугина Н. Л., Варламова И. А. Изучение возможности селективного извлечения меди методом известкования из сточных вод горных предприятий гидрометаллургического комплекса // Вестник Иркутского государственного технического университета. 2010. Т. 42. № 2. С. 188–193.







