In a review article analyzes studies on the concentration of heavy metals and radionuclides using biosorptional potential of different types of microorganisms, and assessed the possibility of their use in the remediation of waste and surface water.
Keywords: heavy metals, bosorption, biomass, microorganisms, waste and surface water, remediation.
Издавна было отмечено, что многие микроорганизмы различных таксономических групп, такие как водоросли, бактерии, грибы, мхи, дрожжи, способны накапливать тяжелые металлы, радионуклиды и прочие экотоксиканты из объектов окружающей среды [1–3] При этом фактор концентрирования экотоксикантов по отношению к среде, из которой они извлекались, может составлять многие сотни и тысячи раз [4–6]. Естественно, что такое явление не могло остаться незамеченным микробиологами, химиками, биотехнологами, экологами. Однако систематизированные исследования по изучению сорбционных свойств микроорганизмов началось только несколько десятилетий назад. Эти исследования были посвящены, в первую очередь, изучению резистентности микроорганизмов к тяжелым металлам и токсинам органических соединений, генно-инженерных решений по модификации микроорганизмов, толерантных к загрязнениям их среды обитания, понятию механизмов взаимодействия тяжелых металлов с клеточными структурами микроорганизмов.
Самые ранние работы по применению микроорганизмов в качестве сорбентов тяжелых металлов из сточных и природных вод были сделаны Ульрихом и Смитом (Ullrich A.H & Smith M. W.) в 1951 году [7]. Аналогичные решения по применению микроорганизмов по очистке стоков химических производств отмечены в работе [8]. Пожалуй, первым патентом по техническому решению биологической очистки сточных вод был зарегистрирован Ames Crosta Mills& Company Ltd. в 1973 году [9], с которого и началось коммерческое освоение биотехнологической ремедиации сточных промышленных вод.
Однако совершенно новое звучание вопроса о возможности применения микроорганизмов в сорбционных процессах и систематизации исследований отмечено в работах Б. Волеского (Volesky B.), М. Тезоса (Tsezos M.), З. Холана (Holan Z.) [10–12], которых, по праву, можно считать пионерами в этой области научных исследований.
Анализ литературы по исследованиям применения микроорганизмов для извлечения тяжелых металлов, радионуклидов и токсинов из технологических объектов и природных поверхностных вод показывает, что информация носит лавинообразный характер и, по всей видимости, будет только увеличиваться [13].
На рис. 1 представлена диаграмма роста количества публикаций за последние десятилетия.
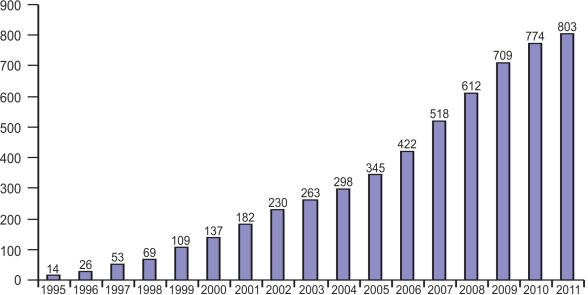
Рис. 1. Диаграмма роста публикаций по биосорбции тяжелых металлов микроорганизмами
К этим публикациям, следует добавить несколько десятков обзоров, монографий, книг, учебно-методических пособий, в которых рассматриваются вопросы биоаккумуляции и биосорбции различных экотоксикантов, их механизмы взаимодействия, равновесное и кинетическое моделирование процессов [10,11,14].
Четко прослеживается перемещение центра исследований с Американского континента (Канада, Бразилия, Аргентина) в центр Европы (Чехия, Румыния, Испания) и Турцию, а затем в Африку (ЮАР, Нигерия) и южно-восточный регион — Индию, Южную Корею, Китай. Это можно объяснить поиском эффективной утилизации биомассы пищевых и производственных отходов с одной стороны, а с другой — привлекательностью создания альтернативы дорогостоящим синтетическим ионообменным смолам и активированному углю. Этому также способствует интеграция научных связей и коммерциализация биосорбционных процессов, одними из инициаторов которой были Б. Волеский и Д. Кратчовил (Volesky B. & Kratchovil D.) [15,16].
Однако следует отметить, что при явно стимулирующем эффекте роста публикаций для продолжения исследований в этой области, многие из них, даже в известных рецензируемых журналах, являются простым дублированием своих или повторением работ других исследователей, с нередко противоречивыми полученными результатами (особенно по сорбционной емкости, сорбционным, кинетическим и термодинамическим параметрам). До настоящего времени остается крайне малым число публикаций, в которых проводится сравнение характеристик сорбционно-аналитических свойств различных микроорганизмов. Мало информации о синергетическом или ингибиторном действии на сорбционные процессы ионов металлов в многокомпонентных растворах с различной ионной силой, об эффективных способах иммобилизации микроорганизмов для реализации проточных биосорбционных процессов, о селективности и о способах ее повышения при концентрировании тяжелых металлов и другое. Это свидетельствует о необходимости создания алгоритма исследований в области изучения биосорбционных процессов с использованием, как живых, так и мертвых микроорганизмов.
Цель настоящего обзора состоит в обобщении и анализе найденного в открытом доступе материала по изучению концентрирования тяжелых металлов и радионуклидов различными типами биомассы, что позволит оценить коммерческий потенциал биосорбционных технологий в ремедиации сточных и поверхностных вод.
1.1.Типы биомассы и биоматериалы
Прежде всего, необходимо указать, что в биосорбционных технологиях может применяться биомасса, содержащая как живые, так и мертвые микроорганизмы. При этом экотоксиканты могут быть удалены из внешней среды как в первом, так и во втором случаях [17]. Разница в механизмах биоконцентрирования заключается в том, что при использовании живых микроорганизмов может осуществляться активная и пассивная сорбция, т. е. аккумуляция и биосорбция. Аккумуляция более сложный механизм, так как в этом случае задействованы метаболические процессы, поддерживающие жизнеобеспечение микроорганизма. Кроме аккумуляции может проходить также и биосорбция, механизм которой также довольно сложен, и обусловлен наличием во внешней оболочке микроорганизма специфических функциональных групп. Во втором случае — для мертвых микроорганизмов — осуществляется только биосорбция [18].
Использование живых микроорганизмов более трудоемкий процесс, так как должно предусматривать систему их жизнеобеспечения и размножения.
Десорбция тяжелых и драгоценных металлов из живых микроорганизмов также имеет ряд ограничений, так в этом случае трудно сохранить условия их жизнеобеспечения. Поэтому применение неживых микроорганизмов в технологических процессах более рентабельно и менее затратно [19–21]. Однако, в литературе описаны достаточно примечательные факты использования именно живых микроорганизмов для извлечения из сточных вод токсичных металлов и радионуклидов [22–26].
Останавливаясь на использовании неживых микроорганизмов в биосорбции тяжелых металлов, можно отметить, что для работы следует выбирать доступные и недорогие биоматериалы, с которыми можно провести несложную предобработку без внесения дополнительных загрязнений обрабатывающими реактивами [27,28]. Таким образом, при выборе биомассы главенствующим фактором должны быть их доступность и дешевизна. Исходная биомасса может быть получена из промышленных отходов, например, биотехнологических производств, из природной среды, или легко выращенная в определенных условиях [29–32]. Имеется достаточно большое количество научных обзоров по использованию различных типов биомассы [33–39]. Описываются случаи, когда извлечение тяжелых или драгоценных металлов достигает 50 % от сухого веса биосорбента [40].
Биоматериал для получения на его основе биосорбентов тяжелых металлов можно подразделить на следующие категории: морские водоросли, бактерии, грибы, дрожжи, сельскохозяйственные отходы.
1.2. Морские водоросли как биосорбент
Использование биомассы водорослей в качестве биосорбента показано в работах [32,41,42]. В этих исследованиях приводятся доводы в пользу водорослей ввиду их неприхотливости в питании и размножении. Большие количества биоматериала водорослей позволяет их широко использовать в технологических процессах для регионов их произрастания, в первую очередь стран морских и океанических побережий.
Извлечение ионов свинца сухой биомассой зеленых водорослей Chlorella vulgaris в диапазоне его концентраций 25–200 мг/л описывается в работе [43]. Изучены влияние рН, температуры и начальной концентрации ионов свинца на сорбционный процесс, описываемый уравнением изотермы Фрейндлиха. Голан и Волеский (Holan Z. & Volesky B.) [32] исследовали биосорбцию ионов тяжелых металлов морскими водорослями в мультиметаллической системе Ni — Pb. Подобные исследования были проведены в [44] с бурыми морскими водорослями Ascophyllum nodosum. Используя бинарную систему Cu-Zn, Cu-Cd, Zn-Cd этими исследователями было показано, что каждый металл ингибирует сорбцию другого. В работах [45–47] было установлено, что бурые водоросли Sargassum sp. обладают способностью извлекать из водных растворов ионы меди (1,08 ммоль/г), Cr (1,3 ммоль/г), а Eclonia — Ni (II) [48]. Киран (Kiran B.) и др. [49] сделали сообщение, что извлечение Cr(VI) из водных растворов водорослями Lyngbya putealis (HH-15) наблюдалось в диапазоне рН 2,0–10,0. Максимум биосорбции наблюдался при рН=3 при начальной концентрации хромат-иона 50 мг/л и достигал 94,8 %, а в присутствии 0,2 % посторонних солей снизился до 90,1 %. Наиболее представительные обзоры по применению различных типов водорослей в качестве биосорбентов тяжелых металлов приведены в [34,39].
Исследователи отмечают, что из трех групп морских водорослей — красные, зеленые и бурые, последние получили большее внимание ввиду их лучшей сорбционной способности по сравнению с другими.
1.3. Бактерии как биосорбент.
Бактерии относятся к самой многочисленной и универсальной группе микроорганизмов и по своей совокупной массе превышают 1015 кг [50].
Многочисленными исследованиями было показано, что некоторые из них способны накапливать тяжелые металлы, такие как свинец и кадмий в количествах в 1,7·105 и 1·105 раз, соответственно, по сравнению с концентрациями этих металлов в среде обитания. Так, Bacillus sp. может показать наличие большого биосорбционного потенциала, позволяющего ее применение в коммерческой биотехнологии [51]. Кроме того, есть сообщения об относительно высокой биосорбционной способности тяжелых металлов Pseudomonas sp., Zoogloea ramigera и Streptomyces sp. [52–56]. Подобные исследования были выполнены и другими авторами [57,58]. Биосорбционные исследования по отношению ионов свинца и кадмия проводились с использованием несульфутирующих бактерий, роль которых в биоремедиации сточных вод известна давно [22,23].
В работе [57] сообщается о применении Rhodobacter sphaeroides и водородредуцирующих бактерий Alcaligenes eutrophus H16. в биосорбционном концентрировании тяжелых металлов. Так, Илхан (Ilhan S.) [58] сообщил, о биосорбции хрома, свинца, и меди из сточных промышленных вод Staphylococcus saprophyticus: Эти ионы были удалены из растворов при рН 2,0;4,5; 3,5 — соответственно.
Биосорбционные свойства бактериальной биомассы и влияние на нее рН, начальной концентрации ионов тяжелых металлов, время контакта биомассы с адсорбтивом, содержащим хром, свинец и медь, исследовались Оздемиром (Ozdemir G.) и др. [59]. Этими исследователями было показано, что Грам-отрицательные бактерии Pantoea ТЕМ 18 способны показать высокие значения биосорбции ионов меди в растворах, загрязненных нефтепродуктами. Известно, что стенки Грам-отрицательных бактерий более тонкие, чем у Грам-позитивных бактерий. Но и те, и другие имеют мембрану, внешняя стенка которой содержит липополисахариды со специфическими функциональными группами, ответственными за осуществление биосорбции [60,61].
Исследователями из Ирана был констатирован факт поглощения Cr(III) Грам-позитивными бактериями типа NRC-BT-2 [62]. Были проведены исследования сравнительной сорбции ионов Cr(III) и Cr(VI) на поверхности Pseudomonas aeruginosa [63].
В течение последних 10–15 лет исследователями был накоплен большой практический материал по применению бактериальной биомассы для извлечения из водной среды тяжелых металлов и радионуклидов. Было установлено, что бактерии Bacillus firmus способны сорбировать свинец, цинк и медь из растворов их солей в количествах 467 мг/г,418 мг/г и 381 мг/г соответственно [64]. Не менее впечатляющие биосорбционные возможности проявляют бактерии Corynebacterium glutamicum, способные сорбировать 567,7 мг/г ионов свинца [65]. Бактерии разновидностей Pseudomonas проявляют в большинстве своем превосходные сорбционные свойства по отношению ионов свинца (270,4 мг/г) и меди (96,9 мг/г) [66]. Однако, уже в работе [67] эти же микроорганизмы показали весьма посредственные сорбционные способности — для Pb 56,2 мг/г; Zn — 6,9 мг/г; Cu — 6,6 мг/г; Cd — 8,0 мг/г. Аналогичная картина может наблюдаться при анализе результатов исследований по сорбционной способности бактериальной биомассы по отношению к другим ионам тяжелых металлов и радионуклидов. При этом авторы, показывающие более высокие значения биосорбции при использовании одной и той же разновидности бактерий, например, для ионов свинца или хрома, как правило, показывают и большие значения максимальной емкости биосорбента и для других ионов [68,69]. Объяснение этому, мы находим не только в возможной адаптации бактерий к иону-загрязнителю, но и в различии подходов к стандартизации измерений и определения сухой массы биосорбента. Такая картина наблюдалась нами и при анализе результатов исследований биосорбционных возможностей и для других микроорганизмов.
Таким образом, обнаруженные нами противоречивые факты, касающиеся количественных значений максимальной сорбционной способности бактериальной биомассы, не могут повлиять на признание ее как потенциального биоматериала для решения инженерно-экологических и химико-аналитических задач, учитывая при этом все-таки хорошие биосорбционные способности по отношению к драгоценным металлам (Pd, Pt, Au) [70] и радионуклидам (U, Th) [71].
1.3. Фунги как биосорбент
Грибы это одно- или многоклеточные бесхлорофилловые эукариоты, насчитвающие от 89000 до 100000 видов. [72]. Это гетеротрофные формы, использующие энергию, образующуюся при расщеплении органических соединений. Как и у животных, у гетеротрофных грибов и миксомицетов запасающим веществом является полисахарид гликоген.
Грибы широко распространены и обитают почти во всех климатических районах. Их можно обнаружить в почве, пресной и соленой воде. Благодаря огромному разнообразию и исключительной способности к выживанию в разных климатических условиях грибы распространены повсеместно. Они сохраняют жизнеспособность даже при низкой температуре.
По морфологическим признакам все грибы делятся на грибы дрожжевые и грибы мицелиальные. Сюда относят такие разнообразные формы, как хлебная плесень, плесневый грибок пенициллум, шляпочные съедобные грибы, трутовики. У дрожжевых грибов колонии гладкие, у мицелиальных — пушистые. К дрожжевым грибам, в частности, относятся Candida spp. и Cryptococcus spp.; к мицелиальным — Penicillium spp., Aspergillus spp., Rhizopus spp. и дерматофиты [73].
Пенициллы по праву занимают первое место по распространению. Естественный резервуар их — почва, причем они, будучи в большинстве видов космополитами, в отличие от аспергиллов, приурочены больше к почвам северных широт.
Пенициллы были обнаружены одновременно с аспергиллами благодаря их в общем сходной экологии, широкому распространению и морфологическому сходству.
Мицелий пенициллов в общих чертах не отличается от мицелия аспергиллов. Он бесцветный, многоклетный, ветвящийся. Основное различие между этими двумя близкими родами заключается в строении конидиального аппарата. У пенициллов он более разнообразен и представляет собой в верхней части кисточку различной степени сложности (отсюда его синоним «кистевик»). На основе строения кисточки и некоторых других признаков (морфологических и культуральных) в пределах рода установлены секции, подсекции и серии.
Ввиду их большой распространенности и разнообразия нельзя оставить без комментариев возможности их использования в качестве биоматериала для сорбентов тяжелых металлов и радионуклидов. К преимуществам использования грибной биомассы относится высокий процент биополимеров клеточной стенки, проявляющей в большинстве случаев превосходные биосорбционные характеристики [74]. Кроме того, большое количество грибковой биомассы может быть получено из мицелия в фармацевтическом производстве антибиотиков или пищевой промышленности, например при производстве лимонной кислоты, ферментов, полисахаридов. При этом, как правило, решается сразу несколько проблем: утилизация отходов производства и создание эффективного биосорбента для удаления экотоксикантов из окружающей среды.
Так, Гадд и Де Ром (Gad G. M. & De Romе L.) сообщили о биосорбции ионов меди девятью разновидностями грибов и показали, что присутствие тяжелых металлов затрагивает метаболические процессы грибковых культур [75].
В работе [76] описывается извлечение кадмия в проточном реакторе. Выращенная в лабораторных условиях биомасса, которая загружалась в реактор, была собрана и сохранена в высушенном состоянии. При этом как свежая, так и высушенная грибная биомасса обладала именно биосорбционными свойствами, а не простым осаждением по отношению к ионам меди, свинца, цинка и кобальта.
Особо следует остановиться на так называемых волокнистых грибах: Penicillium sp., Aspergillus sp., Mucor sp., Rhizopus sp. способных эффективно удалять ионы тяжелых металлов и радионуклиды
В работах [28,29] были исследованы биосорбции ионов свинца, меди, кадмия грибом Aspergillus niger. В этих же работах были приведены результаты исследований по химической модификации функциональных групп природных биополимеров, с целью изучения их роли в биосорбции тяжелых металлов. Гриб Aspergillus niger показал хорошие биосорбционные характеристики по отношению к Cu+2, Zn+2 и Ni+2 в однокомпонентных растворах, в то время как это наблюдалось только для меди и цинка в мульткомпонентных растворах [77].
Отработанная грибковая биомасса, содержащая мертвые клетки Aspergillus niger, также показала хорошие сорбционные свойства по отношению к токсичным металлам. Адсорбционная способность этой биомассы убывала в ряду Cd>Cr(III)>Ni>Fe>Cr(VI) [78].
Широкая распространенность Aspergillus niger стимулирует интерес к их сорбционной способности многих исследователей. Так, в работах [79–82] на протяжении нескольких лет исследовалась максимальная сорбционная способность Aspergillus niger по отношению к ионам меди и свинца для биомассы в процессе роста, так и обработанной раствором едкого натра. Полученные результаты показали более высокие значения сорбционной емкостью для указанных ионов металлов при проведении биосорбции биомассой, обработанной раствором щелочи: для Cu 25,5–28,7 мг/г и для Pb 28,9–32,6 мг/г. При этом результаты, полученные в различное время, были сопоставимыми, что свидетельствует о положительном (стабилизирующем эффекте) обработки биомассы фунги щелочами. Биомасса Aspergillus niger была применена с переменным успехом для биосорбции ионов Zn(II), Ni(II), Cd(II), Fe(III), Cr(VI), а также радионуклидов и ряда трансурановых элементов [83–87].
Гомес (Gomes N.S) с сотрудниками показал возможность применения биомассы Aspergillus niger при цианидном выщелачивании золота, серебра, меди, цинка, железа [88,89]. Янг (Yang Y. Y.) [90] приводит примеры селективного концентрирования 241Am в диапазоне концентрации 7,2–142,4 MBq/г спорами Aspergillus niger, а в работе [91] сообщается об извлечении из водных растворов ионов ртути (Hg2+) и метил ртути (CH3Hg+).
Грибы Penicillium также могут являться хорошими биосорбентами и эффективно удалять из растворов такие ионы, как медь, золото, цинк, кадмий, марганец, уран.
Penicillium italicum [92], Penicillium spinulosum, Penicillium oxalicum [93] Penicillium austurianum [94], Penicillium verrucosum [95], Penicillium purpurogenum [96], Penicillium canescens [97], Penicillium griseofulvum [98] P. Austurianum [99], Penicillium chrysogenum были применены различными исследователями для изучения биосорбции тяжелых металлов.
Так, P. chrysogenum способен извлекать золото из цианидных растворов. Однако, такие признанные авторитеты, как Волеский (Volesky B.) и Виерра (Vieira R. H. S.F.) [4,5], не отмечали этого. В работе [100] сообщается об успешной биосорбции P. spinulosum ионов меди, золота, цинка, кадмия марганца. Наиболее полно была изучена биосорбция Penicillium sp., P. chrysogenum., относящихся к малоизвестным гипомицетам. P. chrysogenum показали преимущественную сорбцию в ряду: Pb2+>Cu2+>Zn2+>Cd2+>Ni2+>Co2+ [101]. Приблизительно такую же биосорбционную способность показали и мертвые клетки P. chrysogenum: Pb2+>Cd2+>Cu2+>Zn2+>As3+. P. canescens показал тот же сорбционный ряд при неконкурентной сорбции при проведении эксперимента с одним ионом металла. При этом были найдены следующие сорбционные емкости: 26,4 мг/г для As(III), 54,8 мг/г для Hg(II), 102,7 мг/г для Cd (II) и 213,2 мг/г для Pb(II). Однако конкурентная адсорбция составляла всего 2,0 мг/г для As(III), 5,8 мг/г для Hg(II), 11,7 мг/г для Cd(II) и 32,1 мг/г для Pb(II) при начальной концентрации ионов металла 50 мг/л.
Таким образом, разновидность грибов Penicillium может показаться хорошей только для урана и свинца [102–104]. Однако, грибы Rhizopus и Pencillium уже считаются хорошо изученными как потенциальная биомасса для удаления других тяжелых металлов из водных растворов [105]. Более того, большинство исследователей показывают, что грибы рода Penicillium способны показать лучшие биосорбционные свойства по сравнению с Aspergillus niger. Из разновидностей Pencillium наиболее высокие значения сорбционной емкости (qмакс.) для Pb(II) и Cd(II) показали Penicillium canescens: 213,2 и 102,7 мг/г сухой биомассы, соответственно [106]; Penicillium simplicissimum для Pb(II) и Cd (II) — 298,01 мг/г и 207,68 мг/г [107]; Penicillium chrysogenum и Penicillium sp. по отношению к урану и продуктам его распада U — 70 мг/г и 165мг/г; Th — 142 мг/г, Sr — 75 мг/г, Nd — 178 мг/г [100,105].
Следует обратить внимание, что наиболее высокие сорбционные характеристики были получены для живых микроорганизмов. Нерастущая или растущая, в средней фазе роста, Penicillium показывали существенно меньшие биосорбционные способности. Предобработка грибковой биомассы щелочами также не дала существенного эффекта [106]. В то же время проведение амино-модификации мицелия Penicillium chrysogenum привело к улучшению биосорбционных свойств, показав при этом qмакс. для следующих ионов: Cd — 210,2 мг/г; Cu — 108,3 мг/г; Pb — 204 мг/г; Ni — 260 мг/г [107–109]. Приведенный пример наглядно иллюстрирует возможность улучшения биосорбционных возможностей микроорганизмов правильным выбором способа модификации.
Резюмируя информацию о сорбционно-аналитических свойствах биомассы фунги следует сослаться на работы [105, 110], в которых рекомедуется определенный вид биомассы для наиболее эффективного извлечения ионов тяжелых металлов. Эти рекомендации приведены ниже в таблице 1.
Таблица 1
Биосорбция грибковой биомассой (мг/г)
|
Вид фунги |
Металл |
Литература |
|
Aspergillusniger, Mucorrouxii, Rhizopusarrhizus(живые клетки) |
Au |
[151] |
|
Penicillium spp. (живые клетки) |
Ag, Cu, Cd, Pb |
[151] |
|
Penicillium, Aspergillus, Trichoderma, Rhizopus, Mucor, Saccharomyces, Fusarium (живыеклетки) |
Pb, Cu, Cd,Zn |
[151] |
|
Aspergillus, Penicillium, Rhizopus, Saccharomyces, Trichoderma, Mucor, Rhizopus(живые клетки) |
Th, U, Sr, Cs,La |
[151] |
|
Phanerochaete chryosporium (живые клетки) |
Cd, Pb, Cu |
[159] |
1.4. Дрожжи как биосорбент
Дрожжи — одноклеточные микроорганизмы, морфология которых близка к грибам [111]. Присутствие тяжелых металлов отражается на метаболизме культуры дрожжей. Эти исследования в течении прошлого десятилетия рассматривали пекарские или пивоваренные дрожжи Saccharomyces cerevisiae как потенциальный биосорбент тяжелых металлов и долгоживущих радионуклидов. Внимание к пивоваренным дрожжам, несмотря на их посредственный сорбционный потенциал по отношению к тяжелым металлам, обусловлено, в первую очередь, их широкой доступностью и уникальности природы как живых, так и мертвых дрожжевых клеток [112], а также их мутантных типов [113], как культивируемых лабораторными методами, так и получаемых в результате отхода бродильных производств [114].
Биомасса дрожжей успешно использовалась как биосорбент для извлечения Ag, Au, Cd, Co, Cr, Cu, Ni, Pb, U, Th, Zn из водных растворов. Дрожжи родов Saccharomyces, Candida, Pichia оказались довольно эффективными биосорбентами тяжелых металлов в широком диапазоне концентраций указанных металлов в монокомпонентных растворах [115].
Многими исследованиями, особенно в последние годы, было показано, что именно применение Saccharomyces cerevisiae экономически целесообразно при создании на их основе биосорбентов [116].
В таблице 2 приведены литературные источники и результаты исследований биосорбционного потенциала дрожжей Saccharomyces cerevisiae.
Таблица 2
Биосорбция тяжелых металлов дрожжами Saccharomyces cerevisiae
|
Ион металла |
Форма биосорбента |
Qmax, мг/г |
Авторы |
Литература |
|
Pb |
Нативные живые клетки |
79,2 |
Al-Saraj et al. (1999) |
[117] |
|
Pb |
Иммоблизованные клетки в золь-гель матрице |
41,9 |
Al-Saraj et al. (1999) |
[117] |
|
Pb |
Получен после дистилляции виски, отмытый и лиофилизирован |
18,9 |
Bustard and McHale (1998) |
[118] |
|
Pb |
Культивированные в лабораторных условиях дрожжи, высушены при 1000 С |
270,3 |
Ozer and Ozer (2003) |
[119] |
|
Pb |
Пекарские дрожжи, обработанные этанолом |
17,5 |
Goksungur et al. (2005) |
[120] |
|
Pb |
Клеточные стенки дрожжей после отмывки, автоклавирования и высушивания при 650 С |
125,0 |
Аронбаев С. и др. (2011) |
[121] |
|
Cu |
Выращены в среде, содержащей ионы меди |
2,01–9,05 |
Donmez and Aksu, (1999) |
[122] |
|
Cu |
Избыточные дрожжи, получаемые в ферментативном производстве после автоклавирования при 1200 С |
4,93 |
Bakkaloglu et al. (1998) |
[123] |
|
Cu |
Нативные живые клетки |
6,4 |
Al-Saraj et al. (1999) |
[117] |
|
Cu |
Получен после дистилляции виски, отмытый и лиофилизирован |
5,7 |
Bustard and McHale (1998) |
[118] |
|
Cu |
Клеточные стенки дрожжей после отмывки, автоклавирования и высушивания при 650 С |
25,6 |
Аронбаев С. и др. (2011) |
[121] |
|
Cu |
Иммобилизованные на цеолитах |
4,7 |
Bag et al. (1999a) |
[122] |
|
Cu |
Избыточные дрожжи обработанные формальдегидом для поперечной сшивки с поверхностью носителя в биореакторе колоночного типа |
8,1 |
Zhao and Duncan (1997) |
[124] |
|
Zn |
Избыточные дрожжи, получаемые в ферментативном производстве после автоклавирования при 1200 С |
3,45–1,95 |
Bakkaloglu et al. (1998) |
[123] |
|
Zn |
Нативные живые клетки |
23,4 |
Al-Saraj et al. (1999) |
[117] |
|
Zn |
Иммобилизованные клетки в золь-гель матрице |
35,3 |
Al-Saraj et al. (1999) |
[117] |
|
Zn |
Получен после дистилляции виски, отмытый и лиофилизирован |
16,9 |
Bustard and McHale (1998) |
[118] |
|
Zn |
Иммобилизованные на цеолитах |
8,37 |
Bag et al. (1999a) |
[125] |
|
Zn |
Избыточные дрожжи, обработанные формальдегидом для поперечной сшивки с поверхностью носителя в биореакторе колоночного типа |
7,1 |
Zhao and Duncan (1997) |
[124] |
|
Cd |
Кислотное протонирование осадочных дрожжей |
9,91–86,3 |
Vasudevan et al. (2003) |
[126] |
|
Cd |
Суспензия нативных клеток в культуральной среде |
35,5–58,4 |
Park et al. (2003) |
[116] |
|
Cd |
Суспензия нативных клеток в культуральной среде |
14,3–20,0 |
Park et al. (2003) |
[116] |
|
Cd |
Иммобилизованные на цеолитах |
10,9 |
Bag et al. (1999) |
[125] |
|
Cd |
Избыточные дрожжи, обработанные формальдегидом для поперечной сшивки с поверхностью носителя в биореакторе колоночного типа |
14 |
Zhao and Duncan (1997) |
[124] |
|
Cd |
Пекарские дрожжи, обработанные этанолом |
15,6 |
Goksungur et al. (2005) |
[120] |
|
Cd |
Мертвые клетки из аэроробных культур |
70 |
Volesky et al. (1993) |
[127] |
|
Cd |
Клеточные стенки дрожжей после отмывки, автоклавирования и высушивания при 650 С |
34,48 |
Аронбаев С. и др. (2011) |
[121] |
|
Hg |
Нативные клетки |
64,2 |
Al-Saraj et al. (1999) |
[117] |
|
Co |
Нативные клетки |
9,9 |
Al-Saraj et al. (1999) |
[117] |
|
Ni |
Избыточные дрожжи, получаемые в ферментативном производстве после автоклавирования при 1200 С |
1,47 |
Bakkaloglu et al. (1998) |
[123] |
|
Ni |
Нативные клетки |
8 |
Al-Saraj et al. (1999) |
[117] |
|
Ni |
Культивированные в лабораторных условиях дрожжи, высушены при 1000 С |
46,3 |
Ozer and Ozer (2003) |
[119] |
|
Ni |
Деактивирование дрожжевой биомассы кислотой при 800 С в течение 24 час. |
11,4 |
Padmavathy et al. (2003) |
[128] |
|
Cr(VI) |
Лабораторная культура с последующим высушиванием при 300С до влажности 15 % (сохранено 80,5 % живых клеток) |
Ок. 5,5 |
Rapoport and Muter (1995) |
[176] |
|
Cr(VI) |
Осадочные дрожжи — отход пивоварения, с иммобилизацией поперечной сшивкой с носителем формальдегидом в биореакторе колоночного типа |
6,3 |
Zhao and Duncan (1998) |
[129] |
|
Cr(VI) |
Культивированные в лабораторных условиях и высушенные при 1000 С |
32,6 |
Ozer and Ozer (2003) |
[119] |
|
Fe |
Получен после дистилляции виски, отмытый и лиофилизирован |
16,8 |
Bustard and McHale (1998) |
[118] |
|
Pd |
Иммобилизованные клетки осадочных дрожжей |
40,6 |
Xie et al. (2003) |
[130] |
|
Pt |
Иммобилизованные клетки осадочных дрожжей |
44 |
Xie et al. (2003) |
[130] |
|
Ag |
Получен после дистилляции виски, отмытый и лиофилизирован |
59 |
Bustard and McHale (1998) |
[118] |
|
Ag |
Промышленные отходы после биосорбционного извлечения серебра, с последующим лабораторным культивированием и высушиванием замораживанием. |
41,7 |
Simmons and Singleton (1996) |
[131] |
|
241Am |
Лабораторная культура, нативные клетки (в пересчете на уран) |
7,45–1880 мкг |
Liu et al. (2002) |
[132] |
|
Получен после дистилляции виски, отмытый и лиофилизирован |
180 |
Bustard and McHale (1998) |
[118] |
|
|
U |
Пивные дрожжи |
150–360 |
Popa et al. (2003) Riordan et al. (1997) |
[133] [134] |
|
U |
Отмытые и неотмытые дрожжи с преобладанием мертвых клеток |
150 |
Tsezos (1997) |
[135] |
|
U |
Клеточные стенки дрожжей после отмывки, автоклавирования и высушивания при 650 С |
183,3 |
Аронбаев С. Д. и др. (2011) |
[136] |
|
Th |
То же |
63 |
Tsezos (1997) |
[135] |
Как видно, величины значений максимальной сорбционной емкости тяжелых металлов сильно различаются, порой достигая различий в 2–3 порядка. Так, для свинца, в зависимости от происхождения дрожжевой биомассы максимальная биосорбционная емкость может варьироваться от 2 мг до ~ 300 мг на 1г сухого веса биомассы; для меди, цинка и кадмия наблюдается почти такая же картина. Saccharomyces cerevisiaе показали хорошую сорбционную способность по отношению к индивидуальным растворам радионуклидов. Такие противоречивые данные могут быть объяснены не только видовыми характеристиками дрожжей и их предобработкой перед использованием, но и самим подходам в расчетах биосорбционных параметров и стандартизации эксперимента [116]. Так было отмечено, что изменение сухого веса биомассы связано с температурой и временем сушки. Так, в работе [116] сушку проводили при 700 С до достижения постоянного веса, а в [119] при 1000 С. Поэтому в работе [34] показано, что и результаты отношения максимальной сорбционной емкости к высушенной массе должно быть разным. В связи с этим, как говорится в этой статье, внимание исследователей должно быть обращено на стандартизацию условий сушки дрожжевой биомассы.
1.5. Пищевые и сельскохозяйственные отходы как биосорбент.
Отходы сельскохозяйственной продукции могут быть применены в качестве сорбентов различных экотоксикантов. Торф, кора деревьев, древесные опилки, кожура бананов и цитрусовых, рисовая шелуха, хлопковые коробочки и др. могут быть использованы в качестве биосорбентов тяжелых металлов [137–140]. Представляя собой практически не истощаемые и возобновляемые ресурсы, они могут успешно конкурировать в качестве дешевых материалов для биосорбентов тяжелых и токсичных металлов. При этом технология извлечения сорбированных драгоценных и редких металлов может быть осуществлена простым сжиганием недорогой биомассы. В работе [141] сообщается об успешном извлечении ионов токсичных металлов Hg (II), Pb(II), Cd(II), Cu(II), Zn(II), Ni(II) из сточных вод с использованием биосорбента на основе выжимок при получении фруктовых соков. Обработанная слабым раствором фосфорной кислоты кожура показала большую сорбционную эффективность. При этом из различных влияющих факторов на кинетику и полноту адсорбции тяжелых металлов показал именно рН фактор.
В работе [142] была изучена способность плодов финиковых и банановых пальм сорбировать ионы свинца, кадмия, меди, хрома, никеля и цинка. Было показано, что биосорбция указанных ионов протекает довольно быстро, достигая ~ 70 процентного извлечения индивидуальных ионов в течение 15 минут. Сорбционная емкость такого биосорбента убывала в ряду: Pb+2>Cd+2>Cu+2>Zn+2>Ni+2>Cr+3.
Аджмал (Ajmal M.) и др. [143] изучили биосорбцию ионов никеля, цинка, кадмия и хрома обработанной солями фосфорной кислоты шелухи риса. Ими было установлено, что лучше и полнее всего происходит извлечение ионов Ni(II) и Cd(II) и зависит как от времени контакта, так и от начальной концентрации ионов в растворе, концентрации биосорбента, температуры и значения рН. Оптимальным значением при извлечении ионов меди отрубями пшеницы был рН=5 [144]. Повышение начальной концентрации ионов меди сказывалось на интенсивность сорбционного концентрирования. В работе [145] была показана сорбция ионов Cr(III) биосорбентом из яичной скорлупы домашней птицы. Саид (Saeed A.) [146] применил в качестве сорбента потенциал папайи и изучил сорбцию ионов меди, кадмия и цинка при различных условиях. Им также было показано, что оптимальным значением рН для биосорбции было 5, а время контактирования с адсорбатом — 60 минут. Селективность извлечения ионов указанных металлов находилась в ряду: Cu(II)>Cd(II)>Zn(II). В то же время им был установлен приоритет в селективном извлечении ионов свинца в многокомпонентном растворе, содержащем кроме ионов свинца, ионы кадмия, цинка, меди и никеля. Десорбция ионов с биосорбента была проведена 0,1 М раствором HCl [147].
В работе [148] были показаны особенности применения высушенной мякоти сахарной свеклы при биосорбции меди из растворов, содержащих 250 мг/л ионов меди. Максимальная сорбционная емкость — 28,5 мг/г сухого сорбента наблюдалась при рН=4 и 250С.
Способность сырых отрубей риса удалять хром и никель из водных растворов продемонстрирована в работах [149,150]. Были изучены равновесные модели [150] с применением уравнений Ленгмюра, Фрейндлиха, Темкина. В этой работе была показана правомочность использования всех этих моделей для описания биосорбционного процесса.
В [151] было изучено применение отходов черного чая для удаления Cr(VI). Этот процесс хорошо описывался уравнением Ленгмюра. Внимание экологов к загрязнениям ионами Cr(VI) объясняется наивысшей токсичностью именно этой формы нахождения хрома в водной среде. Поэтому исследования по удалению хрома с использованием эффективных биосорбентов особенно актуальны [152].
Применение биосорбента из панцыря морских крабов показано в работе [153]. Ионы меди и кобальта были удалены из водных растворов почти полностью при следующих условиях: размер частиц биосорбента 0,767 мм, дозировка биосорбента 5 г/л, рН=6. Максимальная емкость, рассчитанная по уравнению Ленгмюра, составляла для ионов Cu(II) — 243,9 мг/г и для ионов Со(II) — 322,6 мг/г.
Удалению ионов Cr(VI) и Hg(II) с использованием мелкодисперсных опилок виноградной лозы, включенных в ПВХ-матрицу, посвящена работа [154].
1.6. Сравнение биосорбционной способности различных типов биомассы.
Выше нами были приведены литературные данные по применению различных биосорбентов в концентрировании тяжелых металлов. В связи с этим уместен вопрос: какой биосорбент лучше всего использовать для предварительного концентрирования ионов тяжелых металлов и радионукдидов для их последующего извлечения и аналитического определения?
Очевидно, прямого ответа не последует, так как биосорбция, обозначаемая корифеями в этой области науки Валеским Б. и Кратчовилом Д. как «процесс, использующий недорогую биомассу с целью извлечения токсичных тяжелых металлов» [16] относится к явлениям, зависящим от многих факторов. В то же время, в ряде работ уже цитируесых нами [4,11,13,119,155], было проведено сравнение различных типов биомассы. Так, как уже отмечалось, бурые водоросли обладают лучшим биосорбционным потенциалом, по сравнению с зелеными и красными водрослями. [39].
О роли сульфатредуцирующих бактерий Thiobacillus ferrooxidans в концентрировании ионов тяжелых металлов говорится в [22,156,157]. Так, Corynebacterium glutamicum способна сорбировать свинец в количестве 566,7 мг/г [65], Bacillus firmus — Zn (418 мг/г). Pb -467 мг/г; Cu 381 мг/г) [64]. Цианобактерии способны показать высокую сорбционную способность по отношению к Au(III), Pd, Pt, U, Th [70,71].
Мицелиальные грибы пенициллы — Penicillium canescens, Penicillium purpurogenum, Penicillium chrysogenum показывают превосходные биосорбционные свойства по отношению Cd, Fe, Pb, Th, U [96,97,100, 158], а модифицированные формы Penicillium chrysogenum — Cd, Cu, Pb, Ni [108,109].
Аспергилиусы, кажется, имеют лучшую сорбционную способность по отношению Au, Co, Th, Zn [89, 159–161].
На этом фоне пивоваренные дрожжи Saccaromyces cerevisiae обладают весьма посредственной биосорбционной способностью [10,11,15,34,112,127]. В то же время авторами работ [117,119] показаны довольно хорошие сорбционные емкости дрожжевой биомассы для Pb (270,3 мг/г), Hg (64,2 мг/г), Ni (46,3 мг/г). А в работах [169, 177, 208] исследователи показали сорбционную емкость для дрожжевого биосорбента по отношению к Ag, Pt, Pd — 41,7 мг/г, 44 мг/г, 40,6 мг/г, соответственно. Пивоваренные дрожжи показали себя с наилучшей стороны в качестве биосорбента радионуклидов с емкостью по урану 150–360 мг/г и по торию — 63 мг/г [118, 133-,135].
В работе [162] проведено сравнение qмакс. ионов свинца для семи типов биомасс. Этими исследователями было установлено, что биосорбционные способности дрожжей Saccharomyces cerevisiae находятся посередине по сравнению с другими шестью типами биомассы.
Вианна (Vianna L.) [159] изучал способность к адсорбции ионов меди, кадмия и цинка тремя видами биомассы — отходов бродильной промышленности: Bacillus lentus, Aspergillus oryzae и S. cerevisiae. Исследования показали, что протонированная биомасса Bacillus lentus имела самую высокую биосорбционную емкость по Cu и Cd. Донмез и Аксу (Donmez G. & Aksu Z.) [122], изучая биоаккумулирование меди культивируемыми и приспособленными к ионам меди в лабораторных условиях S. cerevisiae, Kluyceromyces marxianus, S. pombe and Candida sp. показали, что значения максимальной биосорбционной емкости для Cu(II) убывают в ряду: S. cerevisiae (7.11) > K. marxianus (6.44) > Candida sp. (4.80) > S. pombe (1.27).
Далее было установлено, что Candida sp и Kluyceromyces marxianus можно считать более эффективными микроорганизмами, чем S. cerevisiae для аккумуляционного поглощения меди из растворов с высокой концентрацией Cu (II).
В таблице 3 представлены некоторые исследования, сравнивающие биосорбционные способности микроорганизмов различных таксономических групп и природных и синтетических сорбентов по отношению к ряду тяжелых металлов [163].
Таблица 3
Значения максимальной сорбционной емкости (ммоль/г) для некоторых сорбентов
|
Сорбент |
Cu(II) |
Pb(II) |
Cr(VI) |
Ni(II) |
|
Природные цеолиты |
- |
0,18 |
- |
- |
|
Активированный древесный уголь (пудра) |
- |
0,10 |
- |
- |
|
Активированный древесный уголь (гранулы)) |
0,03 |
0,15 |
0,07 |
- |
|
Ионообменные смолы |
- |
1,37 |
0,59 |
- |
|
Pseudomonas aeruginosa(бактерии) |
0,29 |
0,33 |
- |
- |
|
Rhizopus arrhizus (фунги) |
0,25 |
0,50 |
0,27 |
|
|
Fucus vesiculosus |
0,97 |
1,04 |
1,12 |
0,08 |
Валеский Б., еще в 1994 году [164] отметил, что фунги Rhizopus можно считать превосходным биосорбентом свинца, кадмия, меди, цинка, урана, в то время как S. сerevisiae не более как посредственный биосорбент, но их сорбционный потенциал выше, чем у других классических адсорбентов, таких как окись алюминия, активированный уголь, цеолиты [105]. Таким образом, несмотря на посредственные биосорбционные характеристики по отношению к большинству тяжелых металлов, пивоваренные дрожжи S. сerevisiae представляют собой уникальный биоматериал для применения в коммерческой биотехнологии, использующей биосорбционные процессы.
1.7. Влияние химической предобработки и иммобилизации микроорганизмов на эффективность биосорбции
Так как в биосорбционные процессы вовлекается, прежде всего, клеточная стенка микроорганизмов, то очевидно, что в результате ее модификации можно существенно изменить сорбционные характеристики биосорбента.
Наиболее простым способом модификации поверхности клетки микроорганизма могут быть нагревание, автоклавирование, замораживание, сушка в различном диапазоне температур, лиофилизация [165]. Химическая обработка может быть основана на специфической отмывке биомассы (деионизованной водой, метанолом, этанолом, моющими детергентами), поперечной сшивке с использованием формальдегида, глутарового альдегида, проведении щелочного или кислотного гидролиза с целью изменения поверхности и возможности доступа к функциональным группам, ответственных за биосорбцию [4].
В работе [166] исследователи показали, что клетки дрожжей, подвергнутые экстремальным условиям (физическая или химическая обработка) могут проявлять совершенно другие биосорбционные свойства по отношению к ионам тяжелых металлов. Так, в [100, 167] показано, что щелочная предобработка грибковой биомассы привела к существенному увеличению биосорбции ионов тяжелых металлов, когда кислотная — практически не повлияла на таковые. Автор [167] продемонстрировал изменение биосорбционных характеристик Saccharomyces cerevisiae по отношению Cu (II), подвергнув их различной предобработке: метанолом, формальдегидом и глутаровым альдегидом. В результате такой предобработки возможны этерификация карбоксильных групп и метилирование аминогрупп, которые, как оказалось, являются приоритетными в биосорбции ионов меди.
Проведение операций по физической модификации мертвых микроорганизмов, включающих термическую или механическую (возможно и механо-ферментативную) дезинтеграцию клеточной стенки позволяет увеличить поверхность «сайтов» и концентрацию активных функциональных групп, ответственных за биосрбцию тяжелых металлов, радионуклидов и прочих экотоксикантов [168].
На рисунке 1 приведена, ставшая уже классической, схема превращения биомассы микроорганизмов в коммерческий продукт — биосорбент [4].
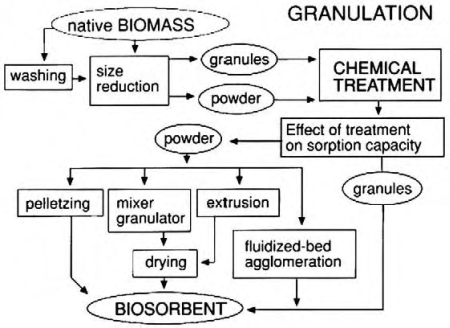
Рис. 1. Схема превращения биомассы в биосорбент.
Очевидно, что поиск эффективной предобработки микроорганизмов, способной повысить сорбционные и эксплуатационные характеристики биосорбентов, может стать прерогативой исследований, направленных на коммерциализацию биотехнолгоии.
Одним из таких путей является разработка технологий иммобилизации живых и мертвых микроорганизмов на твердой матрице, что позволяет улучшить эксплуатационные характеристики биосорбентов и их применение в непрерывных процессах с использованием проточных биореакторов различных типов. Необходимость проведения иммобилизации микроорганизмов в инертной водонерастворимой матрице обусловлена также целью придания механической прочности аморфному биосорбенту и обеспечению необходимых для оптимизации биосорбционных процессов гидродинамических режимов. Естественно, что при иммобилизации живых микроорганизмов следует применять более щадящие методы с целью сохранения и поддержания их жизнеобеспечения и метаболизма. В литературе имеется немало примеров иммобилизации ферментов, белков, органелл, тканей и клеток микроорганизмов [169–171].
Различные способы иммобилизации S.cerevisiae были изучены в работах [172–174].
В качестве матрицы для иммобилизации различными исследователями предлагались природные неорганические носители, типа гематитов, цеолитов, вермикулита и полиакриламидный и Са — альгинатный гели, полиуретан [170, 175, 176].
В таблице 4 приведены примеры использования иммобилизационной микробной биомассы для биосорбции ионов тяжелых металлов.
Таблица 4
Матрицы для иммобилизации биомассы микроорганизмов для получения твердых биосорбентов
|
Матрица |
Тип биомассы |
Металл |
Литература |
|
|
Альгинат кальция |
С. vulgaris S. platensis С. salina R. arrhizus |
Au, Cu, Fe, Zn, Co, Mn
|
[164], [176], [177] |
|
|
Полиакриламидный гель |
Citrobacter Rhizopus arrhizus |
U,Cd, Pb, Cu, Co, Cd |
[178] |
|
|
Кварц |
Algasorb
|
Cu, Ni, U, Pb, Hg, Cd, Zn, As, Ag |
[177] |
|
|
Полиуретан |
P. aeruginosa |
U |
[179] |
|
|
Полисульфон |
P. laminosum Citrobacter |
Pb, Cd, Zn |
[180], [181] |
|
При выборе способа иммобилизации микроорганизмов помимо созданий условий жизнеобеспечения (для живых микроорганизмов), необходимо предусмотреть и возможность легкости десорбции и регенерации биосорбента. А для этих целей, как правило, применяются растворы сильных кислот и оснований, способных вымывать микроорганизмы и разрушать сам твердый носитель. При этом не следует забывать, что и сам носитель, например активированный уголь, цеолиты, кварц, вермикулит, альгинатные гели проявляет способность к сорбции тяжелых металлов и радионуклидов.
1.8. Инструментально-техническое и математическое обеспечение исследования биосорбционных процессов.
Анализ литературы по биосорбции тяжелых металлов из технологических и сточных вод промышленных и сельско-хозяйственных предприятий, показывает, что содержания тяжелых металлов в этих объектах находятся в довольно широких диапазонах концентраций: от нескольких мг/л до десятков г/л. Биосорбция же, как правило, осуществляется в диапазоне 0,1–300 мг/л, т.е ~ 10–5–10–3 М. Для того, чтобы уловить изменения начальных концентраций ионов металла в растворе нужны надежные, чувствительные и точные приборы. Традиционно для таких целей используются спектрофотометрические и атомно-абсорбционные методы определения тяжелых металлов [58]. Эти же методы были применены при использование биосорбентов для предварительного концентрирования ионов токсичных металлов [84,85, 182–185].
Но при изучении механизмов биосорбции, и влияния функциональных групп биополимеров, из которых состоит биомасса, необходимы и другие инструментальные методы исследования. Наличие в распоряжении исследователя того, или другого инструмента, может повлиять на целостность представлений о биосорбции. В литературе [186–189] имеется информация о применении для объяснения механизма сорбции ИК-спектроскопии, электронной сканирующей и электронно-силовой микроскопии. В статьях [190–192] описано применение рентгеноструктурного и рентгенофазового анализа, ядерно-магнитного резонанса, а также применение термогравиометрического анализа и исследования по измерению электрокинетического ζ — потенциала [193]. Многие из этих методов требуют дорогостоящего и сложного оборудования. Кроме того, полученная информация не всегда может быть правильно интерпретирована для того, чтобы получить детальное представление о биосорбционном процесс. Однако не вызывает никакого сомнения, что именно применение этих методов исследования позволяет получить отличительные и дополнительные сведения для создания эффективных биосорбентов и оптимизации условий их использования [194].
В [195] приведен краткий обзор применения аналитической техники для изучения биосорбции и биосорбентов.
Математическое описание биосорбции и моделирование биосорбционных процессов являются важными инструментами в изучения этого явления. Биосорбция, как правило, осуществляется в гетерогенной системе: твердое — жидкое. Такие системы целесообразно исследовать, изучая стационарное равновесное состояние и динамику непрерывного потока.
В обзорах [195,196] были рассмотрены изотермы адсорбции для системы биосорбент — раствор одиночного иона металла. Созданием математической модели адсорбции занимались исследователи [16,158,196–198]. В этих работах были оценены возможности описания биосорбционного концентрирования с использованием уравнений для мономолекулярной адсорбции Фрейндлиха и Ленгмюра.
В большинстве случаев применение этих моделей было достаточно, для описания биосорбционного процесса, так как помогали рассчитать количественные параметры, характеризующие интенсивность и кинетику сорбции и значения максимальной сорбционной емкости.
Но, как правило, эти модели применимы для индивидуального иона металла. На практике сточные и природные воды являются многокомпонентными средами, когда присутствующие в ней вещества могут вступать во взаимодействие не только с адсорбентом, но и между собой. В таких системах построение модели довольно сложное занятие и в каждом конкретном случае должно быть целесообразно обоснованным [198]. Для изучения сорбционных процессов может быть правомочным использование различных моделей, как для индивидуальных веществ, так и их смесей с учетом конкурирующих факторов и температуры.
В работах [195,199–203] приводятся различные математические модели для описания биосорбционных процессов, основанные на равновесных изотермах адсорбции для одно- и мультикомпонентных систем.
Однако, применение только модели Ленгмюра при термодинамических расчетах, как отмечено в работах [204,205], может привести к искажению вычисленной величины ΔG — свободной энергии обмена Гиббса. В целом же, все исследователи приходят к заключению, что модели адсорбции по Фрейндлиху и Ленгмюру являются обязательными при изучении биосорбционных процессов и биосорбентов.
Заключение
Проведенный анализ литературных источников позволяет придти к следующим выводам:
биосорбционные методы концентрирования ионов тяжелых металлов и радионуклидов с использованием различных типов биомассы, не смотря на то, что большинство из этих исследований не вышли за рамки лабораторного эксперимента, являются перспективными и экономически обоснованными методами ремедиации сточных промышленных вод.
применение биомассы отходов пищевых, ферментативных и бродильных производств позволяет не только осуществить утилизацию этих отходов, но и сделать на их основе высокотехнологичный продукт — биосорбент для извлечения тяжелых металлов, радионуклидов и прочих экотоксикантов из природных и сточных вод с целью возвращения последних в рецикл. При этом осадочные дрожжи Saccharomyces cerevisiae, которые благодаря их дешевизне и доступности, могут стать привлекательным, с точки зрения коммерциализации биосорбционных технологий, сырьем для получения сорбентов тяжелых металлов и радионуклидов.
в литературе не нашло должного отражения возможности использования биомассы дрожжей и других микроорганизмов для предконцентрирования ультрамикроконцентраций экотоксикантов в аналитических целях для их последующего определения на уровне ПДК и ниже.
Эти выводы позволяют установить тенденции развития биосорбционных технологий в ближайшее время.
Литература:
- Эрлих Х. Жизнь микробов в экстремальных условиях.-М.: Мир, 1981. — 469 с.
- McCallan S. E. A., Miller L. P. Innate toxicity of fungicides. In: R. L. Metcalf (ed.). Advanced in Pest Control Research.- NY, USA: Interscience, 1956. Vol. II.- P. 107–134.
- Muraleedharan T. R., Iyengar L.,Venkobachar C.. Biosorption: an attractive alternative for metal removal and recovery.// Curr. Sci. -1991. Vol. 61. -P. 379–385.
- Vieira R. H. S. F., Volesky B. Biosorption: a solution to pollution? // Int. Microbiol. — 2000. Vol.3.- P.17–24.
- Volesky B. Biosorption and me. //Water Res.- 2007.Vol. 41. — P 4017–4029.
- Salehizadeh H., Shojaosadati S. A. Removal of metal ions from aqueous solution by polysaccharide produced from Bacillus firmus.// Water. Res.– 2003. Vol. 37.– P. 4231–5.
- Ullrich A. H., Smith M. W. The biosorption process of sewage and waste treatment. //Sewage Ind. Wastes — 1951. Vol. 23. — P. 1248–1253.
- Stasiak M. Application of biosorption process for renovation of waste waters at chemical industry. // Przemysl Chemiczny.- 1969. Vol. 48. — P. 426–428.
- Ames Crosta Mills & Company Ltd. And J. R. Sanderson Apparatus for the biological treatment of waste water by the biosorption process. Great Britain Patent GB1324358.-1973.
- Volesky B. Biosorption of heavy metals. — Florida, USA. CRC Press, 1990.
- Volesky B. Sorption and biosorption. — Quebec: Canada. BVSorbex Inc., 2004.
- Tsezos M. Biosorption of metals: the experience accumulated and the outlook for technology development.// Hydrometallurgy -2001.-Vol. 59.- P. 241–243.
- Park D., Yun Y-S., Park J. M. The Past, Present and Future Trends of Biosorption // Biotechnology and Bioprocess Eng. — 2010.- Vol.15. –P. 86–102.
- John Wase D. A., Forster C. F. Biosorbents for metal ions. — Florida, USA CRC Press,.- 1997.
- Volesky В. Biosorption and biosorbents. In: Biosorprion of heavy metals, edited by В. Volesky.- (CRC Press. Boca Raton. Florida), 1990. — P.3–5.
- Kratchovil D., Volesky B. Advances in the biosorptiou of heavy metals. // Trends Biotechnol.-1998. — Vol.16. — P. 291–300.
- Gadd G. M. Heavy metal accumulation by bacteria and other microorganisms.// Experientia — 1990. — Vol. 46. — P 834–840.
- Modak J. M., Natarajan K. A. Biosorption of metals using nonliving biomass-a review. //Miner. Metall. Proc.- 1995.- Vol. 12. — P. 189–196.
- Krishnani K. K., Ayyappan S. Heavy metals remediation of water using plants and lignocellulosic agrowastes. // Rev. Environ. Contam. Toxicol. — 2006.- Vol. 188. P. 59–84.
- Crini G. Recent developments in polysaccharide- based materials used as adsorbents in wastewater treatment.// Prog. Polym. Sci.-2005.-Vol. 30.-P. 38–70.
- Hai F. I., Yamamoto K., Fukushi K. Hybrid treatment systems for dye wastewater. // Crit. Rev. Environ. Sci. Technol. -2007.- Vol.37. –P.315–377.
- Буракаева А. Д., Русанов А. М., Лантух В. П. Роль микроорганизмов в очистке сточных вод от тяжелых металлов. Методическое пособие. -Оренбург, 1999. — 53 с.
- Каравайко Г. И. Биотехнология переработки металлсодержащих руд и концентратов. В кн. Биогеотехнология переработки металлсодержащих руд. Научные обзоры, 2005.- C. 72–83.
- Бакеева А. В. Биоремедиационные свойства фототрофных микроорганизмов из водоемов, загрязненных радиоактивными отходами.// Автореф. дисс…. канд. биол. наук. С-Пб., 2011.-20 с.
- Черникова А. А. Накопление меди и марганца в клетках цианобактерий Spirulinaplatensis.// Автореф. дисс…. канд. биол. наук. М., 2009.-22 с.
- Сиунова Т. В. Плазмидсодержащие ризосферные бактерии рода Pseudomonas, устойчивые к кобальту и никелю и стимулирующие рост растений. //Автореф. дисс…. канд. биол. наук. Пущино, 2011.- 22 с.
- Kapoor A., Viraraghavan T. Fungi biosorption-An alternative treatment option for heavy metal bearing wastewaters: A review.// Bioresour Technol.-1995.-Vol.53.-P. 195–206.
- Wang J. L. Immobilization techniques for biocatalysts and water pollution control. — Science Press. Beijing., 2002 (in Chinese).
- Kapoor A.,Viraraghavan T.,Cilliimore D. R. Removal of heavy metals using rhe fungus Aspergillus niger.// Bioresour Technol,-1999.- Vol. 70 –P. 95–104.
- Volesky В. Biosorbent materials.// Biotechnol. Bioeng. Symp.-1986.-Vol.16. –P. 121–126.
- Ilhan S., Cabuk A., Filik С., Caliskan F. Effect of pretreatment on biosorpfion of heavy metals by fungal biomass. //Trakya Univ.J.Sci. — 2004.-Vol.5. — P. 11–17.
- Holan Z. R., Volesky B. Biosorption of lead and nickel by biomass of marine algae.// Biotechnol Bioeng. — 1994. — Vol.43. — P.1001–1009.
- Das N., Vimala R., Karthika P. Biosorption of heavy metals. An overview // Indian J.Biotechnology.- 2008.- Vol. 7.- P.159–169.
- Wang J., Chen C. Biosorbehns for heavy metals removal and their future.// Biotechnology Advances.- 2009.- Vol. 27.- P. 195–226.
- Aksu Z. Application of biosorption for the removal of organic pollutants: a review. //Process Biochem.- 2005.-Vol. 40.-P. 997–1026.
- Sağ Y., Kutsal T. Recent trends in the biosorption of heavy metals: a review.// Biotechnol. Bioprocess Eng.- 2001.-Vol. 6.-P. 376–385.
- Babel S., Kurniawan T. A. Low-cost adsorbents for heavy metals uptake from contaminated water: a review. //J. Hazard. Mater.- 2003.-Vol 97.- P. 219–243.
- Crini G. Non-conventional low-cost adsorbentsfor dye removal: a review.// Bioresour. Technol. -2006.-Vol 9 7. — P. 1061–1085.
- Romera E., Gonzalez F., Ballester A., Blбzquez M. L., Muсoz J. A. Biosorption with algae: a statistical review. //Cri. Rev. Biotechnol. -2006.- Vol. 26.- P. 223–235.
- Ahluwaha S. S., Goyal D. Microbial and plant derived biomass for removal of heavy metals from waste water. // Bioresour Technol. -2007.- Vol. 98.- P. 2243–2257.
- Aksu Z., Sag Y., Kutsal T. Tlie biosorption of copper by C. vulgaris and Z. ramigera.// Environ Technol. -1992.- Vol. 13. — P. 579–586.
- Singh S., Rai В. N., Rai L. С. Ni (П) and Сг (VI) sorption kinetics by Microcystis in single and multinietallic system.// Process Btochem. -2001.- Vol. 36. — P. 1205–1213.
- Aksii Z., Kutsal T. A bioseparation process for removing lead (П) ions from waste water using Chlorella vulgaris.// J. Chem. Technol. Biotechnol. — 1991.- Vol. 52. — P. 109–118.
- De Carvalho R. P. Cliong К. H., Volesky B. Evaluation of the Cd. Cu and Zn biosorption in two-metal systems using an algal biosorbent. //Biotechnol. -1995.- Vol. 11. — P. 394.
- Antunes W. M., Luna A. S., Henriques С. A., Costa А. С. An evaluation of copper biosorption by a brown seaweed under optimized conditions. //Electronic J. biotechnol. — 2003.-Vol. 6.
- Gupta V. К., Shrivastava А. К., Jain N. Biosoфtion of chromium (VI) from aqueous solutions by green algae Spirogyra species. //Water Re. -2001.- Vol. 25. –P. 4079–4085.
- Cossich E. S., Tavares С. R., Ravagnani T. M. Biosorption of chromium (Ш) by Sargassum sp. Biomass. //Electronic J. biotechnol. -2004.- Vol.5. –P. 1–6.
- Park D. I. Y., Yirn К. H., Park J. M. Effect of Ni (II) on the reduction of Сг (VI) by Ecklonia biomass. //Bioresour Technol.- 2006.- Vol.97. –P. 1592–1598.
- Kiran В., Kaushik A., Kaushik С. P. Biosorption of Сг (VI) by native isolate of Lyngbya piitalis (HH-15) in the presence of salts. //J. Hazard. Mater. -2006.
- Mann H. Removal and recovery of heavy metals by biosorption. In: Volesky B., editor. //Biosorption of heavy metals. Boca Raton: CRC press. -1990. — P. 93–137.
- Bnerley J. A., Brierley С. L., Goyak G. M. AMT-BIOCLAIM™: A new wastewater treatment and metal recovery technology, in Fundamental and applied biohydron metallurgy, edited by R. W. Lawtence. //R.M. R. Branion & H. G. Ebner (Elsevier. Amsterdam). -1986.- P. 291–300.
- Addour L., Вешосше D., Boudries N., Comeau Y, Pauss A. Zinc uptake by Streptomyces rimosus biomass using a packed-bed column.// J. Chan.Technol. Biotechnol. — 1999.- Vol. 74. –P. 1089–1095.
- Mullen L. D., Wolfe D. C., Ferris F. G., Beveridge T. J., Flenuning С. A. Bacterial sorption of heavy metal. //Appl. Environ Microbiol. -1989- Vol. 55. –P. 3143–3149.
- Nakajima A., Sakaguchi T. Selective accumulation of heavy metals by microorganisms. //Appl.Microbiol BiotechnoL.-1986- Vol. 24. –P. 59–64
- Norberg A., Persson H. Accumulation of heavy metal ions by Zoogloea ramigera. //Biotechnol. Bioeng. -1984.- Vol. 26. — P. 239–246.
- Norberg A., Rydin S. Development of a continuous process for metal accumulation by Zoogloea ramigera.// Biotecnol. Bioeng. -1984- Vol. 26. –P. 265–268.
- Seki H., Suzuki A., Mitsue S. L. Biosorption of heavy metal ions on Rhoodobacter sphaeroides and Alcaligenes eutrophuss H16. //J. Colloid. Interface Sci. -1998.- Vol.197. — P. 185–190.
- Ilhan S., Noubakhsh M. N., Kilicarslan S., Ozdag H. Removal of chromium, lead and copper ions from industrial waste water by Staphylococcus sapropliyticus Turk. //Electronic J.biotechnol. -2004.- Vol.2. –P. 50–57.
- Ozdemir G., Ceyhan N., Ozturk T., Akirmak F., Cosar T. Biosorption of chromium (VI). Cadmium (II) and copper (П) by Pantoea sp. //ТЕМ 18. ChemEngJ. -2004.- Vol.102. –P. 249–253.
- Remacle J. The cell wall and metal binding, in Biosorption of heavy metals, edited by В. Volesky. //CRC Press Boca Raton. Florida. -1990- P. 83–92.
- Gourdon R., Bheude S., Rus E., Sofer S. S. Comparison of cadmium biosorption by Gram-positive and Gram-negative bacteria from activated sludge. //Biotechnol Lett. -1990.- Vol.12. –P. 839–842.
- Rabbani M., Ghafourian H., Sadeghi S., Nazeri Y. Biosorption of Cr (VI) by new bacterial strain (NRC-BT-2). //Int.Cons. Ser. -2005.- Vol.1276. –P. 268–269.
- Tunali S., Cabuk A., Akar T. Removal of lead and copper ions from aqueous solutions by bacterial strain isolated from soil. //Chem. Engl. -2006.- Vol.115. –P.203–211.
- Salehizadeh H., Shojaosadati S. A. Removal of metal ions from aqueous solution by polysaccharide produced from Bacillus firmus. //Water Res. -2003.- Vol.37. — P.4231–4235.
- Choi S. B., Yun Y. S. Lead biosorption by waste biomass of Corynebacterium glutamicum generated from lysine fermentation process. //Biotechnol. Lett. -2004.- Vol.26. –P.331–336.
- Uslu G., Tanyol M. Equilibrium and thermodynamic parameters of single and binary mixture biosorption of lead(II) and copper(II) ions onto Pseudomonas putida: effect of temperature. //J Hazard Mater. -20063-Vol. 135. –P.87–93.
- Pardo R., Herguedas M., Barrado E., Vega M. Biosorption ofcadmium, copper, lead and zinc by inactive biomass of Pseudomonas putida. //Anal. Bioana.l Chem. -2003- Vol. 376. –P. 26–32.
- Ziagova M., Dimitriadis С., Aslanidou D., Papaioannou X. Tzannetaki E. L., Liakopoulou-Kyriakides M. Comparative study of Cd(II) and Cr(Vi) biosorption on Staphylococcus xylosus and Pseudomonas sp. in single and binary mixtures. //Bioresour Technol. -2007.- Vol.98. –P.2859–2865.
- Loukidou M. X., Karapantsios T. D., Zouboulis A. I., Matis K. A. Diffusion kinetic study of cadmium (II) biosorption by Aeromonascaviae. // J. Chem.Technol. Biotechnol. -2004.- Vol.79. –P.711–719.
- de Vargas I., Macaskie L. E., Guibal E. Biosorption of palladium and platinum by sulfate-reducing bacteria. //J. Chem.Technol. Biotechnol. -2004.- Vol.79. –P.49–56.
- Nakajima A., TsurutaT. Competitive biosorption of thorium and uranium by Micrococcus luteus.// J.Radioanal.Nucl. Chem. -2004.- Vol.260. –P. 13–18.
- Мир растений. Энциклопедия в семи томах / Тахтаджян А. Л. (гл. ред.), под ред. Горленко М. В. (Т.2). — М.: «Просвещение», 1991. — Т. 2. Грибы. — С. 370–375.
- Жизнь растений. Энциклопедия в шести томах. Том 2. Грибы. — М.:Просвещение, 1976. — 480 с.
- Horikoshi T., Nakajima A., Sakaguchi T. Snidies on the accumulation of heavy metal elements in biological systems: Accumulation of uranium by microorganisms. //Eur. J. Appl. Microbiol. BiotechnoL. -1981.- Vol.12. –P. 90–96.
- Gadd G. M., De Rome L. Biosorption of copper by fungal melanin. // Appl. Microbiol Biotechnol. -1988.- Vol.29. –P. 610–617.
- Huang С. P., Westman D., Quirk К., Huang J P. The removal of cadmium (II) from dilute solutions by fungal biomass. //Water Sci. Tecimol. -1988.- Vol.20. –P. 369–376.
- Filipovic-Kovacevic Z., Sipos Lbriski F. Biosorption of chromium, copper, nickel and zinc ions onto fungal pellets of Aspergillus niger 405 from aqueous solutions. //Food Technol. Biotechnol. -2000.- Vol.38. –P. 211–216.
- Natarajan K. A., Subramanian S., Modak J. M. Biosorption of heavy metal ions from aqueous and cyanide solutions using fungal biomass. Biohydrometallurgy and the environment toward the mining of the 21st century, Pt В 1999. //Process Metallurgy Amsterdam: Elsevier Science Publ. -1999.- Vol.5. –P. 351 -361.
- Dursun A. Y., Uslu G., Cuci Y., Aksu Z. Bioaccumulation of copper(II), lead(II) and chromium (VI) by growing Aspergillus niger. //Process Biochem. -2003.- Vol.38. –P 1647–1651.
- Dursun A. Y. The effect of pH on the equilibrium of heavy metal biosorption by Aspergillus niger. //Fresenius Environ Bull. -2003.- Vol.12. –P. 1315–1322.
- Dursun A. Y., Uslu G., Tepe O., Cuci Y., Ekiz H. I. A comparative investigation on the bioaccumulation of heavy metal ions by growing Rhizopus arrhizus and Aspergillus niger.// Biochem. Engl. -2003.- Vol. 15. –P. 87–92.
- Dursun A. Y. A comparative study on determination of the equilibrium, kinetic and thermodynamic parameters of biosorption of copper(ll) and lead(II) ions onto pretreated Aspergillus niger. //Biochem. Eng. -2006.- Vol.28. –P. 187–195.
- Barros L. M., Macedo G. R., Duarte M. M., Silva E. P., Lobato A. Biosorption of cadmium using the ftingus Aspergillus niger. //Braz. J. Chem. Eng. -2003.- Vol. 20. –P. 229–239.
- Bag H.,Turker A.R, Tunceli A., Lale M. Determination of Fe(II)and Fe(III) in water by flame atomic absorption spectrophotometry after their separation with Aspergillus niger immobilized on sepiolite. //Anal. Sci. -2001.- Vol. 17. –P. 901–904.
- Bag H.,Turker A. R., Lale M. Determination of trace metals in geological samples by atomic absorption spectrophotometry after preconcentration by Aspergillus niger immobilized on sepiolite. //Ana0l Sci. -19990- Vol.15. –P. 1251–1256.
- Magyarosy A., Laidlaw R. D., Kilaas R., Echer C., Clark D. S., Keasling J. D. Nickel accumulation and nickel oxalate precipitation by Aspergillus niger. //Appl. Microbiol. Biotechnol. -2002.- Vol.59. –P. 382–388.
- Kapoor A., Viraraghavan T., Cullimore D. R. Removal ot heavy metals using the fungus Aspergillus niger. //Bioresour Technol. -19991- Vol.70. –P. 95–104.
- Bhainsa К. С., D’Souza S. F. Biosorption of uranium (Vl) by Aspergillus fumigatus. //Biotechnol. Techniques. -1999.- Vol.13. –P. 695–699.
- Spanelova M., Machovic V., Brezina M. Characterization and sorption properties of Aspergillus niger waste biomass. //Cent. Eur. J. Chem. -200.3- Vol.1. –P. 192–200.
- 88.Gomes N. C., Figueira M. M., Camargos E. R., Mendonca-Hagler L. C., Dias J. C., Linardi V. R. Cyano-metal complexes uptake by Aspergillus niger. //Biotechnol. Lett. -1999.- Vol.21. –P. 487–490.
- Gomes N. C., Linardi V. R. Removal ot gold, silver and copper by living and nonliving fungi from leach liquor obtained from the gold mining industry. //Rev. Microbiol. -1996.- Vol.27. –P. 218–222.
- Yang Y. Y., Liu N., Luo S. Z., Liao J. L., Jin J. N., Zhang T. M. Sorption of Am241 by Aspergillus niger spore and hyphae. //J. Radioanal. Nuc.l Chem. -2004.- Vol.260. –P. 659–663.
- Karunasagar D., Arunachalam J., Rashmi K., Latha J. N. L., Mohan P. M. Biosorption of inorganic and methyl mercury by a biosorbent from Aspergillus niger.// World J. Microbiol Biotechnol. -2003.-Vol.19. — P.291–295.
- Mendil D, Tuzen. M, Soylak M. A biosorption system for metal ions on Penicillium italicum loaded on Sepabeads SP 70 prior to flame atomic absorption spectrometric determinations. //Hazard Mater. -2008.- Vol.152. –P.1171–1178.
- Svecova L., Spanelova M., Kubal M., Guibal E. Cadmium, lead and mercury biosorption on waste fungal biomass issued from fermentation industry. 1. Equilibrium studies. //Sep. Purif.Technol. -2006.- Vol.52. –P. 142–153.
- Awofolu O. R., Okonkwo J. O., Roux van der Merwe R., Badenhorst J., Jordaan E. A new approach to chemical modification protocols of Aspergillus niger and sorption of lead ion by fungal species. //Electron. J. Biotechnol. -2006.- Vol.9. –P. 340–348.
- Cabuk A., Ilhan S., Filik C., Caliskan F. Pb2+ biosorption by pretreated fungal biomass. //Turk. J. Biol. -2005- Vol.29. –P. 23–28.
- Say R., Yilmaz N., Denizh A.. Biosorption ot cadmium, lead, mercury, and arsenic ions by the fungus Penicillium purpurogenum. //Sep. Sri. Technol. -2003- Vol.38. –P. 2039–2053.
- Say R., Yimaz N., Denizli A.. Removal ot heavy metal ions using the fungus Penicillium canescens. //Adsorpt. Sci. Technol. -2003.- Vol. 21. –P. 643–650.
- Shah M. P., Vora S. B., Dave S. R. Evaluation of potential use of immobilized Penicilium griseofulvum in bioremoval of copper. //Biohydrometallurgy and the environment toward the mining of the 21st century, Pt В 1999. Process Metallurgy Amsterdam: Elsevier Science Publ. В V; -1999.- Vol 5. –P. 227–235.
- Rostami К., Joodaki M. R. Some studies of cadmium adsorption using Aspergillus niger, Penicillium austurianum, employing an airlift fermenter. //Chem. Big. J. -2002.- Vol.89. –P. 239–252.
- Kapoor A., Viraraghavan T. Fungal biosorption — an alternative treatment option for heavy metal bearing wastewaters: a review. //BioresourTechnol. -1995.- Vol.53. –P. 195–206.
- Puranik P. R., Paknikar K. M. Influence of co-cations on biosorption of lead and zinc — a comparative evaluation in binary and multimetal systems. //Bioresour Technol. -1999.- Vol.70. –P. 269–76.
- Volesky В, Holan Z. R. Biosorption ot heavy metals.// Biotechnol.Prog. -1995.- Vol.11. — P. 235–50.
- 102.Volesky В. Biosorption by fungal biomass. In: Volesky B, editor. //Biosorption of heavy metals. Florida: CRC press. -1990.- P. 139–71.
- Volesky В. Introduction. In: Volesky B, editor. //Biosorption ot heavy metals. Boca Raton: CRC press. -1990-. –P. 3–5.
- Volesky В. Removal and recovery of heavy metals by biosorption. In: Volesky B., editor. //Biosorption of heavy metals. Florida: CRC press -1990.- P. 8–43.
- Kapoor A, Viraraghavan T. Fungi as biosorbents. In: Wase J, Forster C, editors. Biosorbents for metal ions. London, UK: CRC Press, 1997. — P. 67–86.
- Say R., Yimaz N., Denizli A.. Removal of heavy metal ions using the fungus Penicillium canescens.// Adsorpt. Sci. Technol. -2003.-Vol.21. –P.643–650.
- Xu X.Q, Li X.M, Yang Q, Liao D.X, Zeng G. M. Biosorption of lead and copper ions by Penicillium simplicissimum immobilized on a loofa sponge immobilized biomass. // Acta Sci. Circumst. -2008.-Vol.28. –P.95–100.
- Deng S. B., Ting Y. P. Fungal biomass with grafted poly(acrylic acid) for enhancement of Cu (II) and Cd(II) biosorption.// Langmuir.- 2005.-Vol. 21. –P. 5940–5948.
- Tan T.W, Hu B, Su H. J. Adsorption of Ni2+ on amine-modified mycelium of Penicillium chrysogenum. // Enzyme Microb. Technol.- 2004.-Vol.35.-P.508–513.
- Day R., Denizli A., Arica M. Y. Biosorption of cadmium(II), lead(II) and copper(II) with the filamentous fungus Phanerochaete chrysosporium. // Bioresour Technol. — 2001.-Vol.76.- P. 67–70.
- Дрожжи // http://ru.wikipedia.org/wiki/.
- Wang J.L, Chen С. Biosorption of heavy metals by Saccharomyces cerevisiae: a review.// Biotechnol. Adv. -2006.- Vol.24. — P.427–451.
- Park J. К., Lee J. W., Jung J. Y. Cadmium uptake capacity of two strains of Saccharomxyes cerevisiae cells.// Enzyme Microb. Technol. -2003.- Vol.33. — P.371–378.
- Marques P. A., Pinheiro H. M., Teixeira J. A., Rosa M. F. Removal efficiency of Cu2+. Cd2+ and Pb2+ by waste brewery biomass: pH and cation association effects. //Desalination. — 1999.- Vol. 124. –P.137–144.
- Podgorskii V.S, Kasatkina T. P., Lozovaia O. G. Yeasts-biosorbents of heavy metals.// Mikrobiol. Z.- 2004.- Vol.66. –P.91–103.
- Park J. K., Lee J. W., Jung J. Y. Cadmium uptake capacity of two strains of Saccharomyces cerevisiae cells.// Enzyme Microb. Technol.- 2003.- Vol.33. — P.371 -378.
- Al-Saraj M., Abdel-Latif M. S., El-Nahal I., Baraka R. Bioaccumulation of some hazardous metals by sol gel entrapped microorganisms. //J Non-Crys.t Solids.- 1999.-Vol.248. –P.137–140.
- Bustard M., McHale А. Р. Biosorption of heavy metals by distillery-derived biomass.// Bioprocess Engineering.- 1998.- Vol.19. –P.351–353.
- Ozer A, Ozer D. Comparative study of the biosorption of Pb(II), Ni(II) and Cr(VI) ions onto S. cerevisiae: determination of biosorption heats. // J. Hazard. Mater. -2003.-Vol. 100. — P.219–229.
- Goksungur Y., Uren S., Guvenc U. Biosorption of cadmium and lead ions by ethanol treated waste baker’s yeast biomass.// Bioresour Technol. — 2005.- Vol.96. –P. 103–109.
- Насимов А. М., Аронбаев С. Д. Биосорбция ионов свинца, кадмия и меди осадочными дрожжами Saccharomycescerevisiae // Экологические системы и приборы, ЭСиП.- 2011.- № 2. — С.3–7
- Donmez G, Aksu Z. The effect of copper (II) ions on the growth and bioaccumulation properties of some yeasts.// Process Biochem. -1999.-Vol.35. — P.135–142.
- Bakkaloglu I., Butter T. J., Evison L. M., Holland F. S., Hancock 1.С. Screening of various types biomass for removal and recovery of heavy metals (Zn, Cu, Ni) by biosorption, sedimentation and desorptioa.// Water Sci. Technol. -1998.- Vol. 38. –P.269–277.
- Zhao M., Duncan J. R. Use of formaldehyde cross-1 inked Saccharomyces cerevisiae in column bioreactors for removal of metals from aqueous solutions.// Biotechnol. Lett.- 1997.-Vol.19. –P.953–955.
- Bag H., Lale M., Turker A. R. Determination of Cu, Zn and Cd in water by FAAS after preconcentration by baker’s yeast (Saccharomyces cerevisiae) immobilized on sepiolite. //Fresenius Journal of Analytical Chemistry.- 1999.-Vol.363. –P. 224–230.
- Vasudevan P., Padmavathy V., Dhingra S. C. Kinetics of biosorption of cadmium on baker’s yeast.// Bioresour. Technol. -2003.-Vol.89. — P. 281–7.
- Volesky В., May H., Holan Z. R. Cadmium biosorption by Saccharomyces cerevisiae.// Biotechnol Bioeng. -1993.-Vol.41. –P.826–829.
- Padmavathy V., Vasudevan P., Dhingra S. C. Biosorption of nickel (II) ions on baker’s yeast.// Process Biochem.- 2003.-Vol.38. –P.1389–1395.
- Rapoport A.J, Muter O. A. Biosorption of hexavalent chromium by yeasts. //Process Biochem.- 1995.-Vol.30.- P.145–149.
- Xie D. D., Liu Y. Y., Wu C. L., Chen P., Fu J. K. Studies of properties on the immobilized Saccharomyces cerevisiae waste biomass adsorbing Pt4+ (in Chinese).//Journal of Xiamen Univerisity.- 2003.-;Vol.42. –P. 800–804.
- Liu H., Wang J. L., Wen X. H. Study on biosorption of lead by yeast. // Res. Environ Sci. -2002.- Vol.15. — P. 26–29.
- РораК., Cecal A., Drochioiu G, Humelnicu D. Saccharomyces cerevisiae as uranium bioaccumulating material: the influence of contact time, pH and anion nature. //Nukleonika. — 2003.- Vol.48. –P.121–125.
- Riordan С., Bustard M., Putt R., McHale A. P. Removal of uranium from solution using residual brewery yeast: combined biosorption and precipitation.// Biotechno.l Lett. — 1997.- Vol.19. –P. 385–387.
- Tsezos M. Biosorption of lanthanides, actinides and related materials in biosorbents for metal ions. In: Wase J, Forster C, editors. Biosorbents for metal ions. London UK: CRC Press. 1997. -P. 87–113.
- Аронбаев С. Д., Насимов А. М., Аронбаев Д. М. Биосорбция урана (VI) из водных растворов клеточными оболочками дрожжей S.cerevisiae // Вода: химия и экология. — 2011. — № 12. — С.51–55
- 137Ozer A., Ozer D. The adsorption of copper ions onto dehydrated wheat bran (DWB): Determination of equilibrium and thermodynamic parameters. //Process Biochem. -2004.-Vol.39. –P. 2183–2191.
- Bailey S. E., Olin T. J. Bricka R. M., Adrian D. D. A review of potentially low-cost sorbents for heavy metals.// Water Res. -1999.-Vol.33. –P. 2469–2479.
- Ho Y. S. Removal of copper from aqueous solution by tree fern.// Water Res. -2003.- Vol.37. –P. 2323–2330.
- Aronbaev S. D., Ziydullaeva G. Z. Minirewew of potentially low cost biosrbents from natural products for removing of heavy metals // European science review, 2014, № 11–12 (November-December) — P.88–92.
- Senthilfcumaar S., Bharathi S., Nithyanandhi D., Subburam V. Biosorption of toxic heavy metals from aqueous solutions. //Bioresour Technol. -2000.-Vol.75. –P. 163–165.
- Iqbal M., Saeed A., Akhtar N. Petiolar felt-sheath of palm: A new biosorbent for the removal of heavy metals from contaminated water. // Bioresour Technol. -2005.- Vol.81. –P. 151–153.
- Ajmal M., Rao R. A. K., Anwer S., Ahmad J., Ahmad R. Adsorption studies on rice husk: Removal and recovery of Cd (П) from wastewater. // Bioresour Technol-2003.- Vol.86. –P. 147–149.
- Basci N., Kocadagistan E., Kocadagistan B. Biosorption of aqueous solutions by wheat shell.// Destination. -2004.-Vol. 164. –P. 135–140.
- Chojnacka K. Biosorption of Cr (Ш) by eggshells. //Hazard Mater B. -2005.- Vol 121. –P. 167–173.
- Saeed A., Akhtar M. W., Iqbal M. Removal and recovery of heavy metals from aqueous solution using papaya wood as a newbiosorbent. //Sep. Purif.Technol. -2005.- Vol.45. — P.25–31.
- Saeed A., Iqbal M., Akhtar M. W., Removal and recovery of lead (П) from single and multimetal (Cd, Cu, Ni. Zn) solutions by crop milling waste (black gram husk). //J Hazard Mater. B. -2005.- Vol. 117. — P.65–73.
- Aksu Z., Isoglu I. A. Removal of copper (П) ions from aqueous solution by biosorption onto agricultural waste sugar beet pulp. // Process Biochem. -2005.-Vol.40. –P.3031–3044.
- Oliveira E. A., Montanher S. F., Andrade A. D., Nobrega J. A., Rollemberg M. C. Equilibrium studies for the sorption of chromium and nickel from aqueous solutions using raw rice bran. //Process Biochem. -2005.- Vol.40. –P. 3485–3490.
- Wang X., Qin Y. Equilibrium sorption isotherms for Cu:2+ on rice bran. //Process Biochem. -2005.- Vol.40. –P.677–680.
- Hossain M. A., Kuinita M., Optimization of parameters for Сг (VI) adsorption on used black tea leaves. //Adsorption. -2005.-Vol.11. –P. 561–568.
- Ahalya N., Kanamadi R. D., Ramachandra T. V. Biosorption of chromium (VI) from aqueous solutions by the husk of Bengal gram (Cicer arientimon).// Electronic J. Biotechnol. -2005.-Vol.8. –P. 258–264.
- Vijayaraghavan K., Palanivelu К., Velan M. Biosorption of copper (II) and cobalt (II) from aqueous solutions by crab shell particles.// Bioresour Technol. -2006.- Vol.97. — P. 1411–1419.
- Fiol N. Torre F. Demeyere P, Florido A & Villaescusa I, Vegetable waste-based sensors for metal ion determination. Sens Acniators B. 2006 (in press).
- Nourbakhsh M., Sag Y., Ozer D., Aksu Z., Kutsal T., Caglar A. A comparative study of various biosorbents for removal of chromium (VI) ions from industrial waste waters. //Process Biochem. -1994.- Vol.29. –P.1–5.
- Celaya R. J., Noriega J. A., Yeomans J. H., Ortega L. J., Ruiz-Manriquez A. Biosorption of Zn(II) by Thiobacillus ferrooxidans. //Bioproc. Eng. -2000.- Vol.22. -P539–542.
- Liu H. L., Chen B. Y., Lan Y. W., Cheng Y. C. Biosoiption of Zn(II) and Cu(II) by the indigenous Thiobacillus thiooxidans. / Chem. Engl. -2004.- Vol.97. –P. 195–201.
- Veglio F., Beolchini F. Removal of metals by biosorption: a review. // Hydrometallurgy. -1997.-Vol.44. –P. 301–316.
- Vianna LNL, Andrade MC, Nicoli JR. Screening of waste biomass from Saccharomyces cerevisiae, Aspergillus oryzae and Bacillus lentus fermentations for removal of Cu, Zn and Cd by biosorption.//World J. Microbiol. Biotechnol.- 2000.-Vol.16. –P.437–440.
- Alasheh S., Duvnjak Z.. Adsorption of copper and chromium by Aspergillus carbonarius.//Biotechnol. Prog. -1995.-Vol.11.-P.638–642.
- Gulati R., Saxena R. K., Gupta R. Fermentation waste of Aspergillus terreus: a potential copper biosorbent. //World J. Microbiol. Biotechnol. -2002.-;Vol.18. –P.397–401.
- Kogej A., Pavko A. Comparison of Rhizopus nigricans in a pelleted growth form with some other types of waste microbial biomass as biosorbents for metal ions.//World J. Microbiol. Biotechnol. -2001.-Vol.17.-P.677–685.
- Rincon J., Gonzalez F., Ballester A., Blazquez M. L., Munoz J. A. // Biosorption of heavy metals by chemically-activated alga Fucus vesiculosus. //J. Chem. Technol. Biotechnol. -2005.-Vol.80. –P.1403–1407.
- Volesky B. Advances in biosorption of metals — selection of biomass types.// FEMSMicrobio.lRev. — 1994.- Vol.14. –P.291–302.
- Елинов Н. П. Основы биотехнологии. — С-Пб.: Наука.1995. — 601 c.
- Lu Y.M, Wilkins E. Heavy metal removal by caustic-treated yeast immobilized in alginate.// J. Hazard Mater. -1996.-Vol.49. — P.165–179.
- Wang J. L. Biosorption of copper (II) by chemically modified biomass of Saccharomyces cerevisiae. //Process Biochem.- 2002.- Vol.37. –P.847–850.
- Errasquin E. L., Vazquez C. Tolerance and uptake of heavy metals by Trichoderma atroviride isolated from sludge.// Chemosphere -2003,-Vol. 50. –P.137–143.
- Вудворд Дж. Иммобилизованные клетки и ферменты. Методы. Пер.с анг. — М.: Мир, 1988. — 216с.
- Синицын А. П., Райнина Е. И., Лозинский В. И. и др. Иммобилизованные клетки микроорганизмов. — М. Изд. МГУ, 1994.- 288 с.
- Wang J. L. Microbialimmobilizationtechniquesandwaterpollutiontechnology.// Beijing: Sciencepress. — 2002.-.Vol.11. — P. 233–248.
- Гаранин Р. А. Метод биосорбции тяжелых металлов из промышленных сточных вод с использованием пивоваренных дрожжей Saccharomycescerevisiae. // Автореф. дис…. канд. биол. наук. М., 2011. — 25 с.
- Карпенко Д. В. Разработка технологии получения биосорбентов на основе осадочных пивных дрожжей и их применения для производства пива, этилового спирта и других пищевых продуктов // Дис.... д-ра техн. наук. М., 2005. — 373 с.
- Аронбаев С. Д., Насимов А. М., Аронбаев Д. М. Сравнительная характеристика методов иммобилизации клеточной биомассы пивоваренных дрожжей на твердых носителях // Научный Вестник СамГУ, 2015 № 3. — С. 95–102.
- Никовская Г. Н., Гордиенко А. С., Глоба Л. Н. Сорбция микроорганизмов волокнистыми материалами. // Микробиология. -1986.- Т. 55, № 4. — С. 691–694.
- Vijayaraghavan K., Yun Y. S. Bacterial biosorbents and biosorption. // Biotechnol. Adv. -2008.- Vol. 26. –P. 266–291.
- Wase J., Foster C. Biosorbents for metal ions. — (Taylor & Francis. London), 1997.
- Beveridge T. J., Fyfe W. S. Metal fixation by bacterial cell walls. //Can. J. Earth Sci. -1985.- Vol.22. –P. 1893–1898.
- Macaskie L. E., Dean А. С. R. Microbial metabolism, desolubilization. and deposition of heavy metals: Metal uptake by immobilized cells and application to the detoxification of liquid wastes. In Biological waste treatment, edited by A. Mizrahi (Alan R Liss Inc. New York) 1989. — P. 159–201.
- Нu M. Z. С., Reeves M. Biosorption of uranium by Pseitdomonas aeruginosa strain CSU immobilized in a novel matrix.// Bioteclmol. Prog. -1997.- Vol.13. — P. 60–70.
- Blanco A B. Sanz B. Llama M J & Serra J L, Biosorption of heavy metals to immobilized Phormidhim laminosum biomass. //J. Bioteclmol. -1999.-Vol.69. –P. 227–240.
- Puranik P. R., Paknikar K. M. Biosorption of lead, cadmium and zinc by Citrobacter strain of MCM B-181: Characterization studies.// Biotechnol. Prog. -1999.-Vol. 15. –P. 228–237.
- Maqulelra A., Elmahadl H. A. M., Puchades R. Use of Saccharomyces cerevisiae in flow injection atomic absorption spectrometry for trace metal preconcentration // Anal. Chem. — 1994.- Vol.66. -P.1462–1467
- Bag H., Lale M., Turker A. R. Determination of iron and nickel by flame atomic absorption spectrophotometry after preconcentration on Saccharomyces cerevisiae immobilized sepiolite // http://dx.doi.org/10
- Zou A.-M., Chen M.-L., Shu Y., Wang J.-H. Biological cell-sorption for separation / preconcentration of ultra-trace cadmium in a sequential injection system with detection by electrothermal atomic absorption spectrometry //J. Anal. At.Spectrom. -2007.-Vol.22. -P. 292–298.
- Godlewska-Zylkiewicz B. Microorganisms in inorganic chemical analysis // Anal. and Bioanal. Chem. — 2006.- Vol 384, № 1.-P. 144–123.
- Bishnoi, N. R.. Garima A. Fungus-an alternative for bioremediation of heavy metal containing wastewater: a review.// J. Sci. Ind. Res.-2005.- Vol. 64. –P. 93–100.
- Varma A. J., Deshpande S. V., Kennedy J. F. Metal complexation by chitosan and its derivatives: a review. //Carbohyd. Polym. -2004.- Vol. 55. –P. 77–93.
- Andrus Y., Texier A. C., Le Cloirec P. Rare earth elements removal by microbial biosorption: a review.// Environ. Technol. -2003.- Vol. 24. — P.1367–1375.
- Zhao G., Wu X., Tan X., Wang X. Sorption of Heavy Metal Ions from Aqueous Solutions: A Review // The Open Colloid Science Journal -2011.- Vol. 4. –P. 19–31.
- Kwiatkowski S., Thielen U., Glenney P., Moran C.A Study of Saccharomyces cerevisiaeCell Wall Glucans // J. Inst. Brew. -2009. –Vol.115. № 2. -P. 151–158.
- Аронбаев Д. М., Насимов A. M., Аронбаев С. Д., Куватов А. К. Исследование биосорбции ионов свинца клеточными стенками дрожжей Saccharomycescerevisiae методами ИК-спектрскопии // Сб. материалов II-ой Межд. Казахстанско-Российскойконф. Караганда, КарГУ. — 2012.- С.308–312.
- Singh N., Gadi R. Studies on Biosorption of Pb (ii) by the Nonliving Biomasses of Pseudomonas Oleovorans and Brevundimonas Vesicularis and its Removal from Wastewater Samples // E. J. Sci. Res. -2012.- Vol. 69, № 2. — P..279–289
- Шевчук И. А., Клименко Н. А. Изменение электрокинетического потенциала клеток Bacillus polymyxa ИМВ 8910 при взаимодействии с ионами U (VI) и стронция // Химия и технология воды. — 2010. — Т. 32, № 1. — С. 97–106.
- Аронбаев С. Д., Насимов А. М., Аронбаев Д. М. Применение физико-химических методов в исследовании клеточных стенок дрожжей Saccharomycescerevisiae // Вестник Московского Государственного областного Университета (МГОУ). — 2013. — № 2. — С.84–89.
- Аронбаев С. Д., Зиядуллаева Г. З., Аронбаев Д. М., Исмаилов З. Ф.. Обзор инструментально-технического и математического обеспечения исследований биосорбционных процессов // Всероссийский журнал научных публикаций. — 2014. — № 4(24). — С.8–12.
- Yu J. W., Neretnieks I. Single-component and multicomponent adsorption equilibrium on activated carbon of methylcyclohexane, toluene, and isobutyl methyl ketone.// Ind. Eng. Chem.Res. -1990.-Vol. 29. –P.220–231.
- Aksu Z. Application of biosorption for the removal of organic pollutants: a review. //Process Biochem. — 2005.- Vol.40. — P. 997–1026.
- Pagnanelli F., Esposito A., Veglio F. Multi-metallic modeling for biosorption of binary systems. //Water Res. — 2002.- Vol.36. –P. 4095–4105.
- Volesky B. Biosorption process simulation tools.// Hydrometallurgy. -2003.- Vol.71. –P.179–190.
- Gerente C., Lee V. K. C., Le Cloirec P., MaKay G. Application of chitosan for the removal of metals from wastewaters by adsorption — mechanisms and models review. //Crit. Rev. Environ. Sci. Technol. -2007.- Vol.37. –P. 41–127.
- Crini G., Badot P.-M. Application of chitosan, a natural aminopolysaccharide, for dye removal by aqueous solutions by adsorption processes using batch studies: a review of recent literature. //Prog. Polym. Sci. -2008.-Vol.33.- P.399–447.
- Ho Y.-S. Review of second-order models for adsorption systems.// J. Hazard. Mater. -2006.- Vol.136. –P. 681–689.
- Liu Y. and Y.-J. Liu. Biosorption isotherms, kinetics, and thermodynamics.// Sep. Purif. Technol. -2008.- Vol. 61.-P. 229–242.
- Baysal Z., Çinar E., Bulut Y., Alkan H., Dogru M. Equilibrium and thermodynamic studies on biosorption of Pb(II) onto Candida albicans biomass // J.Hazard. Mater.-2009.- Vol. 161. –P. 62–67.
- Liu Y. Some consideration on the Langmuir isotherm equation. // Colloid Surf. A.: Physicochem. Eng. Aspects. — 2006. — Vol. 274. –P. 34–36.
- Lu X. Comment on “Thermodynamic and isotherm studies of the biosorption of Cu(II), Pb(II), and Zn(II) by leaves of saltbush (Atriplex canescens)”. //J.Chem. Thermodyn. — 2008.- Vol. 40. –P. 739–740.







