Алкогольное поражение печени и процессы свободнорадикального окисления
Автор: Мбанзани Росси Ласкони
Рубрика: 9. Медицина и фармакология
Опубликовано в
LXXVI международная научная конференция «Исследования молодых ученых» (Казань, февраль 2024)
Дата публикации: 17.02.2024
Статья просмотрена: 26 раз
Библиографическое описание:
Мбанзани, Росси Ласкони. Алкогольное поражение печени и процессы свободнорадикального окисления / Росси Ласкони Мбанзани. — Текст : непосредственный // Исследования молодых ученых : материалы LXXVI Междунар. науч. конф. (г. Казань, февраль 2024 г.). — Казань : Молодой ученый, 2024. — С. 1-10. — URL: https://moluch.ru/conf/stud/archive/510/18370/ (дата обращения: 06.05.2024).
Одной из важнейших проблем современной медицины является повреждение печени при алкогольной болезни. Было проведено исследование состояния процесса свободнорадикального окисления липидов и белков. Полученные результаты показали, что алкоголь и эндотоксин относятся к токсичным продуктам, в результате чего снижается функциональная способность печени.
Ключевые слова: алкоголь, эндотоксин, перекисное окисление липидов, окислительная модификация белков, алкогольная болезнь печени.
В эти последние годы появились новые этиологические факторы поражения печени несмотря на это, одним из ведущих среди них остается алкоголь. Алкоголь является веществом, обладающим универсальным токсическим действием на различные органы, что позволяет сделать вывод о системном влиянии алкогольной интоксикации и выделить самостоятельную нозологическую единицу — алкогольную болезнь.
Выделяют несколько клинико-морфологических форм алкогольной болезни (печеночная, мозговая, сердечная и почечная) [1,2,3]. Наиболее часто встречается печеночная форма алкогольной болезни, поскольку это связано со значительным участием этого органа в окислении этанола.
В настоящее время доказано, что алкогольный стеатоз, гепатит (острый и хронический), цирроз печени являются стадиями прогрессирования алкогольной гепатопатии [4,5]. Острое алкогольное отравление сопровождается повышением кишечной проницаемости, что способствует адсорбции эндотоксина из тонкого кишечника. В свою очередь, эндотоксин кишечной микрофлоры в норме является фактором поддержания иммунного гомеостаза, но при патологии создаются условия для его проникновения в портальный, а затем в системный кровоток [6].
Между острой алкогольной интоксикацией и эндотоксинемией существует взаимосвязь, которая наблюдается в результате продукции печенью цитотоксических цитокинов и супероксидных анионов [7].
Имеющиеся в настоящее время в литературе данные, свидетельствуют об усилении процессов липопероксидации, но состояние процессов окислительной модификации белков при алкогольной болезни является практически неизученным.
Материалы и методы
С целью изучения процессов свободнорадикального окисления (СРО) при алкогольной болезни печени, нами была воспроизведена на лабораторных животных экспериментальная модель повреждения печени, которая максимально приближена к естественным процессам, протекающим в организме при алкогольных поражениях печени.
Опыты проведены на 80 нелинейных крысах, разделенных на 4 серии. Животным первой серии в течение 90 дней вводили в желудок 40 % этанол, в расчете 0.015 мг 40 %-ного этанола на 1г массы тела. Животным 2-й серии производили в течение 7-ми дней интраперитонеальные инъекции препарата эндотоксин (ЭТ) кишечной микрофлоры (К-235, Sigma, USA) из расчета 0.1 мг на 1 кг массы тела. В третьей серии препарат ЭТ, в такой же дозе и тех же условиях опыта, вводили крысам, подвергшимся 90-дневной алкоголизации, 4-я серия — интактные животные (контроль).
Животные содержались в стандартных условиях и на стандартном рационе питания. При работе были использованы «Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений (РД-АПК 3.10.07.02–09) утверждены Министерством сельского хозяйства России в 2009 году». Для забора крови и ткани печени крыс забивали декапитацией. Ткань печени использовали для морфологических исследований. Сыворотку крови для биохимических исследований получали из цельной крови центрифугированием при 3000 об/мин в течение 30 минут.
Для оценки интенсивности процессов СРО липидов, определяли содержание коньюгированных диенов (КД) и диенкетонов (ДК), как первичных продуктов перекисного окисления липидов, по методике Стальной И. Д. в модификации Казакова К. С. и Сидоровой Л. Л. [9,10]. Уровень карбонильных продуктов ПОЛ, активных по отношению к 2-тиобарбитуровой кислоте, определяли при помощи диагностических наборов ТБК-Агат по методике Mihara M. [11]. Согласно последним данным, окислительной модификации подвергаются не только липиды, но и белки сыворотки крови и мембран клеток, поэтому нами проводилась изучение спонтанной окислительной модификации белков сыворотки крови по методу Левина в модификации Дубининой Е. Е. [12,13]. Молекулы средней массы определяли по методу Габриэлян Н. И. в модификации Брасюк Д. Л. [14,15].
Полученные данные обрабатывались статистически, методом дисперсионного анализа.
Результаты исследований и обсуждение
Биотрансформация этанола, поступающего в организм, осуществляется посредством нескольких ферментативных систем. Ферментативные системы окисления алкоголя достаточно хорошо изучены и, в целом, их можно свести к следующему: основная роль в окислении этанола принадлежит ферменту алкогольдегидрогеназе (АДГ), которая определяет скорость катаболизма этанола и превращает алкоголь в ацетальдегид. В настоящий момент выделяют две фракции АДГ, конвертирующих этанол в ацетальдегид: желудочная фракция АДГ и печеночная фракция АДГ. Печеночная фракция АДГ является цитозольным НАД зависимым ферментом и окисляет различные биогенные алкоголи, в т. ч. и этанол, если его тканевая концентрация не превышает 10 ммоль/л.
При хроническом употреблении алкоголя в высоких дозах, окисление алкоголя также осуществляется минорной системой микросомального окисления.
Ацетальдегид является высокотоксичным соединением и его обезвреживание осуществляется в печени ферментом альдегиддегидрогеназой (АлДГ), превращающей ацетальдегид в ацетат. АлДГ имеет два изофермента: АЛДГ1 и АЛДГ2, причем АлДГ2 регулирует окисление основного количества ацетальдегида в ацетат, используя в качестве кофермента НАД.
Другие ацетальдегид-окисляющие ферменты, среди которых наиболее известны ксантиноксидаза и альдегидоксидаза, характеризуются низким сродством к этому субстрату. Но при алкоголизации они способны участвовать в реализации токсических эффектов, связанных с тем, что при окислении ацетальдегида этими энзимами продуцируются активные формы кислорода, инициирующие реакции свободно-радикального окисления.
Таким образом, в процессах утилизации алкоголя, активные формы кислорода (АФК) образуются в результате катаболизма этанола минорной системой микросомального окисления, которая активизируется при содержании алкоголя более 10 ммоль/л ткани. Имеющиеся в литературе данные свидетельствуют об усилении процессов перекисной модификации липидов (липопероксидация), как правило протекающих посредством образования коньюгированных аддуктов полиненасыщенных жирных кислот, входящих в состав липидов мембран, либо липопротеидов, с последующим образованием гидроперекисей липидов, а также карбонильных производных.
Супероксидные анионы или АФК, к которым относятся супероксид анион-радикал . О 2 - , перекись водорода Н 2 О 2 , гидроксил радикал . ОН, инициируют процессы свободнорадикального окисления. Интенсификация процессов свободнорадикального окисления (СРО), является одной из причин вызываемых алкоголем повреждений, сопровождаемых накоплением в печени и крови высоко токсичных продуктов перекисного окисления, что снижает функциональные возможности печени и приводит к развитию функциональных и структурных нарушений, в т. ч. и в других тканях и органах.
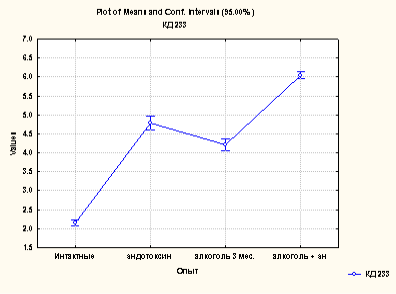
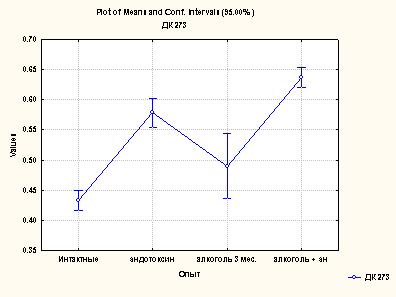
Результаты проведенных нами исследований в экспериментах по моделированию поражения печени посредством алкоголя и эндотоксина, а также при их сочетанном действии показывают повышение уровня коньюгированных диенов и диенкетонов, которые представлены на рис.1(а,б).
а)
б)
Рис. 1. Содержание коньюгированных диенов (а) и диенкетонов (б) в сыворотке крови различных групп животных
Содержание коньюгированных диенов превышало, по сравнению с нормой, при различных формах поражения, в среднем в 2 раза, однако, при сочетанном действии алкоголя и эндотоксина этот показатель более выражен. Аналогичная закономерность выявлена для диенкетонов. Повышенное содержание продуктов липопероксидации фиксировалось по избыточному накоплению как первичных продуктов (КД и ДК), так и вторичных продуктов (малоновый диальдегид- МДА) (рис.2.).
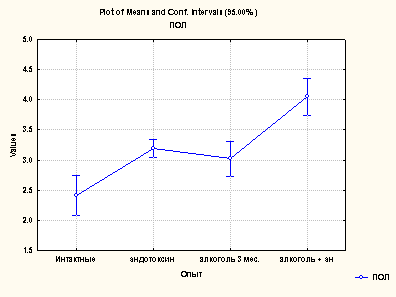
Рис. 2. Показатели накопления МДА в сыворотке крови крыс при различных формах поражения печени
С целью изучения процессов окислительной модификации белков (ОМБ), нами были проведены исследования по определению карбонильных соединений, образующихся при модификации белков в состоянии окислительного стресса, вызванного раздельным и сочетанным действием этанола и эндотоксина (см. схему эксперимента). Проведенные исследования показали повышение содержания карбонильных соединений в белках сыворотки крови по сравнению с контролем. Зависимость между состоянием печени при алкогольном, а также эндотоксиновом поражении и показателями содержания карбонильных групп представлены на рис.3.
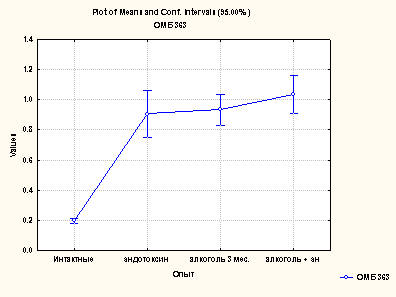
Рис. 3. Состояние процессов ОМБ при различных формах поражения печени
Повышенному содержанию продуктов окислительной модификации белков сопутствовало увеличение содержания пептидов средней массы (ПСМ), причем статистически достоверными были показатели, измеренные при длине волны 254 нм. Данные по содержанию ПСМ представлены на рис. 4.
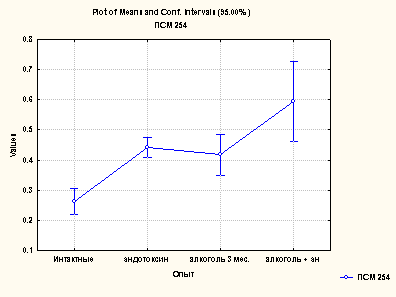
Рис. 4. Определение ПСМ при различных формах поражения печени
Известно, что хроническое употребление алкоголя приводит к развитию патологических изменений печени, что, в первую очередь, проявляется в виде окислительного стресса, сопровождающегося накоплением продуктов окисления этанола. Так как скорость окисления этанола до ацетальдегида в печени выше окисляющей способности альдегидокисляющих ферментных систем, то при алкогольной интоксикации формируется избыток промежуточного метаболита — ацетальдегида, оказывающего местное (гепатотоксическое) действие. В результате его поступления в кровь стимулируются процессы как липопероксидации, так и окислительной модификации белков, о чем свидетельствуют полученные нами данные исследования первичных и вторичных продуктов перекисного окисления липидов (КД, ДК и МДА) и окислительной модификации белков.
В настоящее время в литературе обсуждается вопрос утилизации продуктов перекисных процессов. Согласно данным литературы, образующиеся продукты перекисных процессов утилизируются компонентами антиоксидантной системы, за счет чего снижается их токсическое действие на плазматическую мембрану. Предполагается, что карбонильные продукты, образующиеся в процессе окислительной модификации белков, утилизируются в цитозоле, а коньюгированные диены, триены, вместе с окисленными белками накапливаются в виде «липофуциновых бляшек». При проведении морфологических исследований, такие «бляшки» нами не были обнаружены, но в группе сочетанного действия алкоголя и эндотоксина, были обнаружены более выраженные альтеративные изменения в ткани печени. По всей вероятности, это связано с более интенсивным образованием токсических продуктов, что было обнаружено в ходе исследований.
Многообразные нарушения, развивающиеся в результате алкогольной интоксикации и затрагивающие практически все виды обмена веществ, во многом определяются метаболическими эффектами, непосредственно обусловленными процессами окисления алкоголя. Поскольку основные ферменты окисления этанола и ацетальдегида — АДГ и АлДГ являются НАД-зависимыми, то при алкогольной интоксикации накапливаются значительные количества НАДН. Рост соотношения НАДН/НАД влечет за собой обширные нарушения окислительно-восстановительных процессов. Поэтому, к наиболее важным повреждающим эффектам, формирующимся на этапах катаболизма этилового спирта, можно отнести:
– увеличение интрацеллюлярного содержания НАДН;
– образование и воздействие токсичного метаболита — ацетальдегида;
– интенсификация процессов свободно-радикального окисления липидов и белков.
Представленные нами данные согласуются с результатами, полученными при изучении процессов СРО при других патологических состояниях [16,17].
Таким образом, на экспериментальных моделях хронического поражения печени у крыс, вызванного введением алкоголя и эндотоксина, а также их сочетанного действия, выявлено увеличение содержания в сыворотке крови первичных и вторичных продуктов липопероксидации, сопровождающееся интенсификацией окислительной модификации белков. Изучение уровня содержания продуктов свободно-радикальных процессов при различных поражениях печени показало, что при алкогольно-эндотоксиновой интоксикации, окислительные процессы протекают более интенсивно. Так как при элиминации алкоголя и эндотоксина наблюдается нарушение проницаемости и функционирования мембран не только в результате активации процессов перекисного окисления липидов, но и усиления окислительной модификации белков, вызванного окислительным стрессом, мы можем предполагать значительное участие этих процессов в развитии ряда патологических изменений в клетках печени, приводящих к различным формам алкогольной болезни, проявляющейся в различных формах (от алкогольного стеатоза до цирроза).
Литература:
- Григорьев П. Я., Яковенко И. Н. Алкогольная болезнь печени//Московский мед. журнал.- 1998.-№ 5.- С.13–15
- Дзяк В. Н., Минкус Р. И., Скупник А. Н. Алкогольная кардиомиопатия// Здоровье.Киев.- 1980
- Schellenberg F., Well J.//Alcohol and alcoholism.- 1987.- Suppl. P 625–629
- Маколкин В. И. Патогенез и эволюция поражения внутренних органов при хроническом алкоголизме// Тер.архив.- М.Мед.- 1987.- № 2.-С.3–6
- Серов В. В. Лаппиш К. И. Морфологическая диагностика заболеваний печени// М.Мед.-1989.-336с.
- Bautista A. P., Spitzen J. J. H.Aukcen.expr.- 1996.- 20(8), 1395–1400
- Keshvarzian A., Holms E., Patel M., Iber F.//Am. J. gastroenterol.-1995.- vol.1.- p. 37–41
- Ю. М. Кожем , якін та соавт. Науково-практичні рекомендації з утримання лабораторних тварин та роботи з ними// Київ-. 2002р.- 155 с.
- Стальная И. Д. Метод определения диеновой коньюгации ненасыщенных высших жирных кислот // Современные методы в биохимии. –М.: Медицина, 1977. — С. 62–64.
- Убайдуллаев А. М., Казаков К. С., Мукимов Д. М., Махмудов Б. А. Лабораторный контроль генетических особенностей воспаления и эффективности лечения при хроническом бронхите // Клиническая лабораторная диагностика. — 1994. — № 3. — С.24–28.
- Mihara M., Uchiyama M. et al. // Biochem.Med. — 1980. -V.23. –P.302.
- Levine R. L., Garland D., Oliver C. N. et al. Meth.Enzymol. — 1990. — V.186. –P.464–478.
- Дубинина Е. Е., Бурмистров С. О., Ходов Д. А., Поротов И. Г. Окислительная модификация белков сыворотки крови человека, метод ее определения // Вопр.мед.химии. — 1995. — № 1. — С.24–26.
- Габриэлян Н. И., Липатова В. И. Опыт использования показателя средних молекул в крови для диагностики нефрологических заболеваний у детей // Лаб.дело. — 1984. — № 3. — С.138–140.
- Брасюк Д. Л. Модификация метода определения молекул средней массы // Клиническая лабораторная диагностика. — 1995. — № 1. — С.18.
- Дубинина Е. Е., Морозова М. Г., Леонова Н. В. и др. Окислительная модификация белков плазмы крови больных психическими расстройствами (депрессия, деперсонализация) // Вопр.мед.химии. — 2000. — № 4. — С.1–11.
- Гуляева Н. В., Ерин А. Н., Роль свободнорадикальных процессов в развитии нейродегенеративных заболеваний // Нейрохимия. — 1995. — т.12. Вып.2. — С.3–14.











