Метод окрашивания для изучения морфологических отличий taeniidae
Авторы: Кан Мария Дмитриевна, Киян Владимир Сергеевич
Рубрика: 10. Ветеринария
Опубликовано в
LI международная научная конференция «Исследования молодых ученых» (Казань, декабрь 2022)
Дата публикации: 30.12.2022
Статья просмотрена: 34 раза
Библиографическое описание:
Кан, М. Д. Метод окрашивания для изучения морфологических отличий taeniidae / М. Д. Кан, В. С. Киян. — Текст : непосредственный // Исследования молодых ученых : материалы LI Междунар. науч. конф. (г. Казань, декабрь 2022 г.). — Казань : Молодой ученый, 2022. — С. 22-26. — URL: https://moluch.ru/conf/stud/archive/472/17694/ (дата обращения: 28.04.2024).
Актуальность проблемы тениозов человека обусловлена широкой распространенностью данных паразитозов, часто поражающих человека и животных. В статье дано описание метода окрашивания по гематоксилин-эозину и его преимущество относительно других методов морфологической дифференциации представителей Taeniidae.
Ключевые слова: паразитарные болезни, Taeniidae, Multiceps multiceps, Таеniа hidatigena, Т. ovis, Т. Pisiformis, T. cervi, T.krabbei, T.parenchimatosa, T.arctica, T.crassiceps, морфология, окрашивание, гематоксилин-эозин.
Семейство Taeniidae включает в себя кроме эхинококкуса и альвеококкуса значительное число цестод, которые паразитируют в тонком отделе кишечника собак, кошек, пушных зверей и других плотоядных. При этом псовые являются источником заражения ларвальными цестодозами животных и человека. Из имагинальных тениидозов среди собак, волков и некоторых других плотоядных наиболее распространены те, что вызывают виды Multiceps multiceps, Таеniа hidatigena, Т. ovis, Т. pisiformis, которые, в личиночной стадии вызывают соответственно ценуроз у овец и других сельскохозяйственных животных, цистицеркоз серозных покровов у многих животных, цистицеркоз у овец, цистицеркоз серозных покровов у кроликов и зайцев; а T. cervi, T.krabbei, T.parenchimatosa, T.arctica, T.crassiceps вызывают у оленей, косуль и грызунов цистецеркозы и т.д. [1].
В настоящее время, несмотря на достижения в области молекулярной диагностики, микроскопический анализ яиц и личинок, а также взрослых червей остается основным методом диагностики кишечных гельминтов у людей и животных во всем мире. В большинстве случаев такая морфологическая диагностика основана на идентификации родов или видов гельминтов на основе их характерной морфологии [2].
Однозначная идентификация рода / вида гельминтов часто зависит от прямого морфологического исследования всего организма или отдельных частей (например, проглоттид). В идеале это делается предварительно с помощью гистологического среза и окрашивания, что в некоторых случаях может быть информативным, но часто исключает или усложняет конкретный диагноз.
В зависимости от проводимых исследований и состояния самого паразита существуют различные методы окрашивания цестод. В основном используются раствор гематоксилина Майера, молочно-карминовое окрашивание Блажина, раствор квасцового кармина и гематоксилин-эозиновое окрашивание [3].
Окрашивание гематоксилином-эозином является наиболее распространенным методом окрашивания гельминтов. Этот метод позволяет установить взаимосвязи между частями тела, прекрасно выявляя все клеточные элементы и некоторые неклеточные структуры. Почти во всех случаях, независимо от задачи, используется окрашивание гематоксилином-эозином. В других случаях, когда исследователь сталкивается с особой задачей, они используют специальные методы, окрашивая при этом параллельно гематоксилин-эозином.
Преимуществом этого метода является двойное окрашивание: гематоксилин — основной краситель — окрашивает ядра клеток, эозин — кислотный краситель — окрашивает протоплазму клеток, и, в меньшей степени, различные неклеточные структуры [4].
В ходе исследования мы окрашивали взрослых червей рода Taeniidae гематоксилин-эозином. Процедура окрашивания: прежде всего, необходимо промыть ленточных червей в дистиллированной воде, затем окрасить раствором гематоксилина. Окрашенных червей промывают водой и дифференцируют подкисленным спиртом; во время дифференцировки паренхима светлеет до светло-розового цвета, а на ее фоне четко проступают органы и протоки. Затем промывают слабым раствором нашатырного спирта до тех пор, пока срезы не посинеют. Затем окрашивают водным раствором эозина, чтобы окрасить эозинофильные структуры клетки. Тщательно промойте объект тремя порциями дистиллированной воды, чтобы удалить излишки эозина, и, наконец, обезводить его.
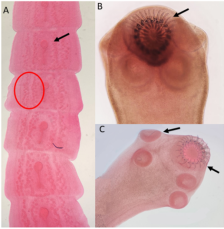
Рис. 1. Примеры окрашенных образцов могут быть относительно легко дифференцированы. (A. a зрелый сегмент Mesocestoides spp ., B. крючки Taenia spp ., C. сколекс Taenia spp .)
Для нашего исследования преимуществом метода было то, что он позволяет установить взаимосвязь между частями тела, прекрасно выявляя все клеточные элементы и некоторые неклеточные структуры (рис. 1). Используя метод окрашивания, были дифференцированы виды Mesocestoides spp., T. krabbei, T. hydatigena, Dipylidium caninum . Отличительными особенностями которых были их морфологическое строение, например, огуречный like солитер отличался от других цестод яйцевидными капсулами в форме кокона. У видов цестод значительное внимание уделялось крючкам и генитальным сосочкам [5].
Необходимость в процедуре окрашивания в течение многих лет была значительно выше, чем морфологический скрининг. Поскольку при наблюдении за незнакомой морфологией паразитологи часто обращаются к атласам и учебникам, чтобы определить тип рассматриваемого гельминта. Эти ссылки обычно описывают стандартное представление паразита без учета потенциальных аномальных форм.
Поскольку морфологическое отклонение от типичных диапазонов также является важным фактором и источником путаницы в исследованиях гельминтов диких животных, методы окрашивания позволяют оптимально изучить морфологию паразита и идентифицировать его род / вид [6].
Заключение
Таким образом, можно сделать вывод, что использование методов окрашивания, даже будучи трудоемким, оправдывает исследование. Эти методы позволяют более тщательно изучить структуру и расположение внутренних органов, что, в свою очередь, делает морфологический анализ более точным и является неотъемлемой частью паразитологического исследования.
Исследование, представленное выше, было проведено при финансовой поддержке Министерства образования и науки Республики Казахстан в рамках проекта AP08052252 на 2020–2022 годы.
Литература:
- Лоуренс Р. Эш, Томас К. Орихел А. Паразитология человека: учебное пособие для Американского общества клинической патологии. — Чикаго, 2007. — 315 с.
- Ван Лисхаут Л., Ростенберг М. Клинические последствия новых диагностических инструментов для кишечных паразитов: учебное пособие по клинической микробиологии. — Нью-Йорк, 2015. — 2 с.
- Гарсия Л. С. Диагностическая медицинская паразитология: учебное пособие по патогенезу и клиническим аспектам инфекций. — Вашингтон, 2007. — 1112 с.
- Стоард Д., Адамс Э. Предисловие к достижениям в диагностике инфекционных и паразитарных заболеваний: выявление паразитов, имеющих медицинское и ветеринарное значение. — Кембридж: издательство Кембриджского университета, 2014. — 1781 с.
- Киодини П. Новая диагностика в паразитологии: учебное пособие для Национальной медицинской библиотеки, 2005. — Нью-Йорк — 267 с.
- Дейли Р., Киодини П. Лабораторные исследования и диагностика тропических болезней у путешественников: учебное пособие для Национальной медицинской библиотеки, 2012. — Чикаго — 803 с.











