Желчнокаменная болезнь (ЖКБ) по праву считается одним из самых распространённых заболеваний и уступает лидерство лишь атеросклерозу, оставив позади язвенную болезнь желудка и двенадцатиперстной кишки (ДПК) [2, 3, 5, 6].
В патогенезе ЖКБ существенная роль принадлежит микрофлоре кишечника и гепатобилиарной зоны. Однако результаты бактериологических исследований желчи при этой патологии не всегда сопоставимы. Крайне мало работ, посвящённых изучению роли анаэробных микроорганизмов при ЖКБ, значение которых в патогенезе осложнённых форм холелитиаза велико. Отсутствуют методы микробиологической экспресс-диагностики возбудителей инфекционного процесса в желчном пузыре. Противоречивы результаты определения чувствительности биликультур к антимикробным химиопрепаратам [1, 4].
Цель исследования: улучшение результатов лечения больных острым калькулёзным холециститом.
Материал и методы исследования: всего обследовано 125 пациентов с острым калькулёзным холециститом (ОКХ) в возрасте от 25 до 80 лет. В исследование вошли 97 (77,6%) женщин и 28 (22,4%) мужчин. Все больные были разделены на 2 группы. 1 группа – больные ОКХ, которым проводилось традиционное консервативное лечение до и после операции (49 человек). 2 группа – больные ОКХ, у которых проводилась этиотропная предоперационная антибиотикопрофилактика и рациональная послеоперационная антибиотикотерапия (76 человек).
У пациентов 1 – 2 групп изучались анамнестические данные, проводилось физикальное обследование, выполнялись скрининговые анализы и общепринятые инструментальные методы исследования. Спектр дополнительных методов исследования у пациентов 1 – 2 групп и сроки их выполнения представлены в таблице 1.
Таблица 1
Дополнительные методы исследования у пациентов 1 – 2 групп
|
Методы исследования |
Группа исследования |
Биологический материал |
Сроки забора |
|
ПЦР – идентификация анаэробной микрофлоры |
2 группа |
Кровь |
До начала антибактериальной терапии |
|
2 группа |
Пузырная желчь; биоптат стенки желчного пузыря |
Интраоперационно | |
|
Бактериологический метод |
1 – 2 группы |
Пузырная желчь; биоптат стенки желчного пузыря; желчные конкременты |
Интраоперационно |
Пациенты 1 группы после традиционного консервативного лечения, включающего ограничение приёма пищи, внутривенные инфузии глюкозо-новокаиновой смеси, солевых растворов, внутримышечные инъекции миотропных спазмолитических средств – были оперированы. В зависимости от времени начала заболевания и выраженности клинических проявлений назначалась эмпирическая антибактериальная терапия цефалоспоринами III и IV поколений аминогликозидами или препаратами группы пенициллина. В послеоперационном периоде больные 1 группы получали стандартную консервативную терапию.
Пациенты 2 группы после стандартного консервативного лечения, дополненного селективными спазмолитическими препаратами (мебеверина гидрохлорид по 200 мг 4 раза в день перорально), были оперированы. Предоперационная антимикробная профилактика назначалась с учётом результатов ПЦР, полученных в течение первых суток с момента поступления в стационар. В послеоперационном периоде больные 2 группы получали рациональную антимикробную терапию с учётом результатов ПЦР и бактериологического исследования.
Все пациенты 1 и 2 групп были оперированы по поводу деструктивных форм острого калькулёзного холецистита в экстренном или отсроченном порядке, преимущественно с использованием видеолапароскопии и минилапаротомного доступа.
Результаты собственных исследований и их обсуждение: морфологически диагностированы следующие формы ОКХ: острый обтурационный калькулёзный холецистит (ООКХ) – 31(24,8%), флегмонозный калькулёзный холецистит (ФКХ) – 56(44,8%) и гангренозный калькулёзный холецистит (ГКХ) – 38(30,4%) случаев.
Микробиологическое исследование показало, что высокий процент положительных результатов посевов был получен при ФКХ – 85,7% и ГКХ – 84,2%. При ООКХ высеваемость микроорганизмов составила всего 12,9%. Это свидетельствует о небольшой продолжительности воспалительного процесса в желчном пузыре и отсутствии контаминации данного биотопа.
При ФКХ в монокультурах были выделены из желчи представители семейства Enterobaсteriaceae; в 5 пробах были обнаружены ассоциации микроорганизмов, представленные E. faecium и S. epidermidis, Candida аlbicans и S. epidermidis.
При ООКХ бактериохолия выявлена всего у 4(12,9%) больных, при этом были обнаружены E. coli, E. faecium и Actinomiyces spp.
ГКХ характеризовался выделением из желчи больных E. coli в три раза чаще, чем Enterococcus spp.
Микробный пейзаж биоптатов по качественному и количественному составу почти не отличался от микрофлоры желчи.
Синегнойная палочка чаще всего выделялась при ФКХ – 20%. Спектр микроорганизмов у пациентов с ФКХ включал также стафилококки (20%), в равных долях – E. coli и E. faecium (13,3%); C. аlbicans, K. pneumoniae, Staphylococcus saprophyticus, Moraxella spp. и P. constellatus по 6,6% соответственно.
На поверхности желчных конкрементов значительно чаще обнаруживаются грамположительные кокки, доля которых составила 63,7% (в том числе стафилококки 36,4%, энтерококки 27,3%). По два вида бактерий обнаружены на желчных конкрементах только при ФКХ и представлены ассоциациями P. аeruginosa и S. epidermidis, C. аlbicans и S. epidermidis.
Изучение биоматериалов показало высокую степень общей бактериальной обсеменённости (107 – 108 КОЕ/г) всех образцов при разных гистологических формах ОКХ, но чаще при флегмонозном и гангренозном. Это свидетельствует об этиологической роли выявленных микроорганизмов в развитии воспаления в желчном пузыре.
Наиболее часто культура P. aeruginosa выделялась у больных с ФКХ. При этой форме ЖКБ из содержимого желчного пузыря и его стенки удалось выделить неспорообразующие анаэробные микроорганизмы в монокультуре – Peptococcus constellatus при тяжёлой клинической картине, обусловленной развитием эмпиемы желчного пузыря и местным гнойным перитонитом.
Однако следует отметить, что при подобной клинической симптоматике, обусловленной не только эмпиемой желчного пузыря, но и перитонитом, перивезикальным и шеечным инфильтратом, перивезикальным абсцессом у 48(85,7%) больных при ФКХ и у 38(100%) пациентов при ГКХ анаэробные микроорганизмы не были выявлены.
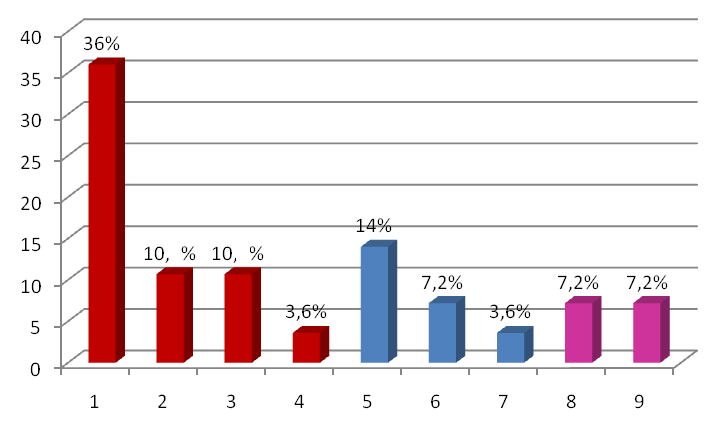
Таким образом, бактериологическое исследование показало, что в исследуемых образцах преобладали представители семейства Enterobacteriaceae (61,0%). Второе место среди всех выделенных культур занимают E. faecium – 14%. Грамположительные кокки также были представлены S. epidermidis – 7,2% и анаэробными кокками P. constellatus – 3,6%. Удельный вес НГОБ Moraxella spp. и Pseudomonas spp. составил 14,4% (рис. 1).
Рис. 1. Спектр микроорганизмов желчного пузыря при остром калькулёзном холецистите
1 – E.coli, 2 – K.pneumoniae, 3 – E.aerogenes, 4 – C.freundii, 5 – E.faecium, 6 – S.epidermidis, 7 – P.constellatus, 8 – Moraxella spp., 9 – Pseudomonas spp.
Желчь, стенка желчного пузыря и желчные конкременты у больных различными формами ОКХ инфицированы преимущественно микрофлорой кишечника. При этом очевидна взаимосвязь между гистологической формой воспалительного процесса в желчном пузыре, спектром и количеством микрофлоры.
При исследовании микрофлоры желчного пузыря методом ПЦР установлено, что при деструктивных формах ОКХ в крови, биоптате стенки желчного пузыря и в желчи обнаруживается ДНК анаэробных микроорганизмов.
Из таблицы 2 видно, что наибольший процент идентифицированных монокультур анаэробных микроорганизмов получен при исследовании пузырной желчи (86,2%) и биоптата стенки желчного пузыря (92,1%). Это является доказательством патогномоничности полученных результатов и свидетельствует об отсутствии ложноположительных результатов идентификации этих микроорганизмов при возможном наличии сопутствующих воспалительных процессов в других органах и системах.
В монокультуре анаэробы идентифицированы всего в 144 (69,6%) образцах.
Таблица 2
Идентифицированные монокультуры анаэробных микроорганизмов
в различных биологических материалах
|
Культуры анаэробных микроорганизмов |
Исследуемые материалы | ||
|
Кровь |
Желчь |
Биоптат | |
|
Bacteroides fragilis |
5(6,6%) |
7(12%) |
11(14,5%) |
|
Bacteroides spp. |
19(25%) |
7(12%) |
14(18,4%) |
|
Porphyromonas spp. |
- |
- |
- |
|
Prevotella melaninogenica |
- |
4(6,9%) |
5(6,6%) |
|
Prevotella spp. |
- |
7(12%) |
7(9,2%) |
|
Fusobactrium spp. |
- |
25(43,1%) |
33(43,4%) |
|
Всего |
24(31,6%) |
50(86,2%)** |
70(92,1%)** |
* – p < 0,05 (при F>1,64)
** – p < 0,01 (при F>2,31)
Микробные ассоциации были представлены в 63 (30,4%) случаях в 6 комбинациях. При сопоставлении результатов идентификации анаэробов с гистологической формой ОКХ установлено, что при обследовании 76 больных 2 группы у 6 (33,3%) больных катаральным холециститом были идентифицированы культуры Bacteroides fragilis, Bacteroides spp. и Fusobacterium spp. При ФКХ у 26 (76,4%) больных был выявлен наиболее разнообразный микробный пейзаж. Таким образом, на первом месте по разнообразию анаэробных микроорганизмов находится флегмонозный, на втором – гангренозный холецистит.
При анализе полученных результатов выявлена взаимосвязь между количеством идентифицированных анаэробов и развитием осложнений ЖКБ. Из 58 больных ФКХ и ГКХ у 47(81%) были выявлены анаэробные микроорганизмы. Именно у этих больных имели место осложнения, представленные в таблице 3.
Во 2 группе было всего 76 больных, из них у 18 (23,7%) диагностирован ООКХ (катаральный холецистит), у 58 (76,3%) больных – ФКХ и ГКХ с осложнениями. Во всех случаях была идентифицирована аэробная, факультативно-анаэробная и анаэробная микрофлора в монокультуре и в ассоциациях (бактериологическим методом и методом ПЦР).
Во 2 группе в 94,8% случаев аэробная микрофлора была диагностирована бактериологическим методом, анаэробная – в 5,2% случаев. Анаэробы были идентифицированы методом ПЦР у 56,9% больных, что достоверно превышает этот показатель по сравнению с бактериологическим методом. Этиологическая роль в развитии осложненных форм желчнокаменной болезни установлена методом ПЦР в 65,5% случаев, что превышает аналогичный показатель при катаральном холецистите.
Таким образом, можно предположить, что при наличии анаэробной инфекции, которая очень часто не диагностируется бактериологическим методом, в большом проценте случаев развиваются деструктивные формы ОКХ и его осложнения (табл. 3).
Таблица 3
Роль анаэробных микроорганизмов в развитии осложнённых форм ЖКБ
|
Культуры анаэробов |
Кол-во случаев иденти-фикации (всего) |
Осложнённые формы ЖКБ (47 больных) | |||||
|
ФКХ, местный перитонит |
ФКХ, эмпиема ЖП, местный перитонит |
ГКХ, местный перитонит |
ГКХ, перивези-кальный инфильтрат |
ГКХ, перивези-кальный абсцесс |
ГКХ, перфорация ЖП, местный перитонит | ||
|
Bacteroides fragilis |
23 (33,1%) |
2 (5,9%) |
- |
2 (8,3%) |
- |
1 (4,16%) |
- |
|
Bacteroides spp. |
40 (55,4%) |
3 (8,8%) |
2 (5,9%) |
2 (8,3%) |
2 (8,3%) |
2 (8,3%) |
- |
|
Prevotella melaninogenica |
9 (13,5%) |
2 (5,9%) |
- |
- |
- |
- |
- |
|
Prevotella spp. |
14 (21,2%) |
3 (8,8%) |
- |
- |
- |
- |
- |
|
Fusobacterium spp. |
58 (86,5%) |
4 (11,8%) |
3 (8,8%) |
2 (8,3%) |
- |
1 (4,16%) |
2 (8,3%) |
|
Bacteroides spp. + Fusobacterium spp. |
22 (34,9%) |
2 (5,9%) |
- |
1 (4,16%) |
- |
1 (4,16%) |
- |
|
Bacteroides fragilis + Prevotella spp. + Bacteroides spp. |
3 (4,8%) |
1 (2,9%) |
- |
- |
- |
- |
- |
|
Bacteroides fragilis + Bacteroides spp. + Prevotella spp. |
13 (20,6%) |
1 (2,9%) |
- |
- |
- |
- |
- |
|
Bacteroides fragilis + Fusobacterium spp. |
7 (11,1%) |
2 (5,9%) |
- |
1 (4,16%) |
1 (4,16%) |
- |
- |
|
Prevotella melaninogenica + Fusobacterium spp. |
11 (17,5%) |
- |
- |
1 (4,16%) |
- |
- |
- |
|
Fusobactrium spp. + Prevotella spp. |
7 (11,1%) |
1 (2,9%) |
- |
1 (4,16%) |
- |
1 (4,16%) |
- |
|
Всего |
- |
26(76,4%) |
21(87,4%) | ||||
Таблица 4
Идентификация возбудителей инфекции при осложнённых формах ОКХ
|
Культуры микроорганизмов |
Метод идентификации возбудителя |
ООКХ |
Осложнённые формы ЖКБ | |
|
Бактериологи-ческий метод |
ПЦР | |||
|
Аэробная микрофлора |
55(94,8%) |
- |
13(72,2%) |
20(34,5%)1 |
|
Анаэробная микрофлора |
3(5,2%) |
33(56,9%)** |
5(27,8%)** |
38(65,5%)** |
1 – осложнённые формы ЖКБ для аэробной микрофлоры: ФКХ, местный перитонит; ГКХ, местный перитонит; ГКХ, перивезикальный инфильтрат. * – p < 0,05 (при F>1,64), ** – p < 0,01 (при F>2,31)
Результаты определения чувствительности выделенных культур к антимикробным препаратам показали, что большинство из них чувствительны к изученным средствам. Среди энтеробактерий резистентность к антимикробным препаратам выявлена только у культур E.coli. При этом 9% штаммов были устойчивы к амикацину и гентамицину, 18% – к спарфлоксацину и ципрофлоксацину.
Штаммы синегнойной палочки были резистентны только к цефоперазону и чувствительны к ампициллину, цефтазидиму, ципрофлоксацину. Штаммы P. putrefaciens были чувствительны ко всем антисинегнойным препаратам.
При определении чувствительности P. constellatus к антимикробным препаратам выявлено, что все выделенные штаммы этого вида устойчивы к метронидазолу – препарату, часто используемому в клинической практике, и чувствительны к остальным изученным препаратам.
Таким образом, большинство штаммов микроорганизмов, выделенных из различных материалов больных ОКХ, чувствительны к изученным антимикробным препаратам, которые включены в формуляр для эмпирической антимикробной химиотерапии при этой патологии.
Во 2 группе при идентификации бактерий в монокультуре, учитывая устойчивость выделенного анаэробного микроорганизма (P. constellatus) к часто применяемому в клинической практике метронидазолу, при деструктивных формах острого холецистита назначались следующие схемы антибактериальной терапии: цефалоспорины III – IVпоколений с аминогликозидами; β-лактамные антибиотики с аминогликозидами или фторхинолоны и аминогликозиды.
При выделении микробных ассоциаций из двух видов культур назначались следующие комбинации: цефалоспорины III – IV поколений или фторхинолоны с аминогликозидами: цефтриаксон+гентамицин – у 1 (33,3%), цефотаксим+гентамицин у 1 (33,3%), спарфлоксацин+амикацин – у 1 (33,3%) пациента.
Как видно из таблицы 5, у больных 2 группы на фоне применения антимикробных химиопрепаратов по результатам определения чувствительности выделенных микроорганизмов по сравнению с 1 группой (15 (30,6%)), был отмечен значительно меньший процент осложнений – 5 (6,6%).
Таблица 5
Послеоперационные осложнения у больных 1 и 2 групп
|
Осложнения после ХЭ |
1-ая группа |
2-ая группа |
|
Общее кол-во больных |
49(100%) |
76(100%) |
|
Открытая ХЭ | ||
|
Количество больных |
5(10,2%) |
7(9,2%) |
|
Серома п/о рубца |
2(40%) |
1(14,3%) |
|
Инфильтрат п/о рубца |
- |
- |
|
Абсцесс п/о рубца |
1(20%) |
- |
|
Серома ложа ЖП |
- |
- |
|
Абсцесс ложа ЖП |
- |
- |
|
Общий % осложнений при открытой ХЭ |
3(60%) |
1(14,3%)* |
|
ХЭ из мини-доступа | ||
|
Количество больных |
17(34,7%) |
23(30,3%) |
|
Серома п/о рубца |
3(17,6%) |
2(8,7%) |
|
Инфильтрат п/о рубца |
2(11,7%) |
1(4,3%) |
|
Абсцесс п/о рубца |
- |
- |
|
Серома ложа ЖП |
2(11,7%) |
- |
|
Абсцесс ложа ЖП |
- |
- |
|
Общий % осложнений при ХЭ из мини-доступа |
7(41%) |
3(13%)* |
|
Лапароскопическая ХЭ | ||
|
Количество больных |
27(55,1%) |
46(60,5%) |
|
Серома п/о рубца |
3(11,1%) |
1(2,2%) |
|
Инфильтрат п/о рубца |
- |
- |
|
Абсцесс п/о рубца |
- |
- |
|
Серома ложа ЖП |
1(3,7%) |
- |
|
Абсцесс ложа ЖП |
1(3,7%) |
- |
|
Общий % осложнений при ЛХЭ |
5(18,5%) |
1(2,2%)** |
|
Общий % осложнений |
15(30,6%) |
5(6,6%)** |
* – p < 0,05 (при F>1,64)
** – p < 0,01 (при F>2,31)
Выводы:
- Микробиологическое исследование у больных острым калькулёзным холециститом позволяет определить спектр микроорганизмов (аэробных, факультативно-анаэробных и анаэробных) и назначать эффективную этиотропную, рациональную антимикробную химиотерапию. Обязательной коррекции с помощью пребиотиков, пробиотиков и синбиотиков требует дисбактериоз, развивающийся у 97% больных после холецистэктомии.
- Одним из ведущих этиологических факторов в развитии деструктивных форм калькулёзного холецистита являются анаэробные микроорганизмы, которые методом полимеразной цепной реакции идентифицированы у 38(65,5%) больных.
- Литература:
- Бородач, А.В. Некоторые патогенетические аспекты хирургического лечения осложненной желчнокаменной болезни / А.В.Бородач, В.А.Бородач, А.Л.Попов. – Новосибирск: Сиб. унив. изд-во, 2008. – 188 с.
- Максименко, В.Б. Нарушения концентрационной и моторно-эвакуаторной функций желчного пузыря при холецистолитиазе / В.Б.Максименко // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. – 2006. – №4. – С. 24-28.
- Малярчук, В.И. Заболевания большого дуоденального сосочка / В.И. Малярчук, Ю.Ф. Пауткин, Н.Ф. Плавунов. – М.: Камерон, 2004. – 167 с.
- Петухов, В.А. Желчнокаменная болезнь и синдром нарушенного пищеварения / В.А. Петухов. – М.: ВЕДИ, 2003. – 128 с.
- Bellows, C.F. Management of gallstones / C.F.Bellows, D.H.Berger, R.A.Crass // Am. Fam Physician. – 2005. – V. 72, №4. – P. 637-642.
- Schirmer, B.D. Cholelithiasis and cholecystitis / B.D.Schirmer, K.L.Winters, R.F.Edlich // J. Long. Term. Eff. Med. Implants. – 2005. – V. 15, №3. – P. 329-338.