Послеоперационное обезболивание на органах грудной клетки, несмотря на многочисленные исследования в этой области, остается актуальной проблемой современной анестезиологии. Известно, что операции на органах грудной клетки являются одним из наиболее травматичных, так как висцеральная и париетальная плевры богаты ноцицептивными рецепторами [1, 3, 8].
После обширных операций на органах грудной полости преобладают легочные нарушения, сопровождающиеся снижением ЖЕЛ, замедлением форсированного выдоха, сокращением амплитуды дыхательного объема [5, 12]. Поэтому сразу после пробуждения больного необходимо добиться эффективной кашли и ранней двигательной активности. Достичь этого можно лишь при адекватной аналгезии [2, 6]. Все это диктует определенные требования, предъявляемые к анестезии при торакальных вмешательствах, которые могут быть сформулированы следующим образом: надежная антиноцицепция, хорошая управляемость газообменом и миорелаксацией, быстрое восстановление сознания и самостоятельного дыхания, высококачественная анальгезия [7].
Более того, в последние годы многими исследованиями доказано, что современные ингаляционные и внутривенные методы общей анестезии не способны полноценно блокировать прохождение ноцицептивных импульсов ни на спинальном, ни на супраспинальном уровне, более того они не предотвращают развития ответной реакции на хирургический стресс [4, 9, 10]. Из этого следует, что сбалансированная анестезия – это фармакологические средства в сочетании с регионарными методиками, воздействующими на физиологические процессы, реализующие ноцицепцию, трансмиссию, модуляцию и перцепцию на базе мультимодальности [3, 10].
Цель нашего исследования заключается в оценке эффективности послеоперационного обезболивания при применении грудной паравертебральной блокады после экстренных оперативных вмешательств у больных с повреждениями грудного каркаса.
Материал и методы обследования.
Обследованы 116 больных, поступивших в РНЦЭМП в экстренном порядке с травматическими повреждениями грудной клетки. Больные разделены на 3 группы в зависимости от применяемого метода анестезии и послеоперационного обезболивания.
Первую группу составили 40 больных, которым по экстренным показаниям проводилось оперативное вмешательство под общей анестезией. Средний возраст больных этой группы составил 37±3,2 года из них 30 мужчин и 10 женщин. Средняя продолжительность оперативного вмешательства в контрольной группе составила 58±8,4 мин. В послеоперационном периоде обезболивание в данной группе осуществлялось введением промедола.
Вторую группу составили 37 пациентов, средний возраст которых составил 38,5±2,4 года, из них 26 мужчин и 11 женщин. Перед индукцией в анестезию производилась интраплевральная аналгезия во втором межреберье с повреждённой стороны местным анестетиком бупивакаином в дозе 50-75 мг. Катетер оставляли в плевральной полости для повторного введения местного анестетика при необходимости и для послеоперационного обезболивания. Аналгетический компонент поддерживался вышеуказанной интраплевральной аналгезией и болюсным введением фентанила. Средняя продолжительность оперативного вмешательства в данной группе составила 65,4±7,6 мин. Послеоперационное обезболивание осуществлялось введением в интраплевральное пространство через катетер местного анестетика бупивакаин, также кетонал в дозе 300 мг в сутки и при необходимости наркотический аналгетик промедол.
Третью группу составили 39 пациентов, средний возраст которых составил 36,8±5,4 года, из них 25 мужчин и 14 женщин. Перед индукцией в анестезию производилась паравертебральная блокада на уровне от Th4 до Th7 c последующей катетеризацией для послеоперационного обезболивания. В паравертебральное пространство вводился местный анестетик бупивакаин в дозе 25 мг на каждый сегмент (в среднем всего 100-125 мг). Дождавшись эффекта от паравертебральной блокады, начиналась индукция в анестезию в/в введением дормикума 0,8 мг/кг, фентанила 3 мкг/кг, кетамина в дозе 1,2 мг/кг. Средняя продолжительность оперативного вмешательства 63,7±8,9 мин, послеоперационное обезболивание проводилось сочетанием паравертебральной блокады бупивакаином в дозе 30-50 мг, также кетонал в дозе 300 мг в сутки и при необходимости добавлялся промедол.
Больным всех групп назначалась стандартная премедикация, состоящая из промедола, димедрола и атропина в общепринятых дозировках. Миоплегия осуществлялась введением аркурония. Во всех группах общая анестезия поддерживалась введением дормикума, кетамина в дозе 0,8-1 мг/кг с целью блокады NMDA рецепторов. ИВЛ проводилась у больных трёх групп по полузакрытому контуру аппаратом «Fabius» (Drager, Германия). Осуществлялся непрерывный мониторинг Ад, ЧСС, ЭКГ с интерпритацией сегмента S-T, SаО2, посредством монитора «Nikon-Kohden» (Япония).
Исследовались показатели кислотно - основного состояния (КОС). Нами также были исследованы следующие показатели центральной и периферической гемодинамики АДс (систолическое артериальное давление), АДд (диастолическое артериальное давление), АДср (среднее артериальное давление), ЧСС (частота сердечных сокращений), МРЛЖ (минутная работа левого желудочка), МОС (минутный объём сердца), СИ (сердечный индекс), ОПСС (общее периферическое сосудистое сопротивление), рассчитанные по следующим формулам:
АДср = АДд + (АДс - АДд) / 3 (1)
МРЛЖ = МОС х АДср х 0,0136 (2)
ОПСС = (АДср х 60 х 1333) / МОС (3)
СИ= МОС/ ПТ (4)
Оценку боли в послеоперационном периоде проводили по визуально-аналоговой шкале (ВАШ). Вышеуказанные исследования были проведены на следующих этапах послеоперационного периода: 1- до начала обезболивания, 2 -через 30 мин после обезболивания, 3- через 2 часа, 4 - через 5 часов.
Также изучали время экстубации у больных трёх групп, время первого требования аналгетика, проводили расчёт использованного в послеоперационном периоде наркотического аналгетика промедол. Характер оперативного вмешательства в трёх группах был практически идентичным:
- торакоскопия с ликвидацией посттравматического гемоторакса- 45 (38,3%);
- торакоскопия с ликвидацией посттравматического пневмоторакса-32 (27,5%);
- торакоскопия с ушиванием разорвавшихся булл- 20 (17,5%);
- миниторакотомия с ушиванием повреждённых участков лёгких-19 (16,6%)
Проведённые нами исследования выявили следующие результаты:
Больные трёх групп поступали в операционную с имеющейся дыхательной недостаточностью, с гипертензией и тахикардией ввиду повреждения каркаса грудной клетки. Превалировал болевой фактор, ограничивающий дыхательную подвижность лёгких. Проведённая премедикация у всех больных полностью не снимала болевого фактора и при поступлении в операционную больные трёх групп ощущали боль равную 7-8 баллам по ВАШ, что соответствует сильной боли.
У всех больных на исходном этапе исследования проявлялись явления респираторного ацидоза с повышением рСО2 и уменьшением О2, что возможно связано с болевым фактором и соответственно ограничением дыхания из-за перелома рёбер. У больных 2 и 3 групп после применения ПВБ и ИПА отмечалась нормализация показателей КОС. Показатели гемодинамики на протяжении всего интраоперационного периода оставались стабильными, чего не скажешь о 1 группе, где оставалась склонность к тахикардии и гипертензии.
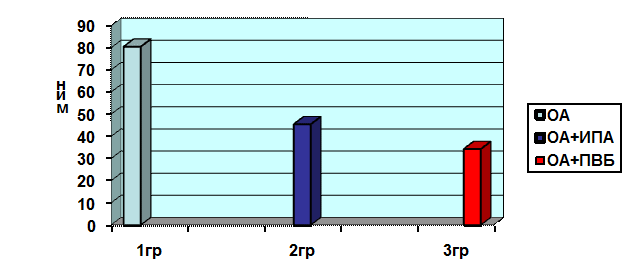
Показатель времени экстубации больных в послеоперационном периоде представлен на рис 1. Время экстубации больных в 1 группе составило 80,5±19,2 мин, что на 43,5% достоверно выше относительно 2 группы, где данный показатель составил 45,5±8,4 мин. В сравнении между 1 и 3 группами, где показатель времени экстубации составил 34,3±7,3 мин, отмечается достоверное повышение вышеуказанного показателя на 57,4 %.
Рис. 1. Время экстубации больных в 3-х группах в мин.
Было интересным сравнение двух групп с применением регионарной анестезии, т. е. 2 и 3. Данное сравнение выявило удлинение времени экстубации у больных 2 группы по сравнению 3 группы на 24,7%, что доказало эффективность ПВБ как аналгетического компонента и сокращения времени пребывания на ИВЛ за счёт меньшего применения наркотических аналгетиков в интраоперационном периоде.
30 % больных 1 группы сразу же после экстубации жаловались на боль с требованием обезболивания. Время первого требования аналгетика (ВПТА) в 1 группе составило 45±11,5 мин, во 2 группе 98,1±8,5* мин, а в 3 группе 150,3±7,9** мин. Отмечается достоверное сокращение ВПТА на 34,7% в 1 группе по сравнению со 2-й группой, и на 70% в сравнении с 3-й группой больных. Сравнивая 2 и 3 группы нами отмечено достоверное удлинение ВПТА в 3 группе, нежели во 2 группе, что доказывало более длительный эффект обезболивания при применении ПВБ. Динамика исследованных нами показателей КОС в послеоперационном периоде не выявило каких либо значимых изменений. Снижавшиеся показатели рО2 и повышавшиеся показатели СО2 изменялись на пике ощущений боли пациентами, но за рамки нормальных величин не выходили.
Показатели гемодинамики, исследованные нами в послеоперационном периоде, были следующими: Показатель АДср до начала обезболивания, и показатель ЧСС соответствовали ощущениям боли пациентами трёх групп по ВАШ. Пациенты 1 и 2 групп ощущали очень сильную боль соответствующую 7-8 баллам, пациенты 3 группы ощущали сильную боль соответствующую 6 баллам по ВАШ. Показатели СИ, МРЛЖ, ОПСС в трёх группах на 1 этапе послеоперационного периода в трёх группах достоверных различий не имели и соответствовали вышеуказанным ощущениям боли пациентами.
Через 30 мин после обезболивания показатели АДср в 1 группе на фоне обезболивания промедолом 20 мг снижались на 12,2%, а ЧСС на 23,5% в сравнении с исходным этапом. Во 2 группе, на фоне сочетания применения интраплеврального обезболивания бупивакаином 50 мг и НПВС кетонала 100 мг, АДср снижалось на 18,1 %, а ЧСС на 25,5%. В 3 группе на фоне применения паравертебральной блокады бупивакаином 50 мг, кетоналом 100 мг АДср снизилось на 19%, ЧСС на 32,2%. Показатель СИ снижался на фоне обезболивания в 1 группе на 23%, во 2 группе на 15,5%, а в 3 группе на 28 % в сравнении с данным показателем на исходном этапе послеоперационного периода. МРЛЖ снижался на 34,4% в 1 группе, во 2 группе на 33,3% и в 3 группе достоверно снижался на 41%. Сравнивая показатель МРЛЖ между 2 и 3 группами на 2 этапе исследования выявлено достоверное снижении этого показателя на 12,3% в 3 группе, что доказывало более лучший эффект обезболивания при применении сочетания НПВС кетонала и ПВБ. Ощущения боли пациентами трёх групп также достоверно изменялись на фоне проводимого обезболивания. На 2 этапе исследования показатель ВАШ в 1 группе снижался на 55,6%, соответствовал слабой боли. Во 2 группе этот показатель адекватности обезболивания достоверно снижался на 73,5% и соответствовал отсутствию боли по ВАШ. В 3 группе вышеуказанный показатель снижался на 82,6% и соответствовал полному отсутствию боли по ВАШ.
Через два часа после обезболивания показатели гемодинамики в трёх группах оставались в пределах нормальных величин, однако имелась некоторая тахикардия в первой группе с соответственным изменением АДср, СИ и МРЛЖ. Показатель МРЛЖ был достоверно выше в 1 группе на 26,8%, по сравнению со 2 группой, и на 37,1% выше по сравнению с 3 группой. СИ на фоне обезболивания достоверно снижался, приближаясь к нормальным величинам во 2 группе на 23%, в 3 группе на 31,4% в сравнении с 1 группой. Таким образом, несмотря на незначительные колебания основных показателей АДс, АДд, ЧСС, показатели центральной гемодинамики СИ и МРЛЖ имели достоверные различия между группами на 3 этапе послеоперационного периода. Что касается показателя ВАШ, то больные 1 группы ощущали боль равносильную 5-6 баллам, что соответствовало умеренной боли по субъективной шкале оценки боли. Больные 2 группы ощущали менее интенсивную боль, которая была достоверно ниже на 22,9% по сравнению с ощущениями пациентов контрольной группы. Пациенты 3 группы на данном этапе послеоперационного периода практически не ощущали боли, и показатели ВАШ в этой группе были на 79% ниже в сравнении с 1 группой. Проведённое сравнение субъективных ощущений боли между пациентами 2 и 3 групп выявило достоверную разницу на 73%. У пациентов 3 группы качество послеоперационного обезболивания было выше и эффективнее, нежели у пациентов 2 группы. 30% больных 2 группы на данном этапе исследования требовали дополнительного обезболивания, и в качестве обезболивающего препарата применялся промедол 20 мг однократно.
Таблица 1. Динамика показателей гемодинамики в послеоперационном периоде
|
Показатели |
До начала обезболивания |
Через 30 мин после обезболивания |
Через 2 часа после обезболивания |
Через 5 часов после обезболивания | |
|
АДс.,.мм.рт.ст.
|
I |
145,2±1,3 |
130,4±1,6* |
135,5±1,4 |
140,5±1,3 |
|
II |
143,2±2,,2 |
125,5±1,7* |
123,5±1,6 |
138,5±1.6** | |
|
III |
142,8±1,9 |
123,3±1,6* |
120,5±1,3 |
118,3±1,2*** | |
|
АДд.,мм.рт.ст |
I |
102,3±1,5 |
88,4±0,4* |
83,3±0,3 |
100,4±1,5 |
|
II |
100,5±1,7 |
78,5±0,6* |
78,4±0,9 |
89.4±0,8** | |
|
III |
98,0±1,5 |
75,4±0,4* |
80,4±0,.2 |
78,5±0,1*** | |
|
АДср.,мм.рт.ст. |
I |
116,6±2,1 |
102,4±1,3* |
100,7±1,5 |
113,3±1,3 |
|
II |
114,8±1,8 |
94,1±1,2* |
93,4±1,6 |
102,7±1,7** | |
|
III |
112,6±1,4 |
91,3±1,5* |
93,7±0,9 |
91,8±1,1*** | |
|
ЧСС., в мин
|
I |
118,3±2,5 |
90,5±0,9* |
89,5±0,8 |
110,3±0,9 |
|
II |
118,5±1,4 |
88,3±0,4* |
82,2±0,6 |
100,4±1,4** | |
|
III |
115,5±1,6 |
78,4±1,2* |
78,8±0,1 |
85,5±0,8*** | |
|
СИ,мл/мин/м2
|
I |
3,5±0,03 |
2,2±0.01* |
3,2±0,03 |
3,1±0,02 |
|
II |
3,5±0,02 |
3,0±0,01* |
2,5±0,01** |
3,5±0,03 | |
|
III |
3,6±0,02 |
2,6±0,01* |
2,2±0,01** |
2,4±0,02*** | |
|
МРЛЖ, кгм/м2 |
I |
8,1±0,5 |
5,4±0,03* |
6,3±0,1 |
6,7±0,09 |
|
II |
7,9±0,8 |
5,3±0,9* |
4,6±0,08** |
6,8±0,04 | |
|
III |
7,8±0,4 |
4,6±0,05 * |
4,0±0,05** |
4,2±0,08*** | |
|
ОПССдин.см.-5 |
I |
1156,0±21,2 |
2154,2±18,7* |
1723,9±17,8 |
2059,4±22,1 |
|
II |
1802,1±18,7 |
1813,4±17,3 |
2364,1±17,5 |
1666,2±13,3** | |
|
III |
1748,0±15,6 |
1944,3±16,2* |
2371,7±14,3 |
2157,6±23,1*** | |
* р<0,05 в сравнении с исходным этапом
**р<0,05 в сравнении с контрольной группой
*** р<0,05 в сравнении 2 и 3 групп между собой
На 4 этапе исследования пациенты 1 и 2 групп ощущали боль, равную 7-8 баллам по ВАШ - это соответствовало очень сильной боли, тогда как пациенты 3 группы практически не ощущали боли. Показатели гемодинамики изменялись соответственно ощущениям боли. ЧСС в 1 группе было на 22,5% выше, АД ср на 19% выше относительно 3 группы, а сравнение этих же показателей между 2 и 3 группами выявило разницу в 15 %. Несмотря на хороший аналгетический эффект ИПА, длительность обезболивания при применении этого метода ниже, чем при применении ПВБ. Это связано со смешиванием местного анестетика, введённого в плевральное пространство с серозной жидкостью, выделяемой плеврой, в результате чего концентрация местного анестетика уменьшается, а действие укорачивается. Также, наличие дренажной трубки способствует вытеканию местного анестетика из плевральной полости вместе с экссудатом.
Показатель МРЛЖ, характеризующий минутную
производительность сердца, повышался на 38,3 % в 1 и 2 группах, ОПСС
повышалось на 22,8% в 1 и 2 группах, что соответствовало ощущениям
боли пациентами 1 и 2 групп, тогда как пациенты 3 группы практически
не ощущали боли и показатели гемодинамики оставались в пределах
нормальных величин. Данные субъективной оценки боли по ВАШ
представлена в рисунке 2.
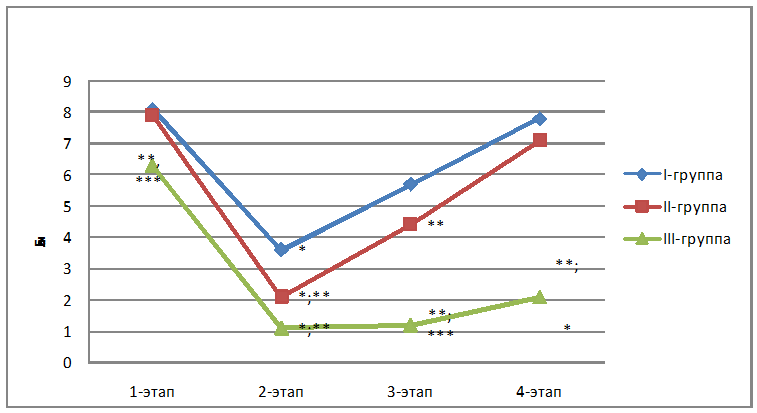
Рис. 2. Оценка боли по ВАШ в послеоперационном периоде
* р<0,05 в сравнении с исходным этапом
**р<0,05 в сравнении с контрольной группой
*** р<0,05 в сравнении 2 и 3 групп между собой
Общий расход препаратов, использованный для послеоперационного обезболивания в послеоперационном периоде в 3-х группах представлен в таблице 2. Как видно из таблицы, расход наркотического аналгетика в группе с применением регионарных блокад значительно меньше. На фоне интраплевральной аналгезии бупивакаином, количество потребляемого наркотического аналгетика промедол достоверно снижалось на 57,2%., тогда как сочетание применения паравертебральной блокады бупивакаином и кетонала достоверно снижало потребление промедола на 85,8%. При сравнении 2 и 3 групп, где примененялось сочетание регионарных блокад с НПВС, отмечается достоверное снижение использования промедола в 3 группе на 66,7%.
Таблица 2
Общий расход препаратов для послеоперационного обезболивания в 3-х группах
|
Название препарата |
I группа Наркотик |
II группа ИПА+НПВС+ наркотик (по необходимости) |
III группа ПВБ+НПВС+ наркотик (по необходимости) | ||||||
|
1-сут |
2-сут |
3-сут |
1-сут |
2-сут |
3-сут |
1-сут |
2-сут |
3-сут | |
|
Промедол 2%, мг |
60 |
40 |
40 |
40 |
20 |
------- |
20 |
----- |
----- |
|
Кетонал, мг |
---- |
---- |
---- |
300 |
300 |
300 |
300 |
300 |
300 |
|
Бупивакаин 0,25%, мг |
----- |
---- |
----- |
150 |
150 |
150 |
150 |
150 |
150 |
Заключение
В послеоперационном периоде мультимодальный подход к обезболиванию с воздействием на все звенья патогенеза боли (перцепция, трансдукция, трансмиссия) способствует гладкому течению, проявляющегося стабильностью гемодинамических показателей, меньшим ощущением боли, снижением потребления промедола на 57,2 % в группе с применением ИПА, тогда как в группе с применением ПВБ на 85,8%. Также, проведённое нами сравнение эффективности ИПА и ПВБ выявило более длительный обезболивающий эффект с минимальным напряжением гемодинамики и лучшей нейровегетативной защитой у пациентов с применением ПВБ. Что касается экономического эффекта, то применение ПВБ позволяет значительно сократить применение наркотических аналгетиков.
Литература:
- Волчков В.А, Игнатов Ю.Д., Страшнов В.И. Болевые синдромы в анестезиологии и
- реаниматологии. М 2006; 166-186.
- Дж. Эдвард Морган-мл., Мэгид С. Михаил М. Клиническая анестезиология: книга 1-я M 2004; 301-314.
- Зильбер А.П., Мальцев В.В. Регионарная анестезия. М 2007; 100-111.
- Малрой. М. Местная анестезия. М 2003; 97-119, 126-140.
- Овечкин А.М. Профилактика послеоперационного болевого синдрома: патогенетические основы и клиническое применение: Автореф дисс…. д.м.н. М 2000.
- Светлов В.А., Зайцев А.Ю., Козлов С.П. Сбалансированная анестезия на основе регионарных блокад:стратегия и тактика. Анест и реаниматол 2006; 4: 4-12.
- Bimston DN., McGee JP., Lip tay MJ., Fry WA. Continuous paravertebral extrapleural infusion for post-thoracotomy pain management. Surg. 1999; 126: 650-6.
- Giesecke К., Hamberger В., Jarnberg PO., Klingstedt C. Paravertebral block during cholecystectomy: effects on circulatory and hormonal responses. Br J Anaesth 1998; 61: 652.
- Gilbert J., Hultman J. Thoracic paravertebral block: a method of pain control. Acta Anaesthesiol Scand 1998; 33:142.
- Detterbeck F.C. Efficacy of methods of intercostals nerve blockade for pain relief after thoracotomy. Ann. Thorac. Surg. 2005 Oct; 80 (4): 1550-1559.