Важной формой зоосоциального поведения у животных разных видов, имеющая приспособительное значение и проявляющаяся видоспецифическим набором поведенческих реакций, является агрессивность.
Известно, что в стрессорную реакцию организма почти всегда вовлекаются органы пищеварения. Но особенности функционирования органов пищеварения в зависимости от поведенческой характеристики организма изучены недостаточно ни в норме, ни при стрессе.
Актуальностью работы явилось выяснение функционального состояния тонкой кишки у крыс из неагрессивной группы при стрессе под влиянием транквилизатора феназепама.
Цель работы: изучение влияния феназепама на активность и топографию энтеральных ферментов у крыс из неагрессивной группы в условиях иммобилизационного стресса.
Материалы иметоды. Эксперименты проводились на взрослых беспородных крысах с массой тела 180–200г. Использовались три группы крыс — смешанная (животные не проверялись на агрессивность), неагрессивная и агрессивная группы.
Животные проверялись на агрессивность по методике А. Л. Рылова (1983); раздражителем являлись электрические импульсы, каждый из которых предъявлялся животным чертырехкратно. Величина агрессивности, связанная с болью, оценивалась по показателю «средней бальности схваток», возникших в ответ на серию из 88 импульсов и количества схваток из 88 возможных. Агрессивными крысами считаются те, у которых «средняя бальность схваток» находится в пределах от 45,6 до 39,7. У крыс со средней агрессивностью этот показатель колеблется от 38,8 до 33,4. У неагрессивных особей он составляет 32,6–0. Иммобилизационный стресс вызвали у крыс путем принудительной иммобилизации в течении 24 часов.
Феназепам вводили перорально с профилактической целью за 30 минут до стресса в дозе 2мг/кг. В качестве контроля использовали крыс с соответствующей типологической характеристикой, которым перорально вводили эквивалентное количество дистиллированной воды. Массу слизистой определяли обычным взвешиванием.
Активность пищеварительных ферментов определялась по следующим методикам: моноглицеридлипазы — методом А. М. Уголева и М. Ю. Черняховской (1969), глицил-1-лейцин-дипептидгидролазы — методом А. М. Уголева и Н. М. Тимофеевой (1969), амилазы — методом Смит — Роя в модификации А. М. Уголева (1969); сахаразы — методом Heleon в модификации А. М. Уголева и Н. Н. Иезуитовой (1969), лактазы — методом Dalhqvist (1968).
Активность ферментов рассчитывалась на 1г массы сырой ткани слизистой оболочки тонкой кишки и выражалась в мг/мин/г для амилазы и в мкмоль/мин/г для остальных ферментов.
Статистическая обработка данных проводилась методом Стьюдента-Фишера.
Результаты исследований. В этой серии экспериментов контролем служили интактные крысы из неагрессивной группы.
Неагрессивные крысы удовлетворительно переносили 24-часовую иммобилизацию, летальных исходов не было.
Масса слизистой оболочки уменьшилась через 6 ч после иммобилизации вдоль всей кишки примерно в 1,5 раза, через 24 ч и далее показатель возвращался к уровню контроля.
В гомогенате слизистой оболочки, снятой вдоль всей тонкой кишки, активность моноглицеридлипазы ингибировалась в 1,5; 2,2; 2,2 раза через 6, 24, 48 ч после стресса (табл.)
Таблица 1
Активность моноглицеридлипазы (мкмоль/мин/г) вгомогенате слизистой оболочки, снятой вдоль всей тонкой кишки при иммобилизационном стрессе ипри стрессе на фоне феназепама укрыс из неагрессивной группы (М +m, n=6)
|
Условия эксперимента |
Время вчасах после стресса | ||
|
6 часов |
24 часа |
48 часов | |
|
Интактные крысы (контроль) |
5,7 + 0,2 |
5,7 + 0,2 |
5,8 + 0,2 |
|
Иммобилизационный стресс |
3,7 + 0,2 Р<0.05 |
2.6 + 0.2 Р<0.01 |
2.4 + 0.1 Р<0.01 |
|
Иммобилизационный стресс на фоне феназепама |
2.7 + 0.2 Р<0.01 |
4.1 + 0.3 Р<0.05 |
6.0 + 0.3 Р<0.1 |
Активность дипептидгидролазы увеличивалась через 6, 24, 48, ч в 1,5; 1,6 и 2,2 раза.
Активность амилазы снижалась на протяжении всего эксперимента: через 6ч в 2,2 раза, 24ч — в 2,4 раза, 48ч — в 1,7 раза.
Сахаразная активность определялась повышенной в 2,3; 2,5; 2,7 раза через 6, 24, 48 ч после иммобилизации.
Активность лактазы ингибировалась в 2,2 раза через 6ч, в дальнейшем не отличалась от контроля.
Топография ферментов у взрослых крыс из неагрессивной группы после иммобилизации изменилась, при этом прослеживалась выраженная тенденция к смещению пиков активности ферментов в каудальном направлении.
Моноглицеридлипазная активность через 6ч и 24ч понижалась в двенадцатиперстной кишке и проксимальном отделе, оставалась на уровне контроля в медиальном отделе, поэтому её градиент изменился. Через 48ч показатель нормализовался в трёх верхних отделах, и увеличивался в дистальных.
Активность дипептидгидролазы через 6, 24,48ч понижалась в двенадцатиперстной кишке, оставалась на уровне контроля в проксимальном и медиальном отделах и повышалась в дистальном отделе, что также привело к смещению градиента в каудальном направлении (рис.).
Амилолитическая активность снижалась через 6ч и 24ч в двенадцатиперстной кишке и проксимальном отделе, оставалась в пределах нормы в медиальном отделе и повышалась в дистальном. Через 48 ч после иммобилизации топография активности фермента не отличалась от контроля.
Сахаразная активность индуцировалась на протяжении всего опыта на всех участках кишки, но особенно сильно в дистальном отделе, поэтому имело место смещение максимума её активности в дистальном направлении.
Активность лактазы во все сроки после стресса не отличалась от контроля на всех участках кишки и топография её не изменялась.
Превентивное введение феназепама до стресса животным этой группы оказало примерно такой же нивелирующий эффект на изученные показатели, как и в смешанной группе животных, т. е. на фоне транквилизатора функциональное состояние тонкого кишечника практически полностью нормализовалось через 48ч. Это касалось активности ферментов в гомогенате слизистой, снятой вдоль всей тонкой кишки (табл.), топографии энзиматических активностей (рис.). Масса слизистой оболочки не отличалась от контроля.
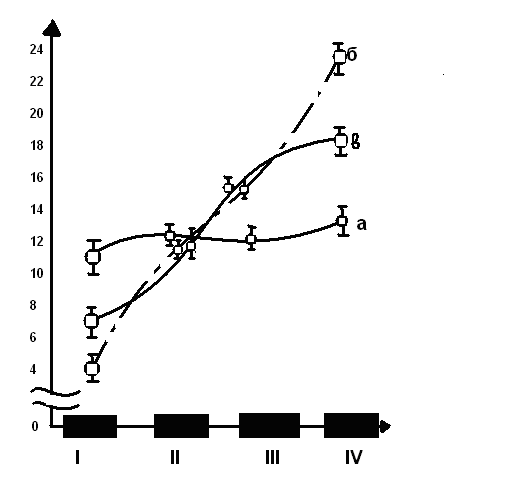
Рис. 1. Распределение активности дипептидгидролазы вдоль тонкой кишки через 24 часа после иммобилизационного стресса и после стресса на фоне феназепама
Ось ординат:
а — интактные крысы (контроль)
б- иммобилизация
в — иммобилизация на фоне феназепама
Ось абсцисс:
I-двенадцатиперстная отдел,
II-проксимальный отдел,
III-медиальный отдел,
IV-дистальный отдел
Выводы:
- Иммобилизационный стресс по-разному влияет на функционально-морфологические показатели тонкой кишки в зависимости от поведенческих особенностей крыс.
- Стресс не вызывает гибели особей из смешанной группы;
- Топография всех ферментативных активностей изменяется, в основном, за счет смещения их максимума в дистальный сегмент.
- Характерным является снижение массы слизистой оболочки по всем участкам тонкой кишки.
Литература:
- Cox T. Stress, coping and problem solving // Work and stress. — N1 — P.5–14
- Palmour R. M. Genetic models for study of aggressive behavior || Progr. Neuropsychopharmacolandboil. Psychiatr — 2002 — V7 –P.573–576
- Уголев А. М. Физиология и патология пристеночного (контактного) пищеварения. — С — Пб. Наука, 2001, — 230с.
- Фурдуй Ф. И. Современные представления о физиологических механизмах развития стресса — Кишинев, 2001 — С. 8–33.

