Вработе исследовались ионогенные ПАВ на примере натрия олеата. В качестве метода исследования был выбран термический анализ. Определена точка Крафта. Показана возможность применения термического анализа для изучения мицеллообразования ионных ПАВ.
Ключевые слова: мицелообразование, термический анализ, поверхностно активное вещество, точка Крафта.
Некоторые органические материалы при переходе из жидкого состояния в твёрдое имеют промежуточную структуру. Вещество в таком состоянии называется жидким кристаллом (ЖК). Оно обладает свойствами как жидкости (текучестью), так и твердого кристалла (анизотропией свойств) [1].
Расположение молекул в жидких кристаллах изменяется под действием таких факторов, как температура, давление, электрические и магнитные поля. Изменения же расположения молекул приводят к изменению оптических свойств (цвет, прозрачность и способность к вращению плоскости поляризации проходящего света). На всем этом основаны многочисленные применения жидких кристаллов [2].
Зависимость цвета ЖК от температуры используется для медицинской диагностики. Нанося на тело пациента некоторые жидкокристаллические материалы, врач может легко выявлять затронутые болезнью ткани по изменению цвета в тех местах, где эти ткани выделяют повышенные количества тепла.
Лиотропные жидкие кристаллы образуются при растворении ряда веществ, таких как, водные растворы мыл, полипептидов, полисахаридов, липидов в определенных интервалах концентраций и температур, структура меняется при нагревании. Структурными единицами лиотропных жидких кристаллов являются не молекулы, а молекулярные комплексы — мицеллы. Растворы поверхностно-активных веществ (ПАВ), содержащих в углеводородном радикале не менее восьми атомов углерода, при больших концентрациях (больших некоторой критической величины (ККМ)), приобретают свойства коллоидных систем.
Мицеллообразование ионных ПАВ происходит в определенном для каждого ПАВ интервале температур, выше некоторого критического значения, так называемой точки Крафта.
Подобные исследования позволят создать новые лекарственные формы, на основе уже известных лекарственных веществ [3–6], а так же по новому подойти к исследованию таких ПАВ как спирты [7] и аминокислоты [8–9], использованию их в фармации и медицине [10]. В дальнейшем эти методы можно будет использовать для исследования белковых систем [11–16].
Известно ряд способов определения ККМ, основные из них: построение изотерм поверхностного натяжения; измерение удельной и молярной электрической проводимости; измерение вязкости, мутности, коэффициента диффузии.
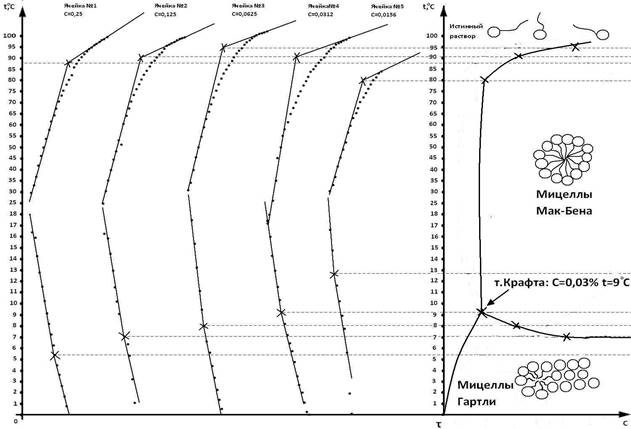
Рис. 1. Зависимость температуры растворов натрия олеата различной концентрации от времени охлаждения (нагревания) системы. Диаграмма состояния раствора натрия олеата. Точка Крафта: С=0,030 %, t=9ºC
Фазовая теория мицеллообразования иогенных ПАВ основана на возникновении новой фазы в системе вода-иогенное ПАВ [17–18]. Изучение зависимости температуры фазового перехода, растворимости и других свойств от состава системы, проводится при помощи метода термического анализа. В основе метода термического анализа лежит исследование скорости изменения температуры системы по мере ее охлаждения или нагревания [19–20].
Температуру, приготовленных растворов ПАВ различной концентрации измеряли с помощью электронных термометров. Нагревание и охлаждение растворов ПАВ проводили с помощью термоблока ПЭ-4020 и холодильника [19]. В качестве ионогенного ПАВ использовался олеат натрия.
По построенным графикам зависимости температуры систем от времени (t) в ходе охлаждения (нагревания), так называемым кривым охлаждения (рис. 1), находили точки излома. Далее определяли соответствующие им температуры начала фазового перехода, то есть образование сферических мицелл (мицелл Гартли) и перехода их в пластинчатые мицеллы (мицеллы Мак-Бэна).
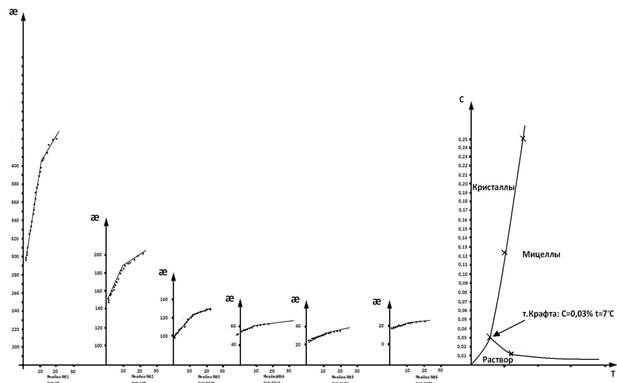
Рис. 2. Зависимость удельной электропроводности растворов натрия олеата различной концентрации от температуры при охлаждении (нагревании) системы. Диаграмма состояния раствора натрия олеата. Точка Крафта: С=0,030 %, t=7ºC
На основании экспериментальных данных строили диаграмму состояния системы вода — иогенный ПАВ, откладывая по оси ординат, температуры фазового перехода растворов ПАВ различной концентрации, а по оси абсцисс — состав смесей.
Параллельно с этими измерениями точка Крафта также была определена методом с использованием удельной электропроводности. В этом случаи строили диаграмму состояния системы вода — иогенный ПАВ, откладывая по оси ординат — состав смесей, а по оси абсцисс температуры фазового перехода растворов ПАВ различной концентрации. Диаграмма представлена на рис.2.
По полученным фазовым диаграммам растворов иогенного ПАВ (натрия олеата) определены области ионных и мицеллярных растворов, а также при низких температурах — область гидратированного твердого ПАВ (набухший гель) и точка Крафта: С=0,030 %, t=9ºC и С=0,030 %, t=7ºC. Точка Крафта не совпадает с температурой плавления твердого ПАВ и лежит ниже, так как в набухшем геле ПАВ гидратировано и это облегчает плавление. На примере натрия олеата показана возможность применения термического анализа для изучения мицеллообразования ионных ПАВ.
Литература:
1. Капустин А. П. Экспериментальное исследование жидких кристаллов./ А. П. Капустин — М.: Наука, 1978–368с.
2. Жданова С. И. Жидкие кристаллы./ С. И. Жданова — М.: Химия, 1979. — 328с.
3. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С., Зарембо В. И. Фазовый переход пар — кристалл при синтезе пленок парацетамола методом вакуумного испарения и конденсации. // Журнал технической физики.. 2014. Т.84. № 3. С.141–143.
4. Беляев А. П., Рубец В. П., Антипов В. В., Рыбников А. О., Беляева С. А. Кристаллизация парацетамола ромбической формы. // Бутлеровские сообщения. 2014. Т.37. № 3. С.113–119.
5. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С. Фазовые превращения при формировании кристаллов парацетамола из паровой фазы. // Журнал технической физики. 2014. Т. 84. № 7. С. 156–158.
6. Беляев А. П., Рубец В. П., Антипов В. В., Бордей Н. С. О механизме начальной стадии образования наноструктур в условиях сверхнизких температур.// Наносистемы: физика, химия, математика. 2012. Т. 3. № 5. С. 103–110.
7. Кучук В. И., Широкова И. Ю., Голикова Е. В. Физико-химические свойства водно-спиртовых смесей гомологического ряда низших алифатических спиртов. // Физика и химия стекла. 2012. Т. 38. № 5. С. 625–633.
8. Dmitrieva I. B., Chukhno A. S., Rodionova E. Y.,. Novichkov R. V.. Specific Adsorption of Aspartic Acid on Iron (III) and Nickel (II) Oxides.// Eurasian Chemico-Technological Journal. 2012. Т. 14. № 4. С. 299–304.
9. Дмитриева И.Б., Чухно А.С., Новичков Р. В.. Взаимодействие глицина с катионами железа(III) и никеля(II) в водных растворах и на поверхности их оксидов. // Бутлеровские сообщения. 2013. Т.35. № 8. С.133–137.
10. Бобров А. П., Маслов В. В., Ткаченко Т. Б., Воронина Д. В., Гришин В. В., Тефц С. Н. Сравнительная оценка действия поверхностно-активных веществ на изменение кинетических параметров агрегации тромбоцитов.// Институт стоматологии. 2010. Т. 3. № 48. С. 80–81.
11. Чухно А. С., Дмитриева И. Б., Мартынов Д. В.. Изоэлектрическая точка белков в водных растворах азолов. // Вестник СПбГУ. 2011. Серия 4: Физика. Химия. Вып. 2. С.124–133.
12. Чухно А. С., Дмитриева И. Б., Колодеева С. С., Мартынов Д. В.. Адсорбция ионов Н+ и ОН- на коллагене. // Вестник СПбГУ. 2011. Серия 4: Физика. Химия. Вып. 3. С. 87–95.
13. Чухно А.С., Дмитриева И.Б., Банкина А.Н., Бриллиантова Е.Ю. Изучение взаимодействия белков с биологически активными азотсодержащими гетероциклическими соединениями при различных значениях pH. // Бутлеровские сообщения. 2013. Т.34. № 5. С.91–99.
14. Чухно А. С., Банкина А. Н., Бриллиантова Е. Ю.. Кинетика процесса набухания желатины в водных растворах азолов. // Бутлеровские сообщения.- 2014. — Т.38. № 5. С.84–88.
15. Men'shikova A.Yu., Skurkis Yu.O., Kuchuk V. I., Dmitrieva I. B., Evseeva T. G., Shabsel's B. M. Effect of the surface structure of poly(styrene-co-acrolein) microspheres and its modification by protein on electrosurface properties. // Коллоидный журнал. 2001. Т. 63. № 5. С. 629–636.
16. Кергенцев А. А., Дмитриева И. Б., Чухно А. С. Определение точки нулевого заряда молекул альбумина в водных дисперсиях при различных концентрациях хлорида калия. // Молодой ученый. 2014. № 18. С. 123–126.
17. Воюцкий С. С. Курс коллоидной химии./ С. С. Воюцкий — М.: Химия, 1975. — 511с.
18. Беляев А. П. Физическая и коллоидная химия / Беляев А. П., Кучук В. И. / под.ред. А. П. Беляева. — 2-ое изд., перераб. и доп. — М., 2012.-752с.
19. Бугреева Е. В., Евстратова К. И., Купина Н. А., и др., Практикум по физической и коллоидной химии./ под ред. проф. К. И. Евстратовой — М.:Высшая школа, 1990. — 255с.
20. Беляев А. П., Скворцов А. М., Кучук В. И., Дмитриева И. Б., Бахолдина Л. А., Чухно А. С., Гришин В. В., Купина Н. А., Малахова Е. Е.. Физическая и коллоидная химия. Руководство к практическим занятиям: учебное пособие. / Под ред. проф. А. П. Беляева. — М.: ГЭОТАР-Медиа, 2012. — 320 с.

