Статистическая физика и термодинамика, молекулярно-кинетическая теория. Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул как наименьших частиц химического вещества. Существует два способа для того, чтобы описать процессы, которые происходят в макроскопических телах, т. е. телах, которые состоят из очень большого числа частиц — атомов и молекул, — называются статистическим и термодинамическим процессом. Статистическая физика изучает раздел физики, который посвящен, глубокому изучению свойств макроскопических тел, исходя из свойств образующих тело частиц и взаимодействий между ними. В качестве примера мы возьмем один кубический сантиметр газа при комнатной температуре и атмосферном давлении. В одном кубическом сантиметре содержится 3*1019 молекул. Казалось бы, что, зная положение и скорость всех молекул в некоторый начальный момент времени, нам можно определить с помощью законов механики, положение и скорость каждой молекулы, а следовательно, и состояние газа в последующие моменты времени. Однако для детального описания совокупности молекул, образующих газ, потребовалось бы нам написать, а затем решить около 1020 уравнений движения. Если даже затратить время на написание уравнения только одну секунду, то лишь на написание уравнений без их решения, нам потребовалось бы время в 300 раз превышающее возраст нашей Вселенной. Допустим, что, если даже мы решим задачу и получим для каждого момента времени 1020 точных значений координат и 1020 точных значений компонент скоростей молекул. Статистическая физика изучает статистические закономерности. Она используется вероятностными методами и истолковывает свойства тел, которые наблюдались на опыте таких, как давление и температура.
Термодинамика изучает свойства макроскопических тел и протекающие в них процессы, не вдаваясь в микроскопическую природу тел. В отличие от статистической физики, термодинамика позволяет делать ряд выводов относительно их протекания. В основе термодинамики лежит небольшое число фундаментальных законов, которые называются началом термодинамики, установленные путем обобщения очень большого количества опытных фактов. По этой причине результаты, получаемые термодинамикой, имеют весьма общий характер.
Состояние термодинамической системы и ее процессы. Термодинамическая система — это совокупность макроскопических тел, которые могут обмениваться энергией меду собой и с внешней средой, а также с другими телами. Например: жидкость и находящийся в соприкосновении с ней пар или газ. Термодинамическая система может находиться в различных состояниях, она отличается температурой, давлением, а также объемом и плотностью. Подобные величины, которые характеризуют состояние системы — это параметры состояния. Параметры состояния не всегда имеют определенные значения. Например: у тела, подогреваемого с другой стороны и охлаждаемого с другой. Температура в разных точках будет разной, поэтому точное значение температуры мы не можем записать. Состояние, в котором хотя бы один параметр точного значения, называется неравновесным. Состояние термодинамической системы равновесное тогда, когда все параметры состояния имеют определенные значения, не изменяющиеся с течением времени. Термодинамические системы, которые не обмениваются с внешней средой ни энергией, ни веществом, называют изолированными или замкнутыми. Существует некий процесс, который называется процессом релаксации. Процесс релаксации это то, когда система переходит с неравновесного состояния в равновесное состояние. С латинского (relaxation) означает уменьшение, ослабление напряжения. Время, за которое первоначальное отклонение какой — либо величины уменьшается в е раз, называется временем релаксации. Поясню сказанное примером. Допустим, нам дан теплоизолированный цилиндрический сосуд, в нем находится газ равновесного состояния. Давление газа равно p, температура Т. Вдвинем поршень резко на небольшое расстояние и сразу вернем в исходное положение. Равновесие газа будет нарушено. Давление возрастет, предположим, равное 272 Па, а температура также возрастет и примет значение 0,272 К. После вращения поршня начнется процесс релаксации.
Термодинамический процесс — это переход системы с одного состояния в другое. Такой переход всегда связан с нарушением равновесия системы. Допустим, для уменьшения объема газа, нужно вдвинуть поршень. При этом газ сожмется и повысится давление, при этом будет нарушено равновесие поршня. Равновесный процесс — это, когда состояние газа все время будет в равновесном состоянии. Бесконечно медленный процесс — это медленный процесс, когда реакции протекают медленно и значения параметров равновесного процесса пренебрежимо малы. Равновесные процессы называются также обратимыми процессами. Когда тело возвращается в исходное положение — это называется циклом.
Молекулярно-кинетические представления. Согласно молекулярно-кинетическим представлениям любое тело, находящееся в 3-х состояниях, твердом, жидком и газообразном состоит из мельчайших частиц, называемых молекулами. Молекулы находятся в беспорядочном, хаотичном движении, их интенсивность зависит от температуры тела. Поэтому, такое движение называется тепловым движением. Доказательством теплового движения служит броуновское движение, которое открыл знаменитый английский ботаник Роберт Браун (1773–1858). В 1827 году он обнаружил беспорядочное движение видимых в микроскоп твердых частиц, которые находились в жидкости. Это движение названо броуновским, потому что молекулы находятся всегда в беспорядочном движении. Также знаменитый, великий русский ученый Михаил Васильевич Ломоносов (1711–1765). Он довел идею об атомическом строении вещества, которая была идеей древних греков. Он видел причину тепла во вращательном движении частиц тела. Таким образом, были сформулированы молекулярно-кинетические представления. Характеристики относительной атомной и молекулярной относительной массы веществ. Относительная атомная масса (Аr) химического элемента называется отношения массы атома этого элемента к 1/12 массы атома углерода. Относительной молекулярной массой (Mr) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома углерода. Из них определения следуют, что атомная и молекулярная массы — это безразмерные величины. Масса, равная 1/12 массы атома углерода, называется атомной единицей массы. Кроме того, число частиц, которые содержатся в моле вещества, называется постоянной Авогадро. Обозначается NA= 6.022*1023 моль-1. Формулы для определения молярной массы, постоянной Авогадро, массы молекул, количества вещества. Формулы по которым можно найти определения ниже приведенные мною:
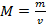 — формула молярной массы, где m0 — это масса молекулы, v — это количество вещества. Формула массы молекулы приведена ниже
— формула молярной массы, где m0 — это масса молекулы, v — это количество вещества. Формула массы молекулы приведена ниже 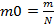 , где N — это число молекул вещества. Молярную массу вещества, можно выразить через массу молекулы вещества: M=m0NA. Количество вещества, можно найти по формуле v=
, где N — это число молекул вещества. Молярную массу вещества, можно выразить через массу молекулы вещества: M=m0NA. Количество вещества, можно найти по формуле v= 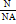 .
.
Внутренняя энергия. Одним из основных законов физики является закон сохранения энергии. При любых процессах в изолированной термодинамической системе внутренняя энергия остается неизменной. Внутренняя энергия — это сумма потенциальной энергии взаимодействия частиц, составляющих тело и кинетической энергии и их беспорядочного движения. Например, внутренняя энергия идеального газа вычисляется так:
U = v NA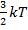
Для того чтобы вычислить внутреннюю энергию одноатомного газа нужно подставить уравнение идеального газа:
U =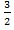 p V
p V
Таким образом, внутренняя энергия идеального газа прямо пропорциональна произведению давления p на объем V, занимаемый газом. Существует два способа изменения внутренней энергии — теплопередача и совершение механической работы. Сумма изменений внутренней энергии равно 0. Потому что работа и количество теплоты, отрицательные.
U = Q+A.
Это выражение закона сохранения энергии и превращения энергии называется первым законом термодинамики, а если работы равны по значению, но противоположны по знаку, то первый закон будет иметь такое выражение:
U = Q — A
В неизолированной термодинамической системе изменение внутренней энергии равно разности полученным количеством теплоты и работой, которую совершает система.
Вывод: Таким образом, при помощи молекулярно-кинетической теории, мы можем узнать, из какого количества состоит тело, узнать строение молекул и атомов. Мы можем найти массу атома, любого химического элемента, вещества. Благодаря процессам определить температуру, состояние вещества. Кроме того узнали о том, что в каком то 1 см3, содержится 3*1019 степени молекул. Узнали о том, что означает каждый процесс, молекулярно-кинетической теории. По каким формулам, можно найти количества вещества, массу молекулы и молярную массу вещества. Все мы это узнали в Разделе молекулярно-кинетической теории. Узнали о том, что такое внутренняя энергия, что она представляет, по каким формулам можно найти внутреннюю энергию и на какие законы она делится и правильно определяется. Если бы мы не знали о молекулярно-кинетической теории, и их не открыли наши знаменитые ученые, мы бы не имели представления о молекулах, атомах, не могли бы посчитать также массу молекулы и атома, их количество. Сейчас мы имеем представления о молекулярно-кинетической теории и внутренней энергии. Научимся решать задачи по молекулярно-кинетической теории и внутренней энергии. Под микроскопом узнаем о строении молекул и атомов. Благодаря, нашим знаменитым ученым, мы имеем представление о молекулярно-кинетической теории и внутренней энергии
Литература:
1. Кабардин О. Ф. справочные материалы, 1988 год. [70, 72, 71, 74, 94, 96]
2. Савельев И. В. курс физики том 1, 1989 год. [207; 209,212, 214]
3. Мясников С. П. пособие по физике 1976 год. [114, 117,118,120]

