Ключевые слова: торакальная хирургия, гнойная хирургия, сердечно-сосудистая хирургия, кардиохирургия, стерномедиастенит.
Введение
Впервые срединная стернотомия, как хирургический доступ к сердцу и крупным сосудам, была описана в 1897 году. Несмотря на стремление внедрить миниинвазивные технологии в хирургию, полная срединная стернотомия продолжает оставаться основополагающим доступом в большинстве кардиохирургических стационаров мира.
Инфекционные раневые осложнения, развивающиеся после срединной стернотомии, обозначаются термином «медиастинит» [1]. При этом инфекционный процесс не обязательно должен вовлекать средостение, он может ограничиваться поверхностными тканями (поверхностная стернальная раневая инфекция) [3].
При присоединении к процессу костных тканей, можно выделить гнойно-деструктивные заболевания (ГДЗ) костного каркаса грудной клетки.
Факторы риска стернальной инфекции
В различных источниках размещён обширный пласт проспективных и ретроспективных исследований, затрагивающих факторы риска развития стернальной инфекции — установлено свыше 20 предикторов [5].
К наиболее прогностически важным относятся: ожирение, сахарный диабет; длительная искусственная вентиляция лёгких; ранее проводимые оперативные вмешательства на грудной клетке (пример — рестернотомия); послеоперационные гемотрансфузии.
Механизмы развития стернальной инфекции
Изложенные в литературе механизмы, которые объясняют взаимосвязь между диастазом грудины и формированием раневой инфекции, представлены несколькими теориями [2]. Первая говорит о наличии локального ишемического остеомиелита, являющегося пусковым фактором раневого осложнения. На фоне локальных изменений, в области деструктурированной кости, проволочные швы ослабевают — развивается диастаз, мягкие ткани расходятся, образуя входные ворота инфекции.
По другой версии, этиологией является неадекватная стернорафия на фоне асимметричной стернотомии или без неё, с дальнейшим подобным развитием патологического процесса [9]. Происходит повторное инфицирование раны, а раневой экссудат самодренируется в средостение и перикард, вовлекая их в воспалительный процесс.
Иным триггером может стать скопление в средостении крови и/или серозного экссудата, представляющих собой великолепную питательную среду для микроорганизмов [2]. Скопление жидкости возникает вследствие неадекватного дренирования области хирургического вмешательства. Проникновение инфекции осуществляется через рану кожи.
Классификация
Неоднократно предпринимались попытки классифицировать стернальную раневую инфекцию (куда входят и ГДЗ).
Впервые подобного рода классификация была опубликована в 1984 году P. Pairolero и P. Arnold. Основной критерий — время возникновения осложнения. Этот параметр использовался и позже — классификация 1996 года, предложенная E. Oakley, где дополнительный критерий — наличие факторов риска и ранее проводимого лечения раневой инфекции.
Анатомическую локализацию, как критерий, впервые применил G. Jones и соавт. в 1997 году. A. Greig и соавт., в 2007 году, модернизировали её путём разделения послеоперационных раневых осложнений не только по глубине, но и по длине раны (верхняя/нижняя половина грудины).
Финальная (на момент написания статьи) классификация, предложенная в 2015 году J. Anger и соавт., по мнению многих специалистов, является наиболее полной и объективной. Она представлена в блок-схеме ниже (рис. 1).
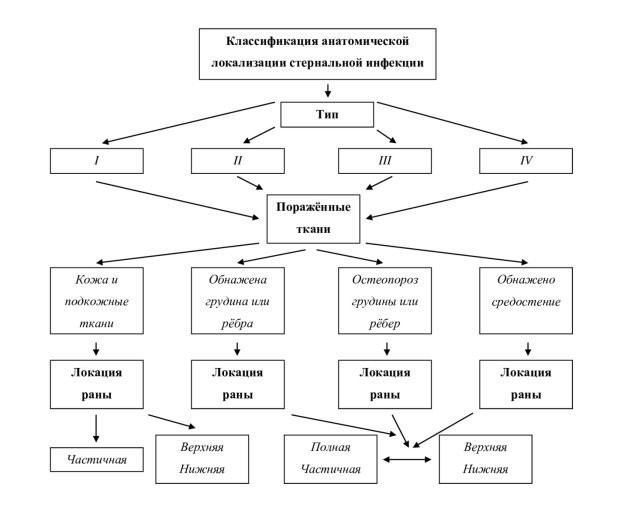
Рис. 1. Блок-схема № 1. Классификация анатомической локализации стернальной инфекции
Профилактика стерномедиастинита
Антибактериальная терапия на протяжении периоперационного периода — «золотой стандарт» профилактики постстернотомных раневых осложнений [6].
В подавляющем количестве случаев флора раневой инфекции при постстернотомных осложнениях представлена различными видами стафилококка. Установлено, что большой процент возбудителей мигрирует из собственной флоры верхних дыхательных путей пациента. Считается, что около 30 % человечества являются носителями Staphylococcus aureus, увеличивая таким образом риск развития раневых осложнений более, чем в 2 раза. Исследование интраназального применения мупироцина показало, что его использование приводит к деколонизации золотистого стафилококка: метициллинчувствительного — в более чем 90 % случаев, метициллинрезистентного — в 45–50 % случаев [7].
К другим профилактическим мерам можно отнести: точная срединная стернотомия; избегание применения воска и локальных гемостатиков, мешающих заживлению грудины и являющихся «лакомыми кусочками» для инфекционных агентов; чёткое сопоставление половин грудины; соблюдение санитарно-эпидемиологического режима в стационаре.
Хирургическое лечение
На сегодняшний день не существует единого алгоритма лечения стернальной инфекции. Подбор наиболее эффективного варианта лечения остаётся за врачом (клиническим подразделением) с учётом накопленного опыта. Вместе с развитием торакальной хирургии модернизировалась и методика лечения осложнений. В современной медицине есть спектр методик, каждая из которых имеет свои плюсы и минусы.
На начальных этапах лечение послеоперационных осложнений, в том числе ГДЗ, заключалось в проведении хирургической обработки и последующей рестернорафии; заживление раны происходило вторичным натяжением.
При открытом ведении раны требовалась длительная искусственная вентиляция лёгких из-за нарушения стабильности грудного каркаса, что приводило к развитию пневмоний, тромбоэмболий. При этом летальность достигала 45 % [4].
Редоновское дренирование
При лечении раневой инфекции, возникшей в результате осложнения торакального оперативного вмешательства, можно использовать методику закрытого дренирования средостения, используя катетеры Редона без постоянной ирригации.
Суть методики заключается в выполнении рестернотомии, хирургической обработке, санации и закрытии раны. В завершении применяется множественное дренирование зоны вмешательства тонкими катетерами. Число дренажей варьируется от 2 до 8 и подбираются с учётом размеров остаточной полости. Дренажные трубки подсоединяются к аспирации с отрицательным давлением (700 мм рт. ст.). Каждый дренаж соединяется с отдельной пластиковой ёмкостью необходимой для контроля количества и качества раневого отделяемого. Посевы экссудата производят 1 раз в 3 дня. Удаление дренажа производится при наличии двух стерильных посевов подряд. После снятия последнего дренажа, пациента переводят с внутривенной на пероральную антибактериальную терапию на 7 дней.
Редоновское дренирование обеспечивает отток раневого отделяемого и уменьшает остаточную раневую полость.
NPWT -терапия
С1990 года в хирургии начинается активное использование NPWT-терапии — метод лечения раневых дефектов/осложнений с использованием отрицательного давления. В частности, NPWT-терапия нашла применение в борьбе с постстернотомными осложнениями. Данная методика позволяет осуществлять постоянное удаление экссудата; уменьшать отёк прилежащих тканей и повышать их перфузию; формировать и контролировать влажную среду, необходимую для роста грануляций.
Последние несколько лет NPWT-терапия, кардио-торакальной хирургии, является основной стратегией лечения стерномедиастенитов [11].
U. Fuchs и соавт., сравнивая эффективность NPWT-терапии с другими методами лечения, сформулировали вывод, что стерильные посевы получаются чаще. S. Raja и G. Berg, в свою очередь, предоставляют данные о том, что временной интервал, от момента снятия швов и хирургической обработки до закрытия раны, уменьшается.
Аутопластика
Не менее интересной стратегией, использующейся в лечении постстернотомных осложнений, является первичное или отсроченное закрытие раневого дефекта при помощи васкуляризированных мягкотканных лоскутов. В 1980 году G. Jones и соавт. Описали применение лоскута большой грудной мышцы описано. Проведённый в 2011 году метаанализ 16-ти исследований, показал результаты пластики мышечным лоскутом и большим сальником.
Повторные вмешательства по причине возникновения некроза лоскута или рецидива инфекции составили от 3 до 18 %, уровень летальности = 29 %. Хронический болевой синдром встречался у 50 % пациентов, абдоминальные грыжи — у 5 % [8].
Высокая выживаемость отмечается при применении мио- и оментопластики, хотя сопровождаются дополнительной хирургической травмой более выраженным болевым синдромом; повышенным риском возникновения послеоперационной грыжи.
При литературном анализе встречаются публикации, посвящённые закрытию дефектов грудной стенки другими аутологическими материалами: m. tensor fasciae latae, гребень подвздошной кости, малоберцовая кость. Основной недостаток метода — ограничение объёма тканей, что позволяет выполнять пластику лишь небольших дефектов.
Аллопластика
Применение в хирургии децеллюляризированной дермы, в качестве варианта закрытия дефектов грудной клетки, представлено официнальными алло- и ксенографтами.
Особенность данного материала в том, что после имплантирования он со временем реваскуляризируется и переформируется в собственную ткань. Материал устойчив к инфекционным агентам, а также замещается аутогенными клетками даже в зоне воздействия лучевой терапии [10].
Для замещения обширных дефектов, как грудины, так и рёберного каркаса, применяются современные синтетические материалы: титановые пластины, специальные стальные сетки и синтетические полимерные сетки; полиметилметакрилат.
Взгляд в будущее
Несмотря на огромный ассортимент пластических материалов, применяющихся для замещения дефектов грудной клетки, большая их часть далека от идеала и не позволяет осуществить полноценное закрытие раны.
Возможно, в будущем, определённую роль сыграют трёхмерные модели изображений, полученные при помощи компьютерной визуализации на предоперационном этапе. Они станут эталоном при изготовлении имплантатов, учитывая индивидуальную конфигурацию.
Создание трёхмерной модели при помощи 3D-принтера позволит быстро и точно получать необходимый пластический материал, что максимально индивидуализирует хирургический подход к реконструкции дефектов грудной клетки.
Литература:
- Кохан, Е. П. Послеоперационные медиастиниты. Диагностика и лечение [Текст] / Е. П. Кохан, А. С. Александров // Хирургия. Журнал им. Н. И. Пирогова. — 2011. — № 9. — С. 22–26.
- Москалец, О. В. Аутоантитела при гематогенном остеомиелите / О. В. Москалец, В. В. Яздовский // Актуальные проблемы гуманитарных и естественных наук. — 2015. — С. 161–163.
- Порханов, В. А. Структура послеоперационных гнойно-септических осложнений в кардио-торакальной хирургии [Текст] / А. В. Порханов, И. С. Поляков, А. А. Завражнов, А. Л. Коваленко, А. А. Сирота // Материалы I Международного конгресса «Раны и раневые инфекции», Москва. — 2012-. С. 278–279.
- Сотников, А. В. К вопросу о профилактике медиастинита у кардиохирургических больных [Текст] / А. В. Сотников, М. В. Мельников, Р. В. Эльмаджи, Г. Н. Горбунов // Вестник Северо-западного государственного медицинского университета им. И. И. Мечникова. — 2015. — Т. 4, — С. 38–42.
- Фогт, П. Р. Элиминация стернальной инфекции в кардиохирургии: метод. рекомендации / П. Р. Фогт, Г. Г. Хубулава, С. П. Марченко. — СПб.: ООО «Б. Браун Медикал», 2012. — С.12–18.
- Шихвердиев, Н. Н. Интраоперационное местное применение антибиотиков для профилактики стернальной инфекции в кардиохирургии [Текст] / Н. Н. Шихвердиев, Г. Г. Хубулава, С. П. Марченко, В. В. Суворов // Патология кровообращения и кардиохирургия. — 2017. — Том 21, № 1. — С. 69–72.
- Aygun, F. The protective effect of topical rifamycin treatment against sternal wound infection in diabetic patients undergoing on-pump coronary artery bypass graft surgery [Text] / F. Aygun, A. Kuzgun, S.Ulucan [et al.] // CVJ of Africa. — 2014. — Vol. 25, № 3 — P. 96–99. https://doi.org/10.5830/CVJA-2014–008.
- Bhattacharyya, A. Gaenslen’s split heel approach for the treatment of chronic osteomyelitis of the calcaneus: a series of three cases / A. Bhattacharyya, R. Das // The Foot and Ankle Online Journal. — 2010. — Vol. 3. — № 11. — P. 3. https://doi.org/10.3827/faoj.2010.0311.0003.
- Gaspard, F. Impact of an antimicrobial dressing in reducing surgical site infections in cardiac surgery patients [Text] / F. Gaspard, P. Brassard, T. Alam [et al] // Wounds. — 2013. — Vol. 25, — P. 178–185.
- Grauhan, O. Cyanoacrylate sealed Donati suture for wound closure after cardiac surgery in obese patients [Text] / O. Grauhan, A. Navasardyan, M. Hofmann [et al] // Interact Cardiovasc Thorac Surg. — 2010. — Vol. 11, — P. 763–767. https://doi.org/10.1510/icvts.2010.247965.
- Grauhan, O. Prevention of poststernotomy wound infections in obese patients by negative pressure wound therapy [Text] / O. Grauhan, A. Navasardyan, M. Hofmann [et al] // J Thorac Cardiovasc Surg. — 2013. — Vol. 145, — P. 1387–1392. https://doi.org/10.1016/j.jtcvs.2012.09.040.







