В данной работе представлены результаты исследований электролитических (электрохимических) свойств различных растворов. Были изучены принципы работы химического источника электрического тока (гальванического элемента). Выполнялась задача вовлечения студентов СПО в научно-проектную деятельность: планирование и организация научных экспериментов, обработка и оформление результатов проведенных исследований.
Ключевые слова: гальванический элемент, электролит, кислота, основание, щелочь, соль, металл, окислитель, восстановитель, ионы, катионы, анионы, электроды, энергетические ячейки, разнополюсные пластины, токовые шины, катод, анод, электродвижущая сила, ЭДС.
Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов (и/или их оксидов) в электролите. В результате взаимодействия в замкнутой проводящей цепи возникает электрический ток.
Электролит — вещество, раствор которого проводит электрический ток вследствие диссоциации (распада) на ионы разного знака (катионы и анионы), Электролитами являются кислоты, соли, основания (щелочи).
Основу химических источников тока составляют контактирующие с электролитом два электрода:
– положительно заряженный катод, содержащий окислитель;
– отрицательно заряженный анод, содержащий восстановитель). При протекании окислительно-восстановительной реакции между электродами устанавливается разность потенциалов (электродвижущая сила). При работе химического источника протекают пространственно-разделённые процессы: на отрицательном аноде восстановитель окисляется, образующиеся при этом свободные электроны переходят по внешней цепи к положительному катоду (создавая электрический ток), где участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются в качестве:
– восстановителя (материал анода) — свинец (Pb), кадмий (Cd), цинк (Zn) и другие металлы;
– окислителя (материал катода) — оксид свинца (IV) (PbO 2 ), гидроксооксид никеля (NiOOH), оксид марганца(IV) MnO 2 ) и другие;
– электролита — растворы щелочей, кислот или солей.
Методы
Приборы и инструменты (рис. 1): мультиметр — DT832; растворы электролитов (газированные напитки, водопроводная вода, раствор лимонной кислоты, раствор поваренной соли, раствор пищевой соды), пластиковый сосуд из 4-х ячеек, набор медных и цинковых пластин, набор электрических проводов с контактами типа «крокодил» и «кнопка».

Рис. 1. Общий вид экспериментального оборудования
Размеры одной электролитической ячейки — 4.5×4.5×4.7 см 3 , что соответствует объему V ≈100 мл. Ширина медных и цинковых пластин — 1 см. При заполнении ячейки электролитом площадь, погруженной части пластин составляла приблизительно 4.5 см 2 .
Зависимость ЭДС и силы тока короткого замыкания от числа подключенных ячеек
В данной серии измерений производились измерения ЭДС (рис. 2) и силы тока короткого замыкания при последовательном подключении 1-ой, 2-х, 3-х и 4-х электролитических ячеек. Мультиметр использовался в режиме вольтметра (V) и амперметра (А), соответственно.
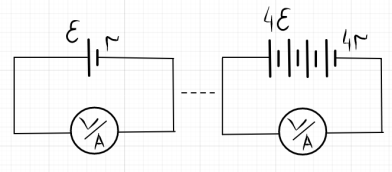
Рис. 2. Электрическая схема экспериментальной цепи, включающей источник (электролитические ячейки) и вольтметр/амперметр
Фотографии серии измерений ЭДС представлены на рис. 3. В представленном случае в качестве электролита использовался раствор лимонной кислоты (соотношение объемов кристаллической лимонной кислоты и воды составляло приблизительно 1/15). Переключатель мультиметра находился в поле для измерений постоянного напряжения. При подключении одной секции (электролитической ячейки) показания 969 мВ, двух — 1928 мВ, трех — 2,88 В, четырех — 3,83 В.
Таким образом, эксперимент показал, что каждая секция «вырабатывает» ЭДС порядка ε ≈960 мВ и при их последовательном соединении ЭДС получаемой батареи принимает значения ε, 2 ε, 3 ε и 4 ε , соответственно (рис. 2).

Рис. 3. Фотографии эксперимента по измерению ЭДС (лимонная кислота)
Измерения силы тока короткого замыкания в этом случае показали, что она не зависит от числа включенных в цепь ячеек и равна приблизительно 3 мА (рис. 4). Переключатель мультиметра находился поле для измерения силы постоянного тока.

Рис. 4. Измерение силы тока (лимонная кислота)
Независимость силы тока от числа n подключенных ячеек можно объяснить следующим образом. Если ЭДС одной ячейки ε , а ее внутреннее сопротивление r , то при их последовательном соединении суммарно получаем nε и nr . Соответственно, согласно закона Ома, сила тока
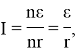
то есть не зависит от числа ячеек, включенных в цепь.
Мощность же батареи будет пропорциональна числу соединенных ячеек:
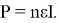
В рассмотренном случае при четырех соединенных ячейках мощность будет равна
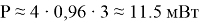
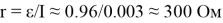
Полученной мощности достаточно, чтобы «заработал», например, светодиод (рис. 5).

Рис. 5. «Работа» светодиода
Кроме того, эксперимент показал, что медная пластина (слева, красный провод) является положительным полюсом электрохимического источника тока, а цинковая (справа, черный провод) — отрицательным.
Сравнение характеристик электрического тока для разных электролитов
Эксперименты проводились с разными электролитами (жидкостями и растворами). Это были газированные напитки: (рис. 1) «Ах!», «Ситро», «Coca Cola», «Добрый кола», «Эвервесс». Растворы: лимонной кислоты, пищевых соли и соды. И даже простая водопроводная вода.
Во всех экспериментах (при одинаковом числе включенных ячеек) значения ЭДС составляло приблизительно одинаковую величину. Для одной ячейки это было около 1 В (даже для простой водопроводной воды). Это говорит о том, что «вырабатываемое» ЭДС (работа по переносу единичного электрического заряда) зависит не столько от используемого электролита, сколько, вероятно, от «геометрии» ячейки, размеров электродов и вещества, из которого они изготовлены. В данной работе таких исследований не проводилось.
Что касается наличия ЭДС при использовании обычной водопроводной воды, то она не дистиллированная, а, конечно, обладает некоторой минерализацией. То есть в ней растворены соли и, соответственно, носители электрического заряда присутствуют.
А вот сила тока при использовании различных электролитов порой существенно отличалась (см. табл. 1)
Таблица 1
Результаты измерения силы тока
|
Электролит |
«Ах!» |
« Coca Cola » |
«Добрый Кола» |
«Ситро» |
«Евервесс» |
Лимонная кислота |
Сода |
Соль |
Вода |
|
Сила тока, мА |
0,6 |
0,5 |
0,5 |
0,5 |
0,4 |
3,0 |
1,5 |
0,3 |
0,3 |
|
Прим. |
Растворы: лимонная кислота — 1/15, сода — 1/4, соль — 1/10 |
||||||||
Из таблицы 1 можно видеть:
- Газированные напитки «дают» приблизительно одинаковую силу тока, что говорит об их приблизительно одинаковом («с электрической точки зрения») составе.
- Для раствора соли и чистой водопроводной воды сила тока одинакова. Это, вероятно, говорит о том, что ионы натрия и хлора не участвуют (или их вклад не является определяющим) в электрохимических взаимодействиях с цинком и медью (из которых изготовлены электроды).
- Наибольшие значения силы тока дают растворы лимонной кислоты (кислота) и соды (щелочь, основание).
Заключение
В ходе выполнения данной работы один из авторов (студент) научился:
- планировать, организовывать и выполнять физический эксперименты;
- проводить электрические измерения с помощью мультиметра;
- оформлять результаты научной работы в виде научной статьи.
По результатам проведенных исследований можно сделать следующие выводы.
- Газированные напитки распространенных торговых марок обладают приблизительно одинаковой кислотностью.
- Наличие даже небольшой минерализации приводит к появлению ЭДС (вода).
- Лимонная кислота является более активным электролитом, в сравнении с пищевой содой, при использовании медного и цинкового электродов.
Для подтверждения приведенных выше вероятностных суждений необходимы дополнительные исследования.







