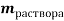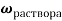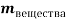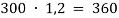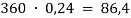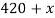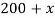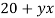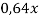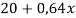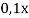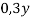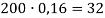В статье рассматриваются табличные методы решения задач на вычисление массовой доли растворённого вещества.
Ключевые слова: химия, табличный метод, массовая доля вещества.
Решение любых задач вызывают у обучающихся затруднения. Хотя решение задач — является одним из самых эффективных способов обучения: развивает навыки контроля и самоконтроля, помогает определить степень усвоение знаний и умений их использование на практике, позволяет выявлять пробелы в знаниях и умениях обучающихся и разрабатывать тактику их устранения. Самостоятельно справиться с решением задач могут немногие. Все больше и больше появляется задачи, имеющие практическое значение, которые являются также хорошим средством развития мышления учащихся. Поэтому на сегодняшний день тема решений таких задач является актуальной.
В данной статье я привожу метод решения химических задач на вычисления массовой доли растворенного вещества табличным способом. Данный способ не является новым, но в химии при решении задач редко используется. Сам метод очень удобный.
По сложности условно можно разделить эти задачи на:
I. Растворы, где меняется количество растворителя
II. Расчеты для одного раствора
III. Растворы, где меняется количество вещества
IV. Растворы, где меняется и количество вещества, и масса растворителя
V. Смешивание растворов.
Основные формулы, которые используются при решении задач:
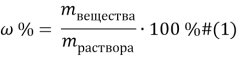
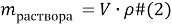
Рассмотрим примеры решения некоторых задач.
I . Растворы, где меняется количество растворителя
Задача № 1
К 300 мл 24 % раствора соли (
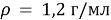
Дано:
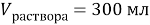
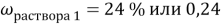
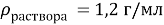
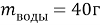
Найти:
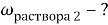
Занесем данные по условию задачи в таблицу 1 и произведем расчет возможных величин, помня, что числа в горизонтальных строчках можно умножать, а числа в вертикальных столбцах можно складывать (если добавляем, разбавляем) или вычитать (если упариваем). Нельзя складывать только массовую долю растворенного вещества между собой. Как правило за « x » — обозначаем то значение, которое необходимо найти.
Таблица 1
|
|
|
|
|
|
Было раствора |
|
0,24 |
|
|
Добавили |
40 |
0 |
0 |
|
Стало раствора |
400 |
x |
86,4 |
В последней строчке получаем линейное уравнение с одним неизвестным, решив которое мы получим ответ нашей задачи.
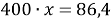
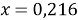
Ответ: 21,6 %
Задача № 2
Вычислите массу воды, которую нужно прилить к 420 г 15 % раствора соли, чтобы получить 9 % раствор.
Дано:
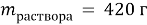
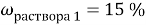
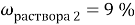
Найти:
Таблица 2
|
|
|
|
|
|
Было раствора |
420 |
0,15 |
63 |
|
Добавили |
x |
0 |
|
|
Стало раствора |
|
0,09 |
63 |
По аналогии с предыдущей задачей в последней строчке получаем линейное уравнение с одним неизвестным, решив которое мы получим ответ нашей задачи.
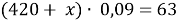
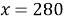
Ответ: 280 г
III . Растворы, где меняется количество вещества
Задача№ 3
Вычислите массу
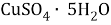
Дано:
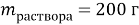
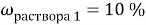
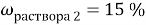
Найти:
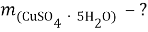
В этой задачи нам понадобится расчет малярных масс
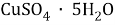
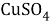
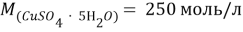
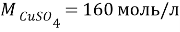
Таблица 3
|
|
|
|
|
|
Было раствора |
200 |
0,1 |
20 |
|
Добавили |
x |
y |
yx |
|
Стало раствора |
|
0,15 |
|
В данной задачи мы сталкиваемся с кристаллогидратом. Необходимо произвести расчет массовой доли
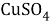
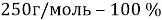
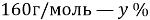
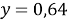
Полученное значение
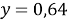
Таблица 4
|
|
|
|
|
|
Было раствора |
200 |
0,1 |
20 |
|
Добавили |
x |
0,64 |
|
|
Стало раствора |
|
0,15 |
|
Составим линейное уравнение:
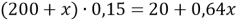
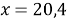
Ответ: 20,4 г
V . Смешивание растворов
Задача № 4
При смешивании 10 % и 30 % раствора соли получили 200 г 16 % раствора соли. Сколько граммов каждого раствора взяли?
Дано:
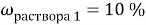
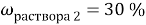
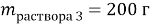
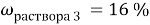
В этой задачи два неизвестных, поэтому вводим две переменные.
Таблица 5
|
|
|
|
|
|
Было раствора |
Х |
0,1 |
|
|
Добавили |
Y |
0,3 |
|
|
Стало раствора |
200 |
0,16 |
|
Составим систему уравнению c двумя неизвестными:
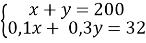
Ответ:
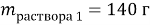
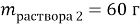
Анализ эффективности данного метода показывает, что процент решения задач этим методом намного выше чем привычным «методом стаканчиков». Задачи, где может применяться этот методом присутствуют на ЕГЭ и ОГЭ как по химии, так и по математики, что расширяет область его применения.
Литература:
- Кузьменко Н. Е., Еремин В. В., Сборник Задач по химии с решениями / Н. Е. Кузьменко, В. В. Еремин –Москва: ООО «Издательский дом «ОНИКС 21 век»: ООО Издательство «Мир и Образование», 2003. — 640 с.
- Кузьменко Н. Е., Еремин В. В., Попков В. А., Начала химии. Современный курс для поступающих в вузы (в 2 т.) / Н. Е. Кузьменко, В. В. Еремин, В. А. Попков — Москва: Экзамен: Издательский дом «ОНИКС 21 век», 2017.-448 с
- Мацокина Г. Ф., Пособие по химии: методы решения расчетных и экспериментальных задач, Нижний Новгород 2015
- Врублевский А. И., Задачи по химии с примерами решений, Минск: «Издательство Юнипресс», 2015.
- Денисов В. Г., Выполнение заданий и решение задач повышенной сложности с комментариями и ответами для подготовки к единому государственному экзамену по химии (Алгоритмы выполнения заданий и способы решения задач) / В. Г. Денисов, Волгоград: Учитель, 2014.-133 с.