Концентрация ядросодержащих клеток (ЯСК) в лейкоконцентрате полученного путем аппаратного лейкоцитофереза для аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК) существенно влияет на сохранность и жизнеспособность гемопоэтических стволовых клеток (ГСК) на этапе добавления криконсерванта DMSO (dimethyl sulfoxide). В 6 (24 %) случаях, количество ГСК снизилось значительно, почти менее 50 % от заготовленной дозы. При этом лейкоконцентрат содержал >150109/л ЯСК, таким образом, при процессе обработки процессинга ГСК теряется большое количество СК. Нами предложен метод снижения объема в зависимости от концентрации клеток, что показало существенную сохранность количества и жизнеспособность СК в трансплантате.
Ключевые слова: аутологичная трансплантцаия, гемопоэтические стволовые клетки, лейкоцитоферез, криопротектор
Трансплантация гемопоэтических стволовых клеток (ТГСК) как медицинская технология, занимает особое место в терапевтическом арсенале злокачественных новообразовании, и является эффективным, в то же время рискованным методом лечения пациентов с онкологическими, гематологическими и аутоиммунными заболеваниями [1]. Основной ролью ТГСК является восстановление гемопоэза после высокодозной химиотерапии, что позволяет многократно эскалировать разовые дозы некоторых цитостатиков. Динамика восстановления кроветворения впрямую зависит от количества трансплантированных гемопоэтических стволовых клеток (ГСК) и во многом определяет успех трансплантации [2].
Одним из видов трансплантации является аутологичная трансплантация гемопоэтических стволовых клеток (АутоТГСК). Более распространенным источником ГСК для аутоТГСК является — периферическая кровь пациента /донора. Для этого больному выполняется мобилизация путем ежедневного (в течение 4–7 дней) введения гранулоцит-колоние-стимулирующих факторов (G-KSF), в результате чего происходит выход ГСК из костного мозга в периферическую кровь [3]. В последующем выполняется сбор ГСК с помощью аппаратного лейкоцитафереза. Данная процедура аппаратного лейкоцитафереза продолжается пока не будет собрана трансплантационная доза (>2 х106 СК на кг пациента), достаточная для успешного восстановления кроветворения после высокодозной химиотерапии.
Однако, не у всех пациентов/доноров удается получить хороший ответ на мобилизацию и собрать достаточное количество ГСК путем лейкоцитафереза. Эти препятствия связаны с динамикой выхода ГСК в периферическую кровь, весьма индивидуальный, и могут быть обусловлены статусом больного (возраст, пол, вовлечением КМ в патологический процесс. В конечном итоге, дни мобилизации могут быть продлены и сбор ГСК из периферической крови выполняется на поздних сроках мобилизации и не всегда бывает результативным. Часто возникает необходимость в повторном лейкоцитаферезе на еще более поздних сроках мобилизации. Однако периферическая кровь в поздние сроки мобилизации характеризуется значительным изменением клеточного состава. Данные изменения в периферической крови обусловлены фармакологическими свойствами препарата G-KSF, который не только стимулирует пролиферацию и выход ГСК из КМ, но и их созревание, а также выход зрелых форм лейкоцитов из депо. В связи с этим на поздних сроках мобилизации наблюдается значительный рост концентрации зрелых ядросодержащих клеток (ЯСК), которые провоцируют высокий лейкоцитоз полученного путем аппаратного лейкоцитофереза трансплантационного материала. Такие ситуации возможны, если лейкоцитаферез выполнялся на фоне высоких концентрации ЯСК. В итоге концентрация ЯСК клеток в трансплантате может достигать 300–500 х 109 клеток/л, что, согласно мнению ряда авторов, обусловливает низкую сохранность ГСК в процессе замораживания и размораживания. Однако авторами [Грицаев С. В. Кузяева А. А.] не предлагаются конкретные пути решения данной проблемы. Тем временем, разработка методов коррекции лейкоцитоза в трансплантате даст возможность улучшить сохранность ГСК в процессе замораживания и размораживания.
Цель исследования:
Улучшить сохранность СК трансплантата полученных с большим количеством лейкоцитов из периферической крови при криоконсервации.
Материалы иметоды исследования:
Для оценки влияния гиперлейкоцитоза на сохранность ГСК проведен ретроспективный анализ результатов обработки и криоконсервации 40 образцов трансплантата, полученного у 33 пациентов: с нейробластомой — 25, с лимфомой ходжкина -12, ретинобластомой- 2 и Саркома Юинга -1. В период выхода из аплазии кроветворения в среднем на +10 день после блока полихимиотерапии (ПХТ) пациентам назначалось ежедневное подкожное ведение G-KSF в дозе 10мкг/кг фактической массы тела, включая день сбора ГСК из периферической крови пациента/донора. Полученный продукт афереза по протоколу заготовки ГСК подвергался обработке до криоконсервации и хранения, что обуславливало дополнительные потери ЯСК (рисунок 1)
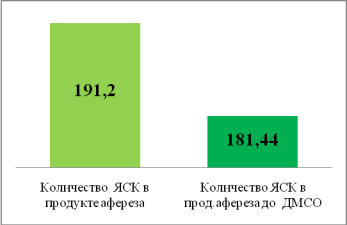
Рис. 1. Показатель потери клеток на этапе обработки ЯСК 106 /кг
На 1 рисунке показано, что потеря клеток на этапе обработки полученного продукта афереза составила 6.5 %.
К хранению трансплантат был подготовлен путем добавления криопротектора в котором конечная концентрация DMSO в трансплантате составляло 10 %. В последующем трансплантат подвергали программному замораживанию и хранению в жидком азоте. Пробы для анализа ЯСК и количества ГСК отбирались до и после добавления криопротектора (DMSO), а также после размораживания трансплантата. На данных этапах для оценки зависимости сохранности ГСК от концентрации ЯСК применялся корреляционный анализ.
Для апробации метода коррекции гиперлейкоцитоза выполнено проспективное исследование с использованием 12 образцов с высокой концентрацией WBC от 150 до 600 х 109 /л WBC. В полученный путем обработки материал в асептических условиях добавлялась аферезная аутоплазма для снижения концентрации ЯСК ниже уровня 150 х 109 /л.
Результаты клинического опыта (12 образцов) сравнивались с результатами, полученными до метода коррекции гиперлейкоцитоза (сравнительные образцы — 28). Анализ жизнеспособных ГСК исследовался до и после добавления криопротектора, а также после размораживания трансплантата. Количество и жизнеспособность ГСК оценивалось на проточном цитометре «Contu-II» с использованием набора моноклональных реагентов. Концентрацию ЯСК определяли с помощью анализатора Sysmex KX-21N.
Результаты исследования: Зависимость сохранности жизнеспособности ГСК от концентрации ЯСК в трансплантате.
Забор СК периферической крови был начат на 5–6-е сутки, при достижении количества ГСК>20106/л. После проведения процедуры афереза в полученном продукте концентрация Wight Blood Cells (WBC) составила max до 530109/л. В результате исследования выявлено, что после добавления криопротектора количество ГСК снизилось до 90.4 ±9,03 106/кг от исходного значения, а жизнеспособность составил 98± 2,01 % (рисунок 2)
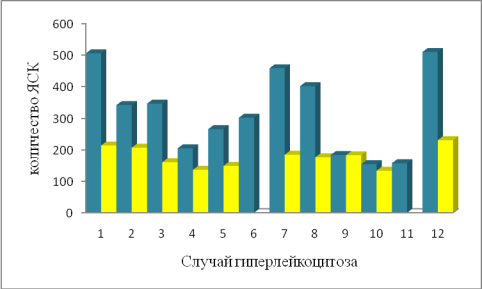
Рис. 2. Сравнительный анализ ГСК до и после добавления криопротектора
Нами замечено, что в случаях, когда общая клеточность материала превышала 300109/л, количество СК снижалось на 15 % от исходных значений. Так в 6 (24 %) случаях, количество ГСК снизилось значительно, почти менее 50 % от заготовленной дозы. При этом лейкоконцентрат содержал >150109/л ЯСК, таким образом, при удалении ЯСК теряется большое количество СК.
Полученные результаты подтверждали наблюдения других авторов, которые сообщали о низкой сохранности ГСК при криоконсервации трансплантатов с гиперлейкоцитозом. Нами дополнительно установлено, что при высокой концентрации WBC в трансплантате гибель не только ГСК, но и гранулоцитов происходит уже на этапе добавления криопротектора.
Анализ аналогичных параметров на этапе размораживания показал, что сохранность и жизнеспособность ГСК зависит от концентрации ЯСК. Следовательно, концентрация ЯСК напрямую влияет на сохранность количества ГСК и на их жизнеспособность в процессе размораживания. В целом по литературным данным в процессе размораживания количество и жизнеспособность ГСК снижается на 10–15 %. Суммарно на этапе введения криопротектора (отмечено) снижение количества ГСК снизилось на 26 %. Такое значительное снижение количества трансплантата может быть причиной посттрансплантационных нежелательных осложнений, связанных с длительными сроками восстановления гемопоэза. В связи с этим целесообразно проводить коррекцию гиперлейкоцитоза в трансплантате.
Методы коррекции: Нами предложена методика снижения объема трансплантата «путем расчета клеточности продукта афереза» до введениия криопротектора в трансплантат. Для снижения лейкоцитов ниже 150 х 109 /л применялся следующий метод:
– Определить количество всех NС (ядросодержащих клеток) в данном объеме продукта афереза.
– Вычислить необходимый целевой объем для удобного расположения NС в трансплантате.
– В случае, если в лейкоконцентрате количество лейкоцитов превышает 150 х 109 /л то объем лейкоконцентрата разделяем на необходимое количество доз до достижения предлагаемого уровня клеточности в целевом объеме, тем самым обеспечив сохранность СК.
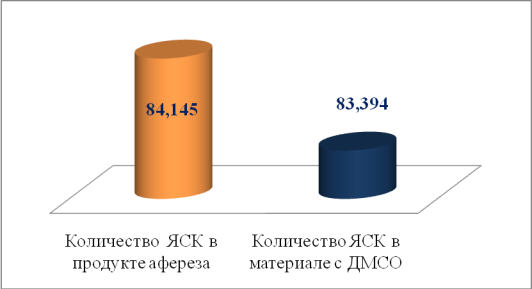
Рис. 3. Количество ЯСК корректированных трансплантатов
Представленные на 3 рисунке результаты снижения лейкоцитоза в продукте афереза показали, что сохранность ЯСК клеток для лучшего приживления трансплантата достоверно выше, чем в случаях, проанализированных до использования метода коррекции (рисунок 3)
Таким образом, благодаря снижению лейкоцитоза в продукте афереза удалось сохранить количество и жизнеспособность СК на этапе до добавления криопротектора и сохранить количество ЯСК для лучшего приживления трансплантата.
Выводы:
Полученные данные свидетельствуют о том, что успех аутоТГСК зависит от множества факторов и не в последнюю очередь зависит от трансплантата. Одним из важных условий сохранности качества трансплантата и количество СК для аутоТГСК является проведение лейкоцитафереза на ранних сроках мобилизации, а так же обеспечение общей клеточности трансплантата на допустимом уровне.
В результате исследования установлено, что введение криопротектора в трансплантат с высокой концентрацией WBC снижает сохранность и жизнеспособность ГСК.
Литература:
- М. А. Масчан «Деплеция альфа/бета Т лимфоцитов — надежная платформа для развития трансплантации гемопоэтических клеток от гаплоидентичных доноров» 2015г; 2 стр.
- Нукушева С. Г., Омарова К. О., Тулебаева А. Б. «Опыт клинического применения операции аутологичной трансплантации гемопоэтических стволовых клеток в Республике Казахстан детям с рецидивами лимфомы Ходжкина» 2012г; 5стр.
- Bensinger W.,DiPersio J. F., McCarty J. M. Improving stem cell mobilization strategies. Bone Marrow Transplantation. (3) cтр. 181–195
- Боранбаева Р. З., Омарова К. О., Тулебаева А. Б., Булегенова М. Г. «Трансплантация гемопоэтических стволовых клеток у детей с онкогематологическими заболеваниями в Республике Казахстан» 2014г.стр.30–32

