Введение
Пигментный аппарат растений является чувствительным индикатором их физиологического состояния [13-16]. Содержание хлорофиллов и каротиноидов является важным показателем физиологического состояния растений, отражающим интенсивность фотосинтеза, адаптивные перестройки, изменения в онтогенезе, старении и стрессовых (антропогенных) воздействиях. В большинстве физиолого-биохимических исследований содержание пигментов в растениях определяют в экстрактах с помощью спектрофотометрического анализа. Применение этого метода сопряжено с разрушением тканей, трудоемко, требует достаточно длительного времени, использования органических растворителей, и часто сопряжено с артефактами, связанными с лабильностью пигментов, неполнотой их экстракции, присутствием других светопоглощающих комплексов и др. В связи с этим, весьма привлекательным является возможность недеструктивного анализа пигментов по спектрам отражения интактных тканей. Спектры отражения листьев претерпевают изменения при стрессах, старении, недостаточности минерального питания, действии загрязнителей среды, адаптации к световому излучению. Существенным преимуществом неповреждающих оптических методов является то, что измерения могут быть осуществлены с малыми затратами времени, вследствие чего возможен анализ большого количества образцов, что достигается с трудом при использовании классических методов. При этом растения остаются пригодными для последующих исследований. Следует также отметить появление на рынке портативных рефлектометров, снабженных гибкими световодами и способных обеспечивать получение качественной спектральной информации в полевых условиях, как с небольшой поверхности растительной ткани, так и с отдельного растения. Спектроскопия отражения широко используется в дистанционном зондировании в целях получения глобальной информации о состоянии посевов и растительных сообществ в целом [2].
Группой ученых Биологического факультета МГУ им. М.В. Ломоносова, под руководством д.б.н., проф. М.Н. Мерзляка при участии зарубежных коллег была разработана общая методология анализа пигментов растений с использованием метода спектроскопии отражения [7-9; 13-21]. Основной задачей данной работы является поиск подходов к использованию метода спектроскопии отражения для анализа пигментов в растительных тканях с применением портативного оптоволоконного рефлектометра.
Объекты и методы
Объектами исследований послужили листья растений березы (Betula verrucosa L.) и кизильника (Cotoneaster alaunica L.), обладающие широкой вариацией пигментного состава в ходе осеннего старения листьев, а также хвоя голубой ели (Picea pungens Koster). Образцы (общее число более 500) отбирались в осенний период (октябрь-ноябрь 2009 г.) с деревьев, растущих вблизи биологического факультета МГУ им. М.В. Ломоносова.
В работе использовали портативный оптоволоконный рефлектометр модульной конструкции, включающий источник света LS-1 с галогенной лампой накаливания, спектрорадиометр USB2000, оптоволоконный зонд на основе разветвленного световода, и держатель образцов собственного изготовления, обеспечивающий падение измеряющего луча на образец под углом 45° либо 90°, а также программное обеспечение OOBase32. Для каждого из образцов записывали спектр отражения в видимой области (400-700 нм) против стандарта из BaSO4 с использованием рефлектометра вышеописанной конструкции, после чего аналитически определяли содержание пигментов, согласно [3]. Для экстракции пигментов листья и хвою гомогенизировали в фарфоровой ступке в ацетоне с добавлением 200 мг карбоната кальция (для предотвращения феофитинизации). Гомогенаты центрифугировали в стеклянных пробирках при 3000-4000 g в течение 10 минут. Полученные экстракты немедленно спектрофотометрировали (спектрофотометр Hitachi 150-20). Концентрацию пигментов определяли по формулам Лихтенталера [12].
Результаты и обсуждение
В результате проведенной работы были получены массивы данных, содержащие информацию о коэффициентах отражения в видимой области спектра и о пигментном составе листьев и хвои изученных видов растений. Спектры отражения листьев березы и кизильника, измеренные на портативном рефлектометре, существенно варьировали в зависимости от содержания в них пигментов (рис. 1-2).
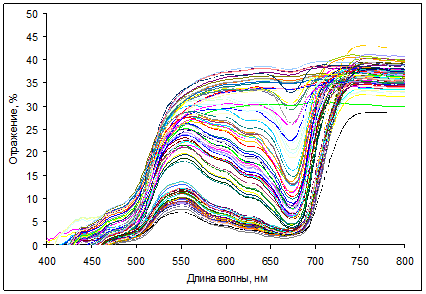
Рис. 1. Спектры отражения листьев Betula verrucosa L.
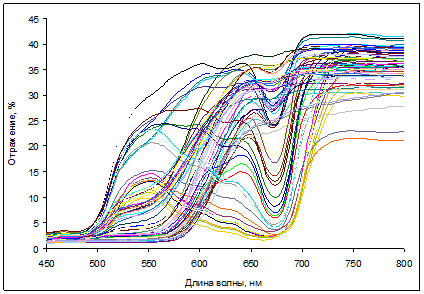
Рис. 2. Спектры отражения листьев Cotoneaster alaunica L.
Максимальные значения отражения были характерны для ближней ИК-области, в которой отсутствует поглощение пигментов. Минимальные коэффициенты отражения наблюдали в полосах сильного поглощения хлорофиллов (в синей и красной областях спектра) и каротиноидов (в синей области). У красных листьев кизильника с высоким содержанием антоцианов дополнительно наблюдали снижение отражения. В ходе осеннего старения листьев этих растений отмечено повышение отражения в красной области вследствие деградации хлорофиллов; в то же время отражение в синей области спектра повышалось незначительно, по-видимому, из-за преимущественного сохранения каротиноидов [15].
Спектры отражения хвои голубой ели также варьировали в зависимости от содержания в них пигментов (рис. 3).
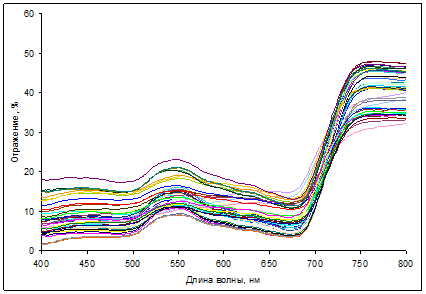
Рис. 3. Спектры отражения хвои Picea pungens Koster
Для хвои ели было характерно низкое отражение при высоком содержании хлорофиллов и каротиноидов, которое изменялось в значительной степени синхронно, за исключением отдельных образцов побуревшей хвои.
Необходимо отметить, что спектры отражения ассимиляционных органов исследованных видов растений, измеренные с помощью портативного рефлектометра, были в целом сходны по форме и положению максимумов со спектрами, измеренными традиционным образом (с применением интегрирующей сферы).
Корреляционный анализ полученных данных позволил выявить спектральные полосы, характеризующиеся высокой корреляцией с содержанием искомых пигментов в широком диапазоне их изменения (рис. 4-6).
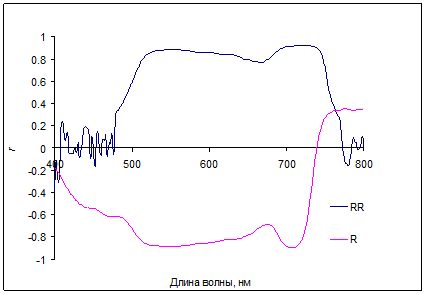
Рис. 4. Корреляция коэффициентов отражения R(λ) (кривая «R») и обратных коэффициентов отражения 1/R(λ) (кривая «RR») с содержанием суммы хлорофиллов a и b для листьев Betula verrucosa L.
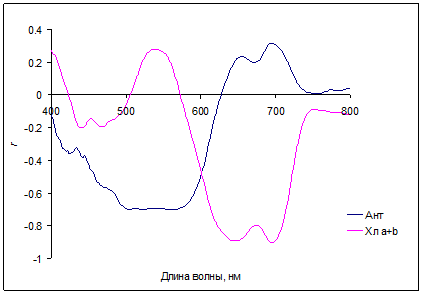
Рис. 5. Корреляция коэффициентов отражения R(λ) с содержанием антоцианов (Ант) и с содержанием суммы хлорофиллов a и b (Хл a+b) для листьев Cotoneaster alaunica L.
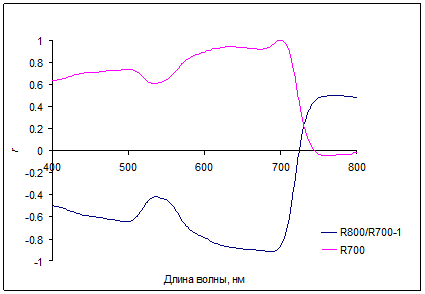
Рис. 6. Корреляция коэффициентов отражения с величиной индекса, связанного с содержанием хлорофиллов (R800/R700-1) и с отражением при 700 нм (R700) для хвои Picea pungens Koster
Области спектра с максимальной чувствительностью коэффициентов отражения к содержанию хлорофиллов были найдены в дальней красной и ближней ИК (700–720 нм), а также в зеленой (550–570 нм) областях. Поглощение антоцианов (плечо или полосы около 550-600 нм) обычно проявляется на фоне значительного поглощения хлорофиллов и каротиноидов. В красных листьях кизильника при минимальных значениях хлорофиллов, антоцианы накапливаются в большом количестве, и практически полностью определяют низкое отражение в зеленой части спектров (рис. 5). Корреляция коэффициентов отражения с величиной индекса, связанного с содержанием хлорофиллов (R800/R700-1) и с отражением при 700 нм для хвои голубой ели показана на рис. 6.
Соотношение между каротиноидами и хлорофиллами является важной характеристикой состояния фотосинтетического аппарата растений. Естественная (например, при осеннем старении) и искусственная (вызванная антропогенными загрязнителями) деградация хлорофиллов, может протекать на фоне сохранения каротиноидов, что приводит к росту соотношения каротиноидов и хлорофиллов [1,15,16,23,24]. В данной работе это явление наблюдали на примере листьев березы (рис. 7). Увеличение данного соотношения, по-видимому, является результатом усиления протекторной функции желтых пигментов, ингибирующих процессы перекисного окисления липидов в листовых тканях [1,5].
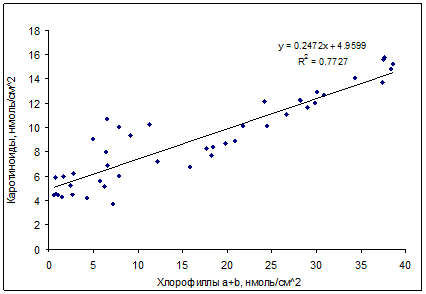
Рис. 7. Зависимость между содержанием каротиноидов и хлорофиллов в листьях
Betula verrucosa L.
В результате проведенной работы была подтверждена применимость ранее предложенных спектральных индексов [2] для недеструктивной оценки содержания пигментов в листьях изученных видов растений по измерениям спектров отражения, выполненных при помощи портативного спектрофотометрического оборудования. Изменения в содержании хлорофиллов и каротиноидов можно оценить, используя индекс PSRI (от Plant Senescence Reflectance Index), в котором используются коэффициенты отражения при 500, 678 и 800 нм: PSRI = (R678 – R500)/R800 [15,18]. При анализе листьев с различным содержанием пигментов было обнаружено, что отражение в максимуме поглощения хлорофиллов в красной области (около 678 нм) тесно коррелирует с отражением около 500 нм – в полосе совместного поглощения хлорофиллов и каротиноидов. В листьях березы с содержанием хлорофилла меньше 3 нмоль/см2 этот индекс сильно коррелирует с отношением каротиноидов к хлорофиллам (рис. 8).
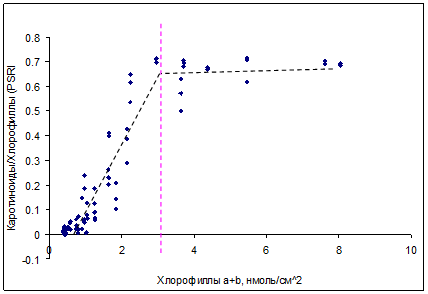
Рис. 8. Зависимость между индексом PSRI (пропорциональному соотношению каротиноидов и хлорофиллов) и содержанием суммы хлорофиллов a и b при осеннем старении для листьев Betula verrucosa L. (r2 > 0.8)
Отдельной задачей является наблюдение за динамикой содержания антоцианов, также способных выполнять защитную функцию [10,11,22,25,26]. Высокий потенциал для недеструктивной оценки содержания антоцианов (на примере листьев кизильника) показал спектральный индекс ARI (от Anthocyanin Reflectance Index), вычисляемый по формуле: ARI = (1/R550 – 1/R700)*R800 [2], в котором отношение 1/R550 чувствительно к содержанию антоцианов, отношение 1/R700 чувствительно к содержанию хлорофиллов и позволяет внести поправку на вклад этих пигментов в поглощение при 550 нм, а коэффициент R800 позволяет учесть гетерогенность оптических свойств листьев, не связанную с поглощением пигментов [6]. В наших экспериментах индекс ARI проявлял высокую линейную корреляцию с содержанием антоцианов в листьях кизильника на фоне сильно варьирующего содержания хлорофиллов (рис. 9).
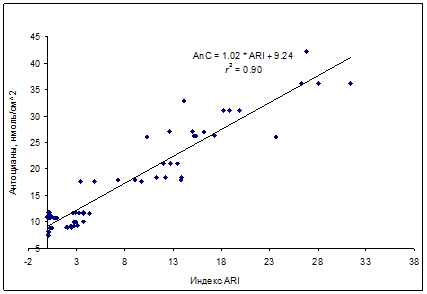
Рис. 9. Зависимость между индексом ARI и содержанием антоцианов в листьях Cotoneaster alaunica L.
Для определения содержания хлорофиллов, были предложены спектральные индексы в виде простых отношений коэффициентов отражения при длинах волн с низкой (R800) и высокой (R700) чувствительностью к содержанию хлорофиллов (ChlRI, от Chlorophyll Reflectance Index). Высоким потенциалом для недеструктивной оценки содержания хлорофиллов в листьях березы обладал спектральный индекс R800/R716–1 (рис. 10). Для недеструктивной оценки хлорофилла в неповрежденной хвое ели может быть использован спектральный индекс R800/R710–1 (рис. 11). Связь этих индексов с содержанием хлорофиллов была линейной.
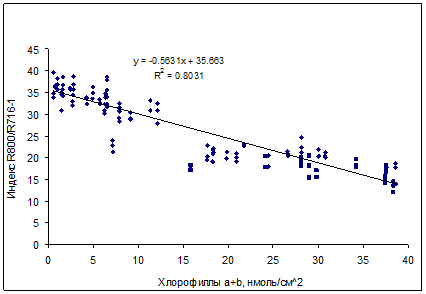
Рис. 10. Зависимость между индексом ChlRI (R800/R716-1) и содержанием суммы хлорофиллов a и b в листьях Betula verrucosa L.
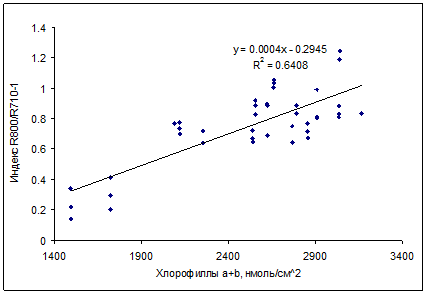
Рис. 11. Зависимость между индексом ChlRI (R800/R710-1) и содержанием суммы хлорофиллов a и b в хвое Picea pungens Koster
Спектры отражения ассимиляционных органов растений могут претерпевать изменения в результате побурения и некротизации тканей, что связано с образованием окрашенных продуктов, возникающих при окислении полифенольных соединений. Использование спектрального индекса BRI (от Browing Reflectance Index): BRI = (1/R510 – 1/R550)/R800, разработанного для количественной оценки побурения при повреждении тканей растений [2,4], позволило дифференцировать образцы хвои голубой ели с симптомами повреждения и без них (данные не приводятся). Наибольшие изменения (снижение отражения) происходят в зеленой области (510-550 нм) и при 800 нм. Это открывает широкие возможности для применения индекса BRI для недеструктивной количественной экспресс-оценки влияния на растения таких повреждающих факторов, как кислотные дожди, загрязнение тяжелыми металлами, и др. поллютантами, распространенными в Мурманской области вследствие деятельности металлургических предприятий, а также других абиотических стрессоров, вызывающих повреждение ассимиляционных органов растений с последующим их побурением.
Заключение
В результате проведенной работы получен массив данных для разработки спектральных индексов при оценке содержания пигментов в ассимиляционных органах изученных видов растений по спектрам отражения. Показана применимость портативного оптоволоконного рефлектометра для недеструктивного анализа пигментов. Необходимо подчеркнуть, что указанный метод особенно удобен для экспресс-анализа содержания пигментов в полевых условиях. Найдены подходы для разработки недеструктивных методов анализа пигментов в модельных видах и видах-индикаторах, используемых для оценки антропогенного стресса в экосистемах Мурманской области. Адаптированы спектральные индексы PSRI (для оценки соотношения каротиноидов и хлорофиллов), ARI (для оценки содержания антоцианов), ChlRI (для оценки содержания хлорофиллов) и BRI (степень развития побурения при повреждении) для использования с портативным оптоволоконным рефлектометром при полевых измерениях.
Работа выполнена при финансовой поддержке гранта РФФИ «Мобильность молодых ученых» 2009 г. (№ 09-04-90753).
Литература
1. Кизеев А.Н. Влияние промышленных загрязнений на состояние ассимиляционного аппарата сосны обыкновенной (Pinus sylvestris L.) на Кольском полуострове: автореф. дисс…канд. биол. наук (03.00.16, 03.00.05). – Петрозаводск, 2006. – 26 с.
2. Мерзляк М.Н., Гительсон А.А., Чивкунова О.Б., Соловченко А.Е., Погосян С.И. Использование спектроскопии отражения в анализе пигментов высших растений // Физиология растений. - 2003. – 50. – C. 785-792.
3. Соловченко А.Е., Чивкунова О.Б., Мерзляк М.Н., Решетникова И.В. Спектрофотометрический анализ пигментов в плодах яблони // Физиология растений. -2001. – 48. – C. 801-808.
4. Chivkunova O., Solovchenko A., Sokolova S., Merzlyak M., Reshetnikova I., Gitelson A. Reflectance spectral features and detection of superficial scald-induced browning in storing apple fruit // Russ. J. Phytopathol. - 2001. – 2. – P. 73–77.
5. Demmig-Adams B., Adams W. Photoprotection in an ecological context: the remarkable complexity of thermal energy dissipation // New Phytologist. - 2006. – 172. – P. 11-21.
6. Gitelson A.A., Merzlyak M.N., Chivkunova O.B. Optical properties and nondestructive estimation of anthocyanin content in plant leaves // Photochem. Photobiol. – 2001. – 74. – P. 38-45.
7. Gitelson A.A., Zur Y., Chivkunova O.B., Merzlyak M.N. Assessing carotenoid content in plant leaves with reflectance spectroscopy // Photochem. Photobiol. – 2002. – 75. – P. 272-281.
8. Gitelson A.A., Gritz Y., Merzlyak M.N. Relationships between leaf chlorophyll content and spectral reflectance and algorithms for non-destructive chlorophyll assessment in higher plant leaves // J. Plant Physiol. – 2003. – 160. – P. 271-282.
9. Gitelson A., Keydan G., Merzlyak M. Three-band model for noninvasive estimation of chlorophyll, carotenoids, and anthocyanin contents in higher plant leaves // Geophys. Res. Lett. – 2006. – 33. – L 11402.
10. Hoch W., Singsaas E., McCown B. Resorption protection. Anthocyanins facilitate nutrient recovery in autumn by shielding leaves from potentially damaging light levels // Plant Physiol. - 2003. – 133. – P. 1296-1305.
11. Karageorgou P., Manetas Y. The importance of being red when young: anthocyanins and the protection of young leaves of Quercus coccifera from insect herbivory and excess light // Tree Physiol. - 2006. – 26. – P. 613.
12. Lichtenthaler H. Chlorophyll and carotenoids: pigments of photosynthetic biomembranes // In Meth. Enzym. - 1987. – P. 331-382.
13. Merzlyak M., Gitelson A. Why and what for the leaves are yellow in autumn? On the interpretation of optical spectra of senescing leaves (Acer platanoides L.) // J. of Plant Physiol. – 1995. – 145. – P. 315-320.
14. Merzlyak M., Gitelson A., Pogosyan S., Lekhimena L., Chivkunova O. Light-induced pigment degradation in leaves and ripening fruits studied in situ with reflectance spectroscopy // Physiologia Plantarum. – 1998. – 104. – P. 661-667.
15. Merzlyak M., Gitelson A., Chivkunova O., Rakitin V. Non-destructive optical detection of pigment changes during leaf senescence and fruit ripening // Plant Physiol. – 1999. – 106. – P. 135-141.
16. Merzlyak M., Solovchenko A., Chivkunova O. Patterns of pigment changes in apple fruits during adaptation to high sunlight and sunscald development // Plant Physiol. et Biochem.. – 2002. – 40. – P. 679-684.
17. Merzlyak M., Solovchenko A., Gitelson A. Reflectance spectral features and non-destructive estimation of chlorophyll, carotenoid and anthocyanin content in apple fruit // Postharvest Biol. and Technol. – 2003. – 27. - P. 197-212.
18. Merzlyak M., Gitelson A., Chivkunova O., Solovchenko A., Pogosyan S. Application of reflectance spectroscopy for analysis of higher plant pigments // Russ. J. of Plant Physiol. - 2003. – 50. – P. 704-710.
19. Merzlyak M.N., Solovchenko A.E., Smagin A.I., Gitelson A.A. Apple flavonols during fruit adaptation to solar radiation: spectral features and technique for non-destructive assessment // J. Plant. Physiol. – 2005. – 162. – P. 151-160.
20. Merzlyak M.N. Modeling pigment contributions to spectral reflection of apple fruit // Photochem. Photobiol. Sci. – 2006. – 5. – P. 748-754.
21. Merzlyak M.N., Chivkunova O.B., Solovchenko A.E., Naqvi K.R. Light absorption by anthocyanins in juvenile, stressed, and senescing leaves // J. Exp. Bot. – 2008. – 59. – P. 3903-3911.
22. Merzlyak M.N., Melo T.B., Naqvi K.R. Effect of anthocyanins, carotenoids, and flavonols on chlorophyll fluorescence excitation spectra in apple fruit: signature analysis, assessment, modelling, and relevance to photoprotection // J. Exp. Bot. - 2008. – 59. – P. 349-359.
23. Solovchenko A., Chivkunova O., Merzlyak M., Gudkovsky V. Relationships between chlorophyll and carotenoid pigments during on-and off-tree ripening of apple fruit as revealed non-destructively with reflectance spectroscopy // Postharvest Biol. and Technol. – 2005. – 38. – P. 9-17.
24. Solovchenko A., Avertcheva O., Merzlyak M. Elevated sunlight promotes ripening-associated pigment changes in apple fruit // Postharvest Biol. and Technol. - 2006. – 40. – P. 183-189.
25. Steyn W.J., Wand S.J.E., Jacobs G., Rosecrance R.C., Roberts S.C. Evidence for a photoprotective function of low-temperature-induced anthocyanin accumulation in apple and pear peel // Physiologia Plant. - 2009. – 136. – P. 461-472.
26. Zeliou K., Manetas Y., Petropoulou Y. Transient winter leaf reddening in Cistus creticus characterizes weak (stress-sensitive) individuals, yet anthocyanins cannot alleviate the adverse effects on photosynthesis // J. Exp. Bot. - 2009. – 60. – P. 3031-3042.

