В статье представлены результаты химического эксперимента по выделению пигментов из растений и получению природных красителей и индикаторов. Рассмотрена возможность использования полученных красителей для окрашивания тканей и индикаторов для определения кислотности моющих средств.
Ключевые слова: растительные пигменты, растительные красители и индикаторы, хроматография
Окраска растений обусловлена содержанием в них различных пигментов. Растительные пигменты – это крупные органические молекулы, поглощающие свет определенной длины волны [1]. Одним из направлений применения растений, богатых пигментами, служит получение природных красителей и индикаторов.
Красители – органические соединения, обладающие способностью поглощать и преобразовывать световую энергию в ультрафиолетовой и инфракрасной областях спектра [4]. Растительные красители являются распространенным экологически безопасным и доступным сырьем.
Индикаторы – это химические вещества, окраска которых меняется в зависимости от рН среды [3]. Проблема получения индикаторов достаточно актуальна, так как природные индикаторы играют большую роль и широко используются при химических исследованиях. Преимуществом растительных индикаторов является дешевизна, быстрота и наглядность исследования.
Цель работы:изучить свойства растительных пигментов и выявить возможность их применения в качестве красителей и индикаторов.
Методы исследования:теоретические (анализ учебной и научно-популярной литературы), экспериментальные (химический эксперимент).
Организация исследования.На первом этапе был проведен анализ научно-популярной литературы по выбранной теме, который показал, что в растительных клетках обычно встречаются зеленые пигменты – хлорофиллы (рис. 1), желто-оранжевые – каротиноиды и разнообразные флавоноиды.
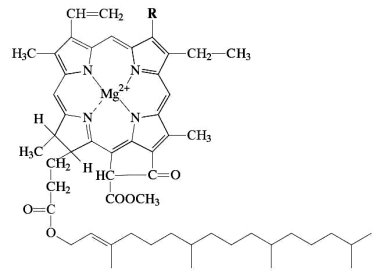
Рис.1. Структурная формула хлорофилла
Каждая из групп растительных пигментов представлена несколькими отличающимися по химическому строению, окраске и поглощению света пигментами. Например, к группе флавоноидов относят антоцианы, определяющие красную, синюю, фиолетовую окраску цветов; флавоны, флавонолы, ауроны и халконы — жёлтую и оранжевую. Пигмент группы флавоноидов кверцетин содержится в коре дуба (рис. 2), катехин – в листьях чая. Пигмент группы каротиноидов рубиксантин содержится в плодах шиповника (рис. 3.).
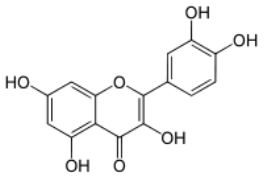
Рис. 2. Структурная формула кверцитина
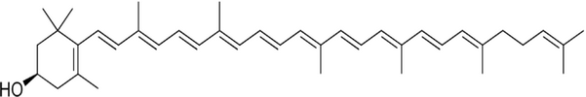
Рис.3. Структурная формула рубиксантина
Второй этап был связан с химическим экспериментом по получению природных индикаторов и красителей.
Технология получения красителей включает два основных процесса: извлечение красящих веществ и приготовление концентрированного красителя, который стабилен при хранении и пригоден для непосредственного использования. После того, как красители перешли в раствор, мы испытывали их способность к окрашиванию хлопчатобумажной ткани.
В результате окрашивания ткани растворами перечисленных растений получили следующие цвета: из шелухи лука – светло-коричневый, из корнеплодов свеклы – светло-бордовый, из ягод калины – светло-розовый, из коры дуба – желто-коричневый. Все полученные результаты представлены в таблице 1.
Таблица 1
Результаты окрашивания ткани полученными растительными красителями
|
Растение |
Используемая часть |
Цвет красителя на ткани |
|
Лук репчатый |
Сухие чешуи |
Темно-коричневый |
|
Свекла столовая |
Корнеплод |
Светло-бордовый |
|
Калина красная |
Ягоды |
Светло-розовый |
|
Дуб обыкновенный |
Кора |
Желто-коричневый |
|
Боярышник |
Кора |
Красно-коричневый |
|
Чистотел |
Листья и стебли |
Желто-зеленый |
|
Крапива |
Листья и стебли |
Серо-желтый |
|
Краснокочанная капуста |
Листья |
Сиреневый |
|
Черника |
Ягоды |
Фиолетовый |
|
Рябина черноплодная |
Ягоды |
Серо-синий |
|
Флокс белый |
Цветы |
Желто-зеленый |
В результате проведенного опыта убедились в том, что растительные красители способны длительное время удерживаться на ткани и не уступают по своим свойствам синтетическим красителем. Недостатком подобного окрашивания является получение не ярких, а светлых оттенков; получение зеленых красителей из растительного сырья является затруднительным; при стирке ткани в обычной воде она сильно линяет.
Природные индикаторы получали из свеклы, моркови, краснокочанной капусты, будры, тюльпана, чистотела, черного чая, луковой шелухи, боярышника и шиповника. Сначала навеску сырья массой 5-10 г погружали в экстрагент объемом 50 мл. Полученные экстракты фильтровали с помощью фильтровальной бумаги, и полученный фильтрат наливали в заранее подготовленную колбу. Для определения эффективности индикатора был использован универсальный буферный раствор, обладающий большой буферной емкостью (pH от 2 до 12) из H3PO4, CH3COOH, H3BO3, молярность 0,04 моль/л, концентрация кислот 100% [2].
К сожалению, из-за неустойчивости антоцианов их отвары быстро плесневеют и скисают, поэтому готовить такие индикаторы надо непосредственно перед работой с ними. Лучшими оказались индикаторы из краснокочанной капусты, будры и красного тюльпана. В растворе этих индикаторов наблюдался более выраженный переход из нейтральной среды в кислотную и щелочную. Более подробные результаты представлены в таблице 2.
Таблица 2
Результаты по приготовлению индикаторов
|
Растительный индикатор |
Изменение окраски индикатора в зависимости от среды | ||
|
Кислая |
Нейтральная |
Щелочная | |
|
Цветы будры плющевидной |
Розовый |
Светло-розовый |
Ярко-зеленый |
|
Цветы красного тюльпана |
Теплый розовый |
Светло-розовый |
Темно-зеленый |
|
Плоды боярышника |
Розово-красный |
Светло-розовый |
Сине-зеленый |
|
Плоды шиповника |
Светло-желто-розовый |
Светло-желтый |
Желтый |
|
Листья краснокочанной капусты |
Розово-красный |
Бледно-фиолетовый |
Зеленый |
|
Листья черного чая |
Желто-коричневый |
Оранжево-коричневый |
Коричневый |
|
Листья чистотела |
Светло-желтый |
Желтый |
Темно-желтый |
|
Корнеплод моркови |
Светло-желтый |
Светло-желтый |
Светло-желтый |
|
Корнеплод свеклы |
Малиновый |
Красный |
Желто-коричневый |
|
Луковая шелуха |
Светло-оранжевый |
Оранжевый |
Коричневый |
С помощью приготовленных индикаторов из краснокочанной капусты и боярышника определили среду распространенных моющих средств и выяснили, что стиральные порошки «Зифа» и «Лоск» имеют щелочную среду, а моющее средство «Ферри» слабощелочную (табл.3). При использовании средств для мытья посуды, имеющих щелочную среду, нарушается нормальная кислотная среда кожи рук, которая в норме имеет слабокислую среду рН=5,5.
Таблица 3
Изменение окраски индикаторов и красителей
|
Природный индикатор |
Изменение окраски индикатора | ||
|
Стиральный порошок «Зифа» |
Стиральный порошок «Лоск» |
Средство для мытья посуды «Фэри» | |
|
Краснокочанная капуста |
зеленый (щелочная среда) |
зеленый (щелочная среда) |
сине-зеленый (слабощелочная среда) |
|
Боярышник |
сине-зеленый (щелочная среда) |
сине-зеленый (щелочная среда) |
светло-зеленый (слабощелочная среда) |
Таким образом, при применении средств для мытья посуды необходимо использовать резиновые перчатки, защищающие кожу от действия на нее щелочной среды, которая разрушает кислотную мантию эпидермиса и вызывает кожные заболевания. Хотя на этикетках этих моющих средств производитель указывает, что они не оказывают вредного воздействия на кожу.
Также в ходе работы было проведено исследование содержания растительных пигментов в крапиве, краснокочанной капусте, свекле и моркови. Разделение растительных пигментов производили методом распределительно-сорбционной бумажной восходящей хроматографии, который основан на различии в коэффициентах распределения индивидуальных веществ между двумя фазами – органической и водной. В результате проведенного поэтапного эксперимента получили распределение отдельных пигментов на хроматографической бумаге (рис.4).
Ближе всех к старту находится желто-зеленое пятно хлорофилла в. Выше располагается пятно хлорофилла а, окрашенное в сине-зеленый цвет. Ещё дальше от старта расположился желто-коричневый след ксантофилла. Ближе всех к фронту растворителя подошел каротин, цвет пятна которого – желтый. Таким образом, каротиноиды, по сравнению с хлорофиллом, адсорбируются на фильтровальной бумаге хуже, поэтому передвигаются по ней дальше хлорофилла.
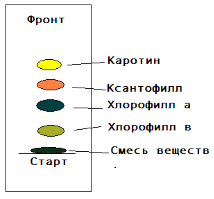
Рис.4. Распределение пигментов на хроматографической бумаге
В ходе проведенного исследования можно сделать следующие выводы:
Растительные пигменты - органические соединения, присутствующие в клетках и тканях растений и окрашивающие их. Они принадлежат к трем классам: хлорофиллы, каротиноиды и флавоноиды.
Используя растительные пигменты в качестве природных красителей, установили, что они являются пригодными для окраски тканей. При использовании растительных пигментов в качестве индикаторов было установлено, что они проявляют свойства кислотно-основного индикаторов и являются вполне «точными» определителями кислотности жидкостей.
Проведенный анализ растительных пигментов методом распределительной хроматографии показал, что спиртовая вытяжка листьев крапивы, краснокочанной капусты, корнеплодов свеклы и моркови содержит такие пигменты, как хлорофилл, каротин и ксантофилл.
Литература:
- Грищенко А. Игра цветов, или пигменты в нашей жизни / А. Грищенко, С.В. Кодацкая // Биология – Первое сентября. – 2010. – №6 [Электронный ресурс]. – URL: http://bio.1september.ru/view_article.php?ID=201000604 (дата обращения: 21.02.2015).
- Лурье Ю.Ю. Справочник по аналитической химии. – М.: Химия, 1989. – 448 с.
- Павлова С. Растительные индикаторы в школьной лаборатории / С. Павлова, В. Макарова, А.П. Петрова // «Проба пера». Естественные и математические науки: материалы VII школьной международной заочной научно-исследовательской конференции. – Новосибирск: СибАК, 2013. – С.161-168.
- Селиванов Е.В. Красители в биологии и медицине. – Барнаул: Азбука, 2003. – 40 с.

