Ключевые слова: кинетика реакции, борной кислоты, температура, скорость реакции
Химическая кинетика изучает химическую реакцию как процесс, протекающий во времении по определенному механизму [1–2]. Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий.
Различаются простые химические реакции, протекающие в одну стадию, и сложные реакции, протекающие через несколько стадий (т. е. являющиеся совокупностью простых реакций). В ходе химической реакции концентрации её участников изменяются. Исходные вещества (реагенты) расходуются, и концентрация их уменьшается, продукты образуются, их концентрация растет. При образовании промежуточных веществ, концентрация которых сначала возрастает, а затем уменьшается до нуля, то данная реакция является сложной.
Важнейшим понятием являются «скорость химической реакции» [3–4]. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Кинетической кривой называется зависимость концентрации какого-либо участника реакции от времени Изучение различных кинетических кривых показывает, что скорость уменьшения концентрации реагента со временем падает. Наблюдаемое падение скорости, очевидно, связано с уменьшением концентрации реагентов. Кинетические исследования подтверждают правильность этого предположения, выражаемого в наиболее общем виде с помощью закона действующих масс для скорости реакции. Как и любая функция, кинетическая кривая может быть задана в виде графика, таблицы или уравнения (аналитически).
В этой работе была выведена скорость реакции борной кислоты с различными концентрациями эквивалентно изменению времени
Экспериментальная часть:
- приготовим раствор борной кислоты (H3BO4) по концентрацию 4–10М. при температуре 25ᵒС.
- приготовим второй раствор, состоит из (HCl+NaF) по концентрацию 0.2М. при температуре 25ᵒС.
- Перемешаем растворы, которые приготовили друг с другом, каждому по 25мМ.
- После добавления смесь и перемешивание помещаем в перемешивающее устройство должны быть разработаны электродную систему при перемешивании непосредственно (Electrod System). В то время как поддержание стабильности температуры раствора с помощью термостата.
Результаты и обсуждения
Общее уравнение для расчета скорости взаимодействия борной кислоты:
Там, где концентрация соляной кислоты, хлорид натрия больше, чем концентрация борной кислоты и значительно ниже
[HCl]>> [H3BO4], [NaF]>> [H3BO4]
Для того, чтобы вычислить скорость уравнения реакции в зависимости от концентраций реагентов потребляется любой борной кислоты единицы изменения времени в час распределились следующим образом
![]() dt=
dt=![]() [HCl]a [NaF]b• [H3BO4]
[HCl]a [NaF]b• [H3BO4]
Где, K1= -K [HCl]a [NaF]b
![]() H3BO4]
H3BO4]![]()
dx/ dt =- K1 [X], dx/ x =- K1dt
dlnx = — K1dt
![]()
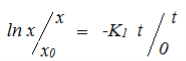
![]()
![]() Значить
Значить ![]()
![]() и
и![]()
Уравнение скорости: ![]()
Half lives t1/2= 0.693/K
Скорость и постоянная реакции борной кислоты рассчитывают в соответствии с таблицей (1), который дал значения скорости и постоянного взаимодействия различные значения и эти значения являются неожиданными, поскольку концентрация борной кислоты, которую получают из за исключением того, определяют, как тенденция в формах (1,2и3) были различны, было бы очевидно, что разные темпы значения констант взаимодействия а скорость взаимодействия
Таблица (1) принять к сведению, что лучшая скорость реакции были получены, когда концентрация кислоты борной в самой высокой концентрации контрастного половинного взаимодействия, чтобы взаимодействовать анизотропные значения в половине взаимодействия потребления материалов для продуктов, и это нам ясно, когда высокая концентрация борной кислоты была скорость взаимодействия — это высокоскоростной кинетическое взаимодействие, так как в литературе
Таблица 1
Зависимость период полураспада, скорости реакции иконстанты скорости реакции от концентрации (H3BO4)
|
концентрация |
константы скорости (K, час-1) |
t1/2 час |
скорости реакции, (моль час-1) |
|
1*10–4 |
1,02*10–3 |
6,82*10+2 |
2,96*1014 |
|
3*10–4 |
1,33*10–3 |
519,0157766 |
7,81*1023 |
|
1*10–3 |
7,4*10–4 |
929,91 |
9,59*1023 |
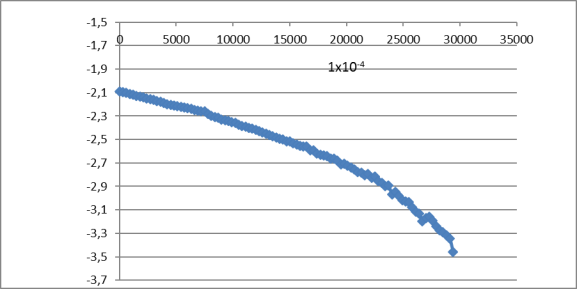
Рис. 1. Зависимость log [C∞-C] от времени реакции для концентрации (H3BO4 1х10–4)
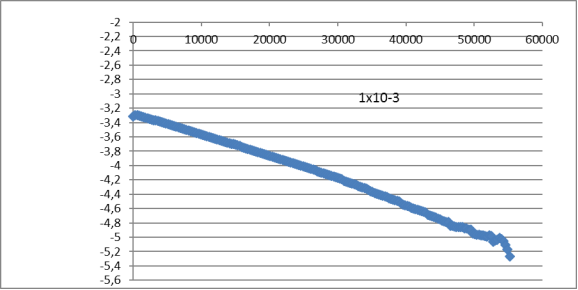
Рис. 2. Зависимость log [C∞-C] от времени реакции для концентрации (H3BO4 1х10–3)
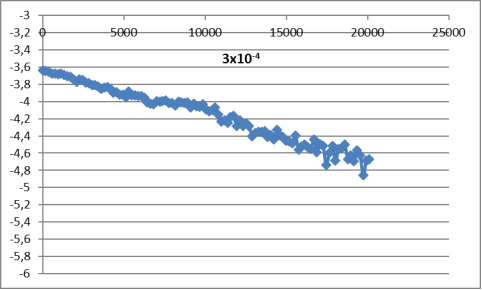
Рис. 3. Зависимость log [C∞-C] от времени реакции для концентрации (H3BO4 3х10–4)
Литература:
- Леванов. А. В., Антипенко Э. Е. Химическая кинетика//Московский государственный университет имени М. В. Ломоносова.-2006
- Marcus R. A. Recent Developments in Theoretical Chemical Kinetics //Journal of Chemical Education.-1968.-V. 45.-P. 356–358
- Колинько П. А., Козлов Д. В. Химическая кинетика в курсе физической химии//Новосибирск.- 2013
- Белоусова, Н. В. Химическая кинетика//Сибирский федеральный университет, 2009







