Представлены результатыэкспериментальных исследований криозаморозки половых гонад. При криоконсервации фрагментов тестикулярной ткани кроликов, с использованием разработанной нами криопротектора на основе глицерина и программного замораживания наблюдалась морфофункциональная сохранность и стероидогенный потенциал фрагментов тестисов.
Results of pilot studies of cryofreezing of sexual gonads are presented. At a cryopreservation of fragments of the testicular tissue of rabbits, with use developed by us a cryoprotector on the basis of glycerin and program freezing morphfunktsionaly safety and steroidogen potential of fragments of testis was observed.
Ключевые слова: криоконсервация, тестикулярная ткань, сперматогенез.
Keywords: cryopreservation, testicular tissue, spermatogenesis.
Введение. Одним из основных задач современной андрологии является сохранение и поддержание фертильности. Сперматогенный эпителий семенников крайне чувствителен к повреждающим факторам, в результате их воздействия, приводящие к ослаблению или прекращению сперматогенеза и атрофии эпителия.
Криоконсервация ткани и клеток мужских половых гонад в настоящее время является одним из прогрессивных методов сохранения фертильности. При различных патологических состояниях организма или длительной гормональной, лучевой и химиотерапии криоконсервация тестикулярной ткани позволяет значительно сохранить стероидогенный и сперматогенный потенциалы биологического материала, как объекта для дальнейшей трансплантации.
Цель исследования — изучить морфофункциональное состояние, стероидогенный и сперматогенный потенциалы криоконсервированной тестикулярной ткани.
Материалы иметоды исследования.
Материалом исследования служили фрагменты тестикулярной ткани от здоровых кроликов-самцов, половозрелого возраста с живой массой 3000–3500 г. После экстирпации семенники освобождали от оболочки и вырезали фрагменты 0,5–1см2. Исследуемый материал был разделен на следующие экспериментальные группы:
I группа — контроль, тестикулярную ткань после вырезки фиксировали в 10 % нейтральном парафине;
II группа — фрагменты тестикулярной ткани криоконсервировали без добавления криопротектора, тем самым вызывали искусственное повреждение клеток;
III группа — тестикулярную ткань замораживали с добавлением криопротектора, в качестве криопротектора использовали смесь с 10 % глицерином.
Работу проводили в соответствии с положением «Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1985).
Для заморозки использовали крипробирки, объем замораживаемого образца составлял 1 мл. Образцы замораживали на программном замораживателе CryoLogic с использованием программы CryoGenesis 4. Размораживали образцы на водяной бане при температуре 34–370С.
Для гистологического исследования фрагменты яичек фиксировали в 10 % нейтральном формалине, обезвоживали в спиртах восходящей концентрации, заливали в парафин и просветляли в ксилоле. На санном микротоме готовились срезы толщиной 6–7 микрон и окрашивали гематоксилином и эозином.
Результаты иобсуждения.
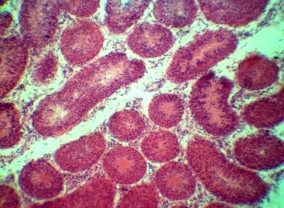
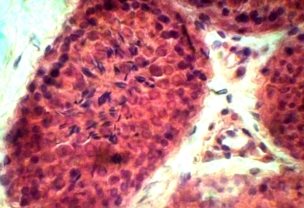
При морфологическом исследовании тестикулярной ткани контрольной I группы — паренхима состоит из извитых семенных канальцев, в строме находиться небольшое количество соединительной ткани, а также группы интерстициальных клеток (клетки Лейдига). Извитые семенные канальца выстланы сперматогенным эпителием. На базальной области находятся крупные клетки с гиперхромными ядрами — сперматогонии. Между ними располагаются клетки пирамидальной формы и вытянутые в просвет канальца — клетки Сертоли. Клетки Сертоли выполняют несколько существенных функций: выполняют барьерную функцию между половыми клетками и внутренней средой организма; обеспечивают питание половых клеток; участвует в образовании высокоспециализированной внутриканальцевой жидкости, обладающая фагоцитарной активностью и удаляющая дегенерированные и остаточные тельца. В базальной области обнаруживаются делящиеся митотическим образом сперматогонии, ближе к просвету канальцев в адлюминальной области определяются спрематоциты I и II порядков, за ними находятся сперматиды на различных этапах развития и зрелые сперматозоиды (рис 1. а, б).
а)б)
Рис 1. Извтые семенные канальца кроликов I группы.
Видны поперечные и косые срезы извитых семенных канальцев разделенных соединительной тканью, а также группы интерстициальных клеток. Видны клетки находящиеся на всех стадиях сперматогенеза. Окраска гематоксилином и эозином. х 120, 480.
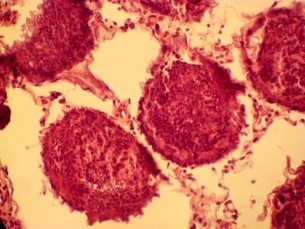
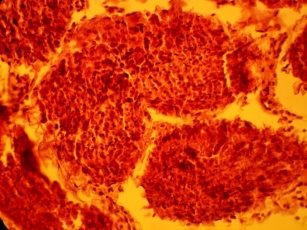
При морфологическом анализе II группы, криоконсервация без криопротектора, наблюдаются деструктивные изменения сперматогенного эпителия, выражяющиеся в хаотичности расположения клеток, разобщенности структур, семенные канальца не проявляются. Отмечаются набухщие сперматоциты первого и второго порядка. Клетки Сертоли плохо определяются. В строме отмечается отек паренхимы которая обусловлена нарушенем проницаемости. Видны интерстициальные клетки с пикнотическими ядрами (рис 2 а, б,).
а)б)
Рис 2. Извитые семенные канальца кроликов II группы. Окраска гематоксилином и эозином. Х 120, 480.
В III экмпериментальной группе исследования с использованием в качестве криопротектора 10 % глицерина и заморозки с помощью програмного замораживателя CryoLogic наблюдается общая сохранность морфологических структур сперматогенного эпителия схожая с I группой. Отмечаются клетки соответсвующие всем стадиям сперматогенеза, видна сохранность клеток Сертоли и сперматогенного эпителия.
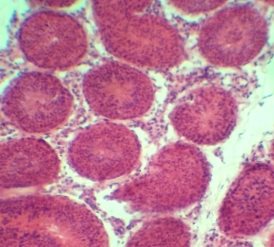
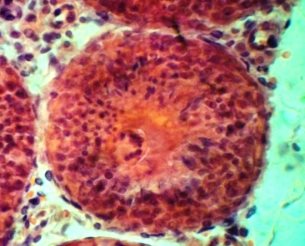
а)б)
Рис 3. Извитые семенные канальца кроликов III группы. Окраска гематоксилином и эозином. Х 120, 480.
Выводы.
При криоконсервации тестикулярной ткани с использованием 10 % глицерина и программного замораживателя наблюдается хорошая морфофункциональная сохранность и способностью к синтезу и секреции половых стероидов по сравнению с нативной тестикулярной тканью. Биологический материал фрагментов тестикулярной ткани криоконсервированный таким образом может быть использован в дальнейшем использован для коррекции и восстановлении фертильности.
Литература:
- Гистология/ под ред. Э. Г. Улумбекова, Ю. А. Челышева.-М.: ГЭОТАР, 1997.- 960 с.
- Ендовицкая И. П., Зиновьева Н. А., Эрнст Л. К. Динамика сперматогенеза у кроликов// Цитология.-2005.-Т.47.-С.44–48.
- Киселева А. Ф., Житников А, Я., Кейсевич Л. В. Морфофункциональные методы исследования в норме и патологии.-Киев: Здоровье, 1983.- С.164.
- Сперматогенез и его регуляция// Под ред. Л. В. Данилова.- М.: Наука, 1983.-С.232.

