Для аскорбата лития в дозе 1000 мг/кг получены фармакокинетические кривые для цельной крови и гомогенатов тканей 10 различных биосубстратов (головной мозг, лобная доля головного мозга, сердце, аорта, лёгкие, печень, почки, селезёнка, надпочечники, бедренная кость). В рамках бескамерного анализа динамики концентраций в цельной крови получены следующие значения фармакокинетических параметров аскорбата лития: Cmax=50.59 мкг/л, t max=1.50 ч, Clast=33.7 мкг/л, AUCt=1750 мкг/л*ч, MRTt=22.9 ч, Lz=0.005 1/ч, T1/2=141 ч, CL=0.029 л/ч, Vd=5.9 л. Концентрации лития в цельной крови и в лобной доли головного мозга оставались стабильными в течение, по крайней мере, 40-45 часов после прохождения пика концентрации. Многокамерный фармакокинетический анализ показал, что стабилизация уровней лития в крови и в головном мозге поддерживается за счёт специального «депо» лития, состоящего, вероятно, из надпочечников, аорты, бедренной кости и головного мозга.
Ключевые слова: аскорбат лития, бескамерная модель, многокамерное моделирование, фармакокинетика, биосубстраты
Ион лития характеризуется нормотимическим действием. Наиболее известной фармакологической формой лития является карбонат лития, использующийся в психиатрии для терапии биполярных расстройств [1], маниакального синдрома, игромании [2] и др. Однако, препараты на основе карбоната лития имеют существенные недостатки.
Во-первых, для результативного и безопасного применения этих препаратов требуется регулярно измерять концентрацию лития в крови, что влечет за собой дополнительные инвазивные процедуры [3]. Во-вторых, для карбоната лития характерен узкий терапевтический коридор концентраций лития в плазме — 0.6–1.2 ммоль/л. Концентрации Li+ в 1.5–2.5 ммоль/л ассоциированы со слабой токсичностью, 2.5–3.5 ммоль/л — с тяжелым отравлением, а превышение порога в 3.5 ммоль/л может быть опасным для жизни [4]. В-третьих, для достижения искомого терапевтического эффекта в психиатрии необходимо использование значительных дозировок карбоната лития (1-3 гр./сут., в остром периоде — до 9 г/сут), что, ввиду высокой токсичности карбоната лития, снижает привлекательность этой соли лития для назначения врачами [5].
Поэтому, для повышения безопасности литиевой терапии исследуются эффекты других солей лития. В частности аскорбат лития характеризуется низкой токсичностью (5-ый класс, LD50–6334 мг/кг, токсичность в 8.4 раза меньше, чем у карбоната лития) [6]. В то же время психоневрологическая эффективность аскорбата лития достигается при более низких дозировках (в 10-20 раз меньше суточной дозы карбоната лития) [7]. Установлены анксиолитический, антидепрессивный [8], нейропротекторный [9] и мнестический эффекты аскорбата лития [10].
Таким образом, полученные нами результаты позволяют утверждать, что препарат, созданный на основе аскорбата лития, будет достигать искомого терапевтического эффекта на существенно более низких дозировках, чем карбонат лития. Для более полной характеризации аскорбата лития как фармацевтической формы необходимо проведение фармакокинетических исследований, результаты которых позволят выявить особенности усвоения аскорбата лития организмом человека.
В настоящей работе представлены результаты комплексного экспериментального исследования фармакокинетики аскорбата лития в дозе 1000 мкг/кг. Выбор данной дозировки обусловлен тем, что эффекты органических форм лития достоверны уже при дозах в 30-100 мкг/кг (при приеме в течение 1-3 месяцев) [11]. Для исследования фармакокинетики и распределения лития в тканях было решено использовать однократное введение 10-кратной дозы от 100 мкг/кг, т. е. 1000 мкг/кг. Т. к. LD50 аскорбата лития составляет 6334 мг/кг [6], то доза в 1000 мкг/кг элементного лития достаточно далека от остро-токсичной.
Материалы иметоды.
В качестве модельного объекта были использованы самцы белых крыс линии Вистар массой 200–250 г (n=54, 9 групп по 6 животных в каждой). Все процедуры и опыты на крысах проводились в соответствии с международными правилами обращения с животными; исследование проводилось в соответствии с решением этического комитета ИвГМА от 24 марта 2016 г. Животные содержались в комнатах с одинаковыми условиями, в клетках по 6 крыс в каждой, при температуре 19–21°С. Животных ежедневно кормили комбикормом из расчета 40–50 г на особь.
Приготовление растворов. Зондирование проводилось раствором аскорбата лития, 1 мл которого содержал 250 мкг элементного лития. Для получения дозы 1000 мкг/кг животному массой 250 гр необходимо получить 250 мкг элементного лития, т. е. 1 мл раствора. Необходимый объём раствора рассчитывался исходя из массы животного. Для приготовления раствора использовался порошок дигидрата аскорбата лития. Молекулярная масса безводного аскорбата лития — 178 г/моль, дигидрата аскорбата лития — 214 г/моль. В дигидрате аскорбата лития литий и аскорбат-анион представлены в молярном соотношении 1:1, а в массовом соотношении 1:71.33. Таким образом, 250 мкг элементного лития содержится в 250*71.33=17.84 мг дигидрата аскорбата лития.
Проведение эксперимента. Проводилось зондирование раствором аскорбата лития в дозе 1000 мкг/кг (в расчете на элементный литий), затем проводился отбор групп в 9 временных точках — 0 мин, 45 мин, 1 ч, 1.5 ч, 3 ч, 6 ч, 12 ч, 24 ч, 48 ч. Методом масс-спектрометрии определялись уровни лития в 11 различных биосубстратах — цельная кровь, головной мозг, лобная доля головного мозга, сердце, аорта, лёгкие, печень, почки, селезёнка, надпочечники, бедренная кость.
Определение уровней лития. При определении уровней лития были получены гомогенаты тканей исследованных биосубстратов. Образцы гомогенатов отбирались в пластиковые пробирки и разбавлялись в 5 раз бидистиллированной и деионизированной водой. При проведении масс-спектрометрии, в качестве внутреннего стандарта в растворы вводили индий в концентрации 25 мкг/л. Калибровочные растворы были приготовлены из стандартных растворов фирмы VTRC с известным содержанием в диапазоне от 5–1000 мгк/л (10–7 %). Полученные растворы анализировались на масс-спектрометре с ионизацией в индуктивно-связанной плазме «Plasma Quad PQ2 Turbo» (VG Elemental, Англия). Рабочая мощность СВЧ генератора была 1,3 кВт. Расход плазмообразующего газа (аргон) 14 л/мин, расход транспортирующего газа 0,89 мл/мин. Проводилось от 3 до 10 экспозиций каждого образца, время интегрирования сигнала составило 60 сек. Данный метод признан наиболее точным и производительным и позволяет с высокой точностью проводить количественный анализ содержания 68 элементов периодической системы Д. И. Менделеева (в т. ч. лития) в различных биосубстратах.
Фармакокинетический анализ. Входе настоящего анализа был использованы методы многокамерного и бескамерного фармакокинетического анализа. Многокамерный анализ проводился посредством пакета SimBiology в составе программного комплекса MATLAB-2016 [12], а бескамерный анализ — с использованием электронных таблиц Excel, дополненных модулями программного пакета PKSolver [13].
Результаты.
В результате проведения фармакокинетического эксперимента были получены фармакокинетические кривые (ФК-кривые, т. е. зависимости концентраций от времени) для гомогенатов тканей различных органов (Рис. 1).
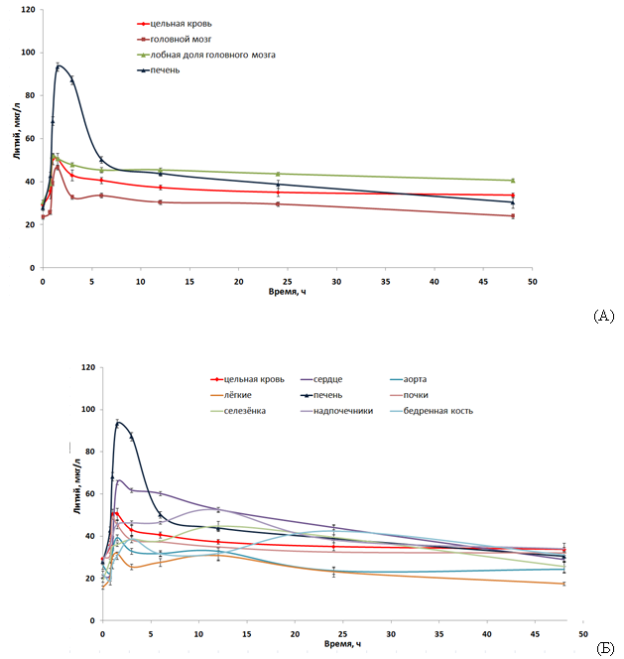
Рис. 1. Фармакокинетические кривые содержания лития в гомогенатах тканей после приема аскорбата лития в дозе 1000 мкг/кг (в расчете на элементный литий). (А) гомогенаты тканей головного мозга, цельной крови и печени, (Б) другие органы
ФК-кривые, полученные для различных биосубстратов, существенно отличаются по характеру и степени изменения концентраций лития во времени. Оценка «расстояния» между данными кривыми как среднеквадратичного отклонения кривых друг от друга позволило произвести кластеризацию ФК-кривых с использованием метода анализа метрических сгущений [14]. В результате кластеризации было установлено, что все ФК-кривые, за исключением ФК-кривых для печени, сердца и бедренной кости образуют единственный кластер (Рис. 2).
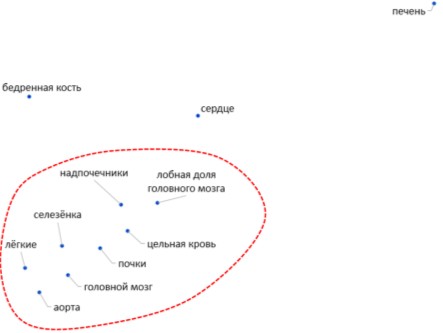
Рис. 2. Результаты кластеризации ФК-кривых для различных биосубстратов
Визуальный анализ ФК-кривых показывает, что в течение 1-2 часов после зондирования аскорбатом лития происходит интенсивное накопление лития во всех исследованных тканях. Максимальные пиковые концентрации лития (Cmax) отмечены именно в гомогенатах тканей печени и сердца, а минимальные — в гомогенатах лёгких и аорты.
Важно отметить, что концентрации лития в цельной крови и в лобной доли головного мозга оставались весьма стабильными в течение, по крайней мере, 40…45 часов после прохождения пика концентрации. Данное наблюдение может указывать, во-первых, на преимущественное накопление лития в цельной крови и в лобных долях при использовании аскорбата лития и, во-вторых, на поддержание концентраций лития в этих органах за счёт некоторого «депо» лития.
ФК-кривые аскорбата лития для 6 из 11 исследованных биосубстратов имели только один пик (tmax в районе 1-1.5 часов) с последующим медленным снижением концентрации лития (печень, головной мозг, лобная доля, цельная кровь, сердце, почки) происходящим, вероятно, вследствие выведения лития. Для 5 из 11 биосубстратов (надпочечники, селезенка, аорта, бедренная кость, лёгкие) ФК-кривые характеризовались присутствием второго, пологого пика концентраций лития, наблюдаемого через 10–20 часов после начала эксперимента (в случае бедренной кости — через 20-30 часов, Рис.). Можно предположить, что именно эти органы (надпочечники, селезенка, аорта, бедренная кость) и, также, головной мозг и образуют своего рода «депо» лития, которое способствует поддержанию стабильных концентраций лития в цельной крови и в головном мозге. Существование такого «депо» лития подтверждается результатами проведенного нами многокамерного фармакокинетического анализа.
Результаты многокамерного фармакокинетического анализа аскорбата лития.
Для многокамерного ФК-анализа была использована ФК-кривая для содержания лития в цельной крови (Рис. 3), т. к. анализ содержания препаратов в крови — основа фармакокинетического анализа. Данная кривая характеризуется выраженным пиком концентраций лития через 1-1.5 часа после зондирования и довольно пологим участком, указывающим на медленное выведение лития из крови.
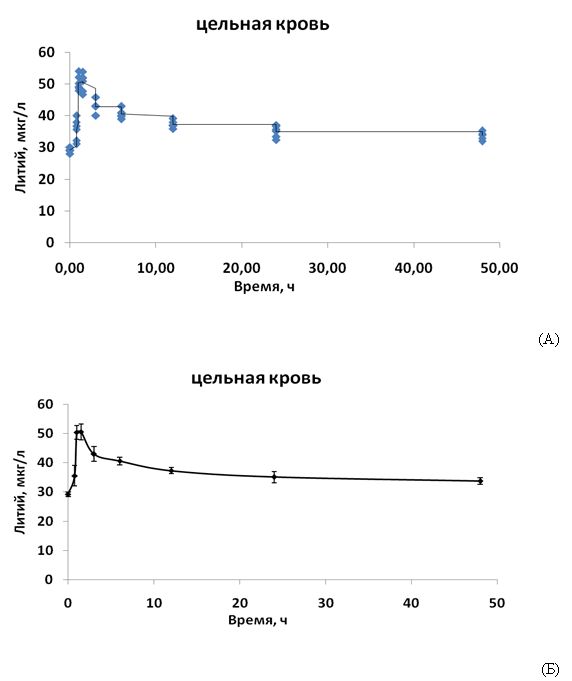
Рис. 3. Фармакокинетика уровней лития в цельной крови. (А) Исходные данные. (Б) Усреднённая ФК-кривая
Для получения наиболее адекватной многокамерной модели были исследованы одно-, двух-, трех- и четырех-камерные модели в различных конфигурациях. В результате моделирования было установлено, что самой простой моделью, наиболее точно описывающей исследуемую ФК-кривую (Рис. 3) является трехкамерная модель, включающая ЖКТ (1-ый компартмент), цельную кровь (центральный, 2-ой компартмент) и депо лития (3-ий компартмент), причём элиминация лития осуществляется из центрального компартмента, а не из депо (Рис. 4).
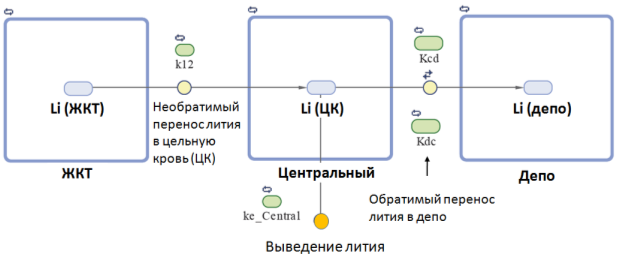
Рис. 4. Трехкамерная модель фармакокинетики аскорбата лития, полученная в результате многокамерного фармакокинетического моделирования в среде MATLAB. Приведены условные обозначения соответствующих констант (k12, Kcd, Kdc, Ke_central), использующиеся в тексте статьи
Качество исследованных многокамерных моделей характеризовалось значениями стандартного отклонения концентраций между теоретической и экспериментально полученной ФК-кривыми, а также коэффициентом корреляции между теоретическими и экспериментальными значениями концентраций лития в цельной крови (Рис. 5). Для полученной трёхкамерной модели, представленной на Рис. 4, значение среднеквадратичного отклонения концентраций составило a=3.4 мкг/л (при коэффициенте корреляции, равном 0.92), что указывает на приемлемое качество полученной модели.
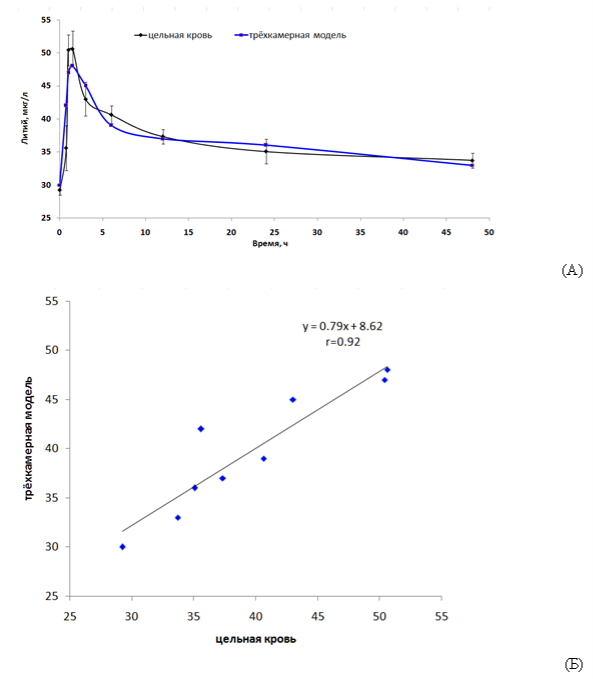
Рис. 5. Показатели качества трёхкамерной ФК-модели. (А) Экспериментально полученные точки ФК-кривой («цельная кровь») и теоретическая ФК-кривая («трёхкамерная модель»). Среднеквадратичное отклонение концентраций составило а=3.4 мкг/л. (Б) Корреляция между теоретическими и экспериментальными значениями концентраций лития. Коэффициент корреляции r=0.92
Полученная модель является оптимальной по качеству и сложности. Более простые многокамерные ФК-модели характеризовались гораздо более низким качеством. Более сложные модели не приводили к существенному повышению качества модели.
Например, удаление компартмента «депо» из модели на Рис. 4 приводило к существенному повышению среднеквадратичного отклонения концентраций (a=10 мкг/л), также как и удаление компартмента «ЖКТ» (a=15 мкг/л). Моделирование процесса элиминации только из депо также резко снижало качество модели (a=5.6 мкг/л), в то время как моделирование элиминации и из депо, и из центрального компартмента не улучшало качество модели (a=3.5 мкг/л). Включение в модель процесса обмена между депо и ЖКТ также снижало качество модели (a=4.5 мкг/л).
Таким образом, трёхкамерная модель фармакокинетики аскорбата лития, в которой раствор соли переходит из ЖКТ в центральный компартмент (цельную кровь), затем — в депо, а элиминация происходит только из центрального компартмента (Рис. 4) является наиболее адекватной из исследованных многокамерных моделей. ФК моделирование позволило получить количественные оценки соответствующих констант скорости и объёмов компартментов (Таблица 1).
Таблица 1
Параметры полученной трёхкамерной модели фармакокинетики аскорбата лития. Среднеквадратичное отклонение концентраций— 3.4 мкг/л, коэффициент корреляции— 0.92
|
Параметр |
Ед. |
Значение |
Расшифровка |
|
V(GI) |
у.е. |
1.00 |
Объём компартмента «ЖКТ» |
|
V(C) |
у.е. |
4.40 |
Объём центрального компартмента |
|
V(D) |
у.е. |
1.81 |
Объём компартмента «депо» |
|
k12 |
1/ч |
0.67 |
Константа переноса из ЖКТ в цельную кровь |
|
ke_Central |
1/ч |
0.0068 |
Константа элиминации из цельной крови |
|
Kcd |
1/ч |
0.41 |
Константа переноса из цельной крови в депо |
|
Kdc |
1/ч |
0.27 |
Константа переноса из депо в цельную кровь |
Таким образом, моделирование показало, что объем депо составляет примерно половину от объема центрального компартмента (т. е. цельной крови, см. Таблица 1). Аскорбат лития достаточно быстро переносится из ЖКТ в кровь (k12=0.67 1/ч) и весьма медленно удаляется из цельной крови (что соответствует малому значению константы ke_Central=0.0068 1/ч). Скорость обмена лития между кровью и депо сравнима со скоростью переноса из ЖКТ в кровь, причем перенос лития из цельной крови в депо (Kcd=0.41 1/ч) осуществляется несколько быстрее, чем обратный процесс переноса лития из депо в цельную кровь (Kdc=0.27 1/ч).
К сожалению, имеющиеся ФК-данные не позволяют сделать количественно достоверных выводов о том, какие же именно органы составляют «депо» лития. Однако, сравнение динамики концентраций лития в депо, полученном в результате моделирования, с динамикой концентрации лития в «депо», состоящем из головного мозга, аорты, надпочечников и бедренной кости указывает на определенную схожесть изменения концентраций (Рис. 6). Очевидно, что депо, состоящее из этих органов, по крайней мере, позволяет стабилизировать концентрации лития после первых 10...15 часов эксперимента.
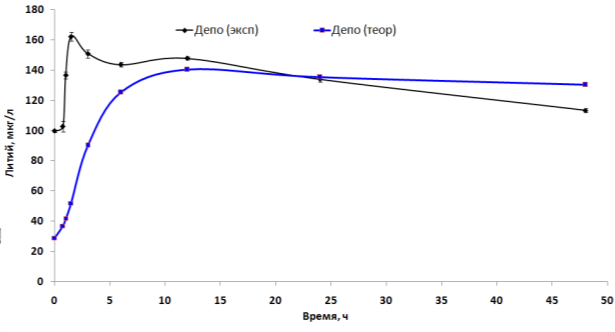
Рис. 6. Динамика концентраций в «депо» лития, полученном в результате многокамерного ФК-моделирования. Экспериментальные данные для «депо» были получены суммированием содержания лития в головном мозге, аорте, надпочечниках и бедренной кости
Бескамерный фармакокинетический анализ аскорбата лития.
Бескамерный анализ позволяет охарактеризовать такие повсеместно используемые ФК параметры препарата как площадь под кривой, клиренс, период полувыведения, время и максимальное значение достигаемой концентрации tmax, Cmax, объем распределения и др. (Таблица 2). Параметры бескамерной модели были рассчитаны для всех исследованных биосубстратов на основании соответствующих ФК-кривых (Таблица 3).
Таблица 2
Изученные фармакокинетические параметры бескамерной модели аскорбата лития
|
Параметр |
Ед. |
Комментарий |
|
Cmax |
мкг/л |
Максимальная концентрация лития в биосубстрате |
|
tmax |
ч |
Время достижения максимальной концентрации |
|
Clast |
мкг/л |
Последняя измеренная концентрация лития |
|
AUCt |
мкг/л*ч |
Площадь под кривой (характеризует биодоступность) |
|
MRTt |
ч |
Среднее время удержания — среднее общее время ионы лития препарата проводят в биосубстрате после приема аскорбата в заданной дозе |
|
Lz |
1/ч |
Наклон участка финального выведения (последние 3..4 точки ФК-кривой) |
|
T1/2 |
Ч |
Период полувыведения — время, за которое из биосубстрата выводится половина ионов лития |
|
CL |
л/ч |
Клиренс — объем биосубстрата, из которого все ионы лития удаляются за единицу времени |
|
VD |
Л |
Объем распределения — отношение общего содержания вещества в организме к его концентрации в исследуемом биосубстрате, т. е. некий условный объем, в котором должно было бы распределиться данное вещество, если бы его концентрация везде была такой же, как в биосубстрате |
Полученные в рамках бескамерного анализа значения ФК параметров аскорбата лития подтверждают сделанные выше выводы. Во-первых, время достижения максимума (tmax) составило 1–1.5 ч для большинства биосубстратов (за исключением селезёнки, надпочечников и бедренной кости, в которых tmax=12…24 ч).
Во-вторых, наиболее стабильно литий накапливается именно в лобной доле (Clast=40.5 мкг/л — самое высокое значение концентрации через 48 ч среди исследованных биосубстратов). Этот вывод подтверждает и значение площади под кривой: значение AUCt для лобной доли составило 2094 мкг/л*ч, в то время как, например, для печени (в который были отмечены наиболее высокие пиковые концентрации лития) — 2031 мкг/л*ч. Литий эффективно накапливался также в сердце (AUCt=2123 мкг/л*ч) и в надпочечниках (AUCt=1969 мкг/л*ч).
В-третьих, низкое значение наклона участка финального выведения (Lz) и высокое значение периода полувыведения (Т1/2) были характерны для всех биосубстратов, особенно для цельной крови (Lz=0.005 1/ч, Т1/2=141 ч), головного мозга, в т. ч. лобной доли (Lz=0.007 1/ч, Т1/2=210 ч), почек (Lz=0.004 1/ч, Т1/2=179 ч) и бедренной кости (Lz=0.002 1/ч, Т1/2=451 ч). Накопление лития в лобной доле и в кости подтверждается наиболее низкими значениями клиренса именно для этих биосубстратов (лобная доля — CL=0.017 л/ч; бедренная кость — CL=0.011 л/ч). Таким образом, аскорбат лития способствует поддержанию стабильных концентраций иона лития в цельной крови и в головном мозге, что важно для осуществления профилактического и терапевтического потенциала лития.
Таблица 3
Значения фармакокинетические параметры бескамерной модели аскорбата лития при введении вдозе 1000 мкг/л
|
Биосубстрат |
Cmax, мкг/л |
tmax, ч |
Clast, мкг/л |
AUCt, мкг/л*ч |
MRTt, ч |
Lz, 1/ч |
T1/2, ч |
CL, л/ч |
Vd, л |
|
цельная кровь |
50.59 |
1.50 |
33.71 |
1750 |
22.9 |
0.005 |
140.65 |
0.029 |
5.91 |
|
головной мозг |
46.51 |
1.50 |
23.99 |
1406 |
22.2 |
0.007 |
96.71 |
0.053 |
7.34 |
|
лобная доля |
51.94 |
1.00 |
40.51 |
2094 |
23.3 |
0.003 |
209.71 |
0.017 |
5.27 |
|
сердце |
65.40 |
1.50 |
28.98 |
2123 |
20.6 |
0.017 |
40.87 |
0.065 |
3.85 |
|
аорта |
39.20 |
1.50 |
24.22 |
1300 |
22.2 |
0.008 |
89.62 |
0.056 |
7.30 |
|
лёгкие |
31.82 |
1.50 |
17.47 |
1144 |
21.3 |
0.010 |
66.59 |
0.089 |
8.51 |
|
печень |
93.39 |
1.50 |
30.41 |
2031 |
20.3 |
0.018 |
38.91 |
0.067 |
3.75 |
|
почки |
48.85 |
1.00 |
32.02 |
1625 |
23.1 |
0.004 |
179.31 |
0.025 |
6.53 |
|
селезёнка |
44.73 |
12.00 |
25.56 |
1749 |
21.7 |
0.009 |
73.65 |
0.056 |
5.95 |
|
надпочечники |
52.47 |
12.00 |
33.95 |
1969 |
22.0 |
0.008 |
84.48 |
0.041 |
4.99 |
|
бедренная кость |
42.43 |
24.00 |
31.10 |
1710 |
23.9 |
0.002 |
451.44 |
0.011 |
7.41 |
Заключение.
Проведено комплексное экспериментальное исследование фармакокинетики аскорбата лития (в дозе 1000 мкг/кг). Получены фармакокинетические кривые для цельной крови и гомогенатов тканей 10 различных биосубстратов (головной мозг, лобная доля головного мозга, сердце, аорта, лёгкие, печень, почки, селезёнка, надпочечники, бедренная кость). Многокамерный фармакокинетический анализ показал, что стабилизация уровней лития в крови и в головном мозге поддерживается за счёт специального «депо» лития, состоящего, вероятно, из надпочечников, селезёнка, аорты, лёгких и бедренной кости. Концентрации лития в цельной крови и в лобной доли головного мозга оставались весьма стабильными в течение, по крайней мере, 40…45 часов после прохождения пика концентрации. Полученные в рамках бескамерного анализа значения ФК параметров аскорбата лития подтверждают сделанные выше выводы и показывают, что аскорбат лития способствует поддержанию стабильных концентраций иона лития в крови и в головном мозге, что важно для осуществления профилактического и терапевтического потенциала лития.
Литература:
- Chang C. M., Wu C. S., Huang Y. W., Chau Y. L., Tsai H. J. Utilization of Psychopharmacological Treatment Among Patients With Newly Diagnosed Bipolar Disorder From 2001 to 2010. J Clin Psychopharmacol. 2016; 36 (1):32–44.
- Pallanti S., Quercioli L., Sood E., Hollander E. Lithium and valproate treatment of pathological gambling: a randomized single-blind study. J Clin Psychiatry. 2002; 63(7):559–564.
- Baumgartner A., Pinna G., Hiedra L., Gaio U., Hessenius C., Campos-Barros A., Eravci M., Prengel H., Thoma R., Meinhold H. Effects of lithium and carbamazepine on thyroid hormone metabolism in rat brain. Neuropsychopharmacol 1997; 16(1):25–41.
- El-Balkhi S., Megarbane B., Poupon J., Baud F. J., Galliot-Guilley M. Lithium poisoning: is determination of the red blood cell lithium concentration useful? Clin Toxicol (Phila). 2009; 47 (1):8–13.
- Kandil E., Dackiw A. P., Alabbas H., Abdullah O., Tufaro A. P., Tufano R. P. A profile of patients with hyperparathyroidism undergoing lithium therapy for affective psychiatric disorders. HeadNeck. 2011; 33 (7):925–7.
- 6.Остренко К. С.; Сардарян И. С. Определение острой токсичности аскорбата лития при пероральном введении у крыс линии Вистар. Международная заочная научно-практическая конференция «Вопросы образования и науки», Россия, Тамбов, 31 декабря 2015 г.ISSN 2411–7609.
- К. С. Остренко, В. В. Расташанский. Влияние различных доз композиции аскорбата лития, пиридоксина гидрохлорида и тиамина мононитрата на нервно-психическое возбуждение и адаптивную активность у крыс. Scienceandworld. 2016. № 1 (29). Vol. II. р. 104–105, ISSN 2308–4804.
- Остренко К. С., Колоскова Е. М. Антидепрессивный эффект аскорбата лития в экспериментальной модели стресса у крыс. Вестник науки и образования, 1 (13), 2016, ISSN 2312–8089.
- Демидов В. И., Остренко К. В., Жидоморов Н. Ю., Громова О. А., Торшин И. Ю., Кривоногов В. А., Карпунина Ю. В. Эффективность аскорбата лития для профилактики и лечения хронической алкогольной интоксикации и алкогольной демиелинизации. Ж. Неврологии и психиатрии им. СС. Корсакова. Подано в печать, 2016.
- «Способ улучшения памяти аскорбатом лития» заявка 2016114064 на патент РФ.
- Гоголева И. В. Влияние органических солей лития, магния, селена на элементный гомеостаз головного мозга на фоне экспериментальной хронической двусторонней окклюзии общих сонных артерий. Дисс. к. м. н. по ВАК 14.00.25, 2009, ИвГМА, 119 с.
- FerreiraA. J. M. (2009). MATLAB Codes for Finite Element Analysis. Springer. ISBN 978–1–4020–9199–5. http://www.mathworks.com/products/simbiology/
- Zhang Y., Huo M., Zhou J., Xie S. PKSolver: An add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel. Comput Methods Programs Biomed. 2010 Sep;99(3):306–14.
- I. Y. Torshin, K. V. Rudakov. On Metric Spaces Arising During Formalization of Problems of Recognition and Classification. Part 2: Density Properties. Pattern Recognition and Image Analysis, 2016, Vol. 26, № 3, pp. 483–496, ISSN 1054–6618.

