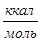Известно, что для выяснения структурных особенностей полимеров часто проводятся исследования сорбции паров воды. Пары воды являются активным сорбатом по отношению ко многим полимерным материалам, что особенно ярко проявляется в полимерах с гидрофильными группами и, в определенной степени, играет роль и пористость ионита. Механизм образования пористой структуры полимеров определяется, главным образом, природой порообразователя (инертного растворителя), тогда как сшивающий агент обеспечивает устойчивость образованной пористой структуры по отношению к смене или удалению растворителя. Механизм образования пористой структуры зависит также от природы растворителя и количества сшивающего агента. Влияние количества сшивающего агента, инертного растворителя и др. факторов подробно изучено на примере синтеза сополимеров стирола с рядом дивинильных мономеров.
Нами изучено влияние количества сшивающего агента ГТТ на удельную поверхность (Sуд), суммарный объем пор (W0) и радиус пор (rk) сополимеров акрилонитрила с ГТТ.
Для расчета удельной поверхности сорбентов, для которых характерны S-образные изотермы сорбции, использовали уравнение БЭТ.
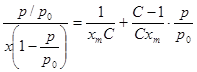 (1)
(1)
где p- равновесное давление пара сорбата над сорбентом;
p0- давление насыщенного пара сорбата при той же температуре;
x- количество сорбированного вещества, г/г;
xm- количество вещества в сплошном моно молекулярном слое, г/г;
C- постоянная, представляющая отношение времени жизни молекул в первом слое и жидкости соответственно.
Согласно уравнения (1), зависимость p/x(p0-p) от р/р0 выражается прямой линией, по тангенсу угла наклона которой S-отрезку I, отсекаемому прямой на оси ординат, можно рассчитывать величина xmи С:
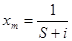
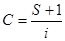 (2)
(2)
Удельная поверхность S (м2·r-1) связана с емкость монослоя уравнением
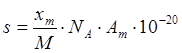 (3)
(3)
где М-молекулярная масса адсорбата;
NA-число Авагадро (6,02·1023моль-1);
Am –площадь поперечного сечения молекул адсорбата (А2), т. е. площадь которую адсорбированная молекула занимает на поверхности твердого тела в заполненном монослое.
Amподсчитывается по уравнению:
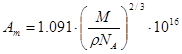 ,
, 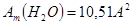
где М- молекулярная масса сорбируемого вещества, г/моль;
ρ- его плотность, г/см3;
суммарной объем пор W0 (см3/г) вычисляется по уравнению:
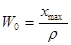
где хmах — количество максимально сорбированного веществ, г/г;
ρ- его плотность, г/см3;
средний размер пор (Å) определяется соотношением
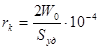
Если пренебречь адсорбцией на стенках, то х1/ ρ было бы равно объему  всех пор, имеющих радиусы до r1 включительно. Согласно гипотезе капиллярной конденсации, все эти поры будут заполнены, когда относительное давление достигает значения р1/р0, которое выражается “уравнением Кельвина”:
всех пор, имеющих радиусы до r1 включительно. Согласно гипотезе капиллярной конденсации, все эти поры будут заполнены, когда относительное давление достигает значения р1/р0, которое выражается “уравнением Кельвина”:
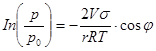
где  -поверхностное натяжение, дин·см-1;
-поверхностное натяжение, дин·см-1;
V-молярной объем жидкости, см3·моль-1;
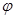 -краевой угол мениска жидкости со стенками капилляра.
-краевой угол мениска жидкости со стенками капилляра.
Отрицательно знак свидетельствует о том, что ρ будет меньше p0, если краевой угол меньше 900. При 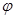 =0, т. е. что жидкость смачивает стенки пор, уравнением Кельвина при этом приобретает следующий вид:
=0, т. е. что жидкость смачивает стенки пор, уравнением Кельвина при этом приобретает следующий вид:
ln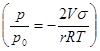
Это позволяет для данной жидкости непосредственно рассчитать значение радиуса цилиндра r1 соответствующее заданному значению р1/р0 или, наоборот, значение относительного давления, соответствующее заданному радиусу.
Теплота чистой адсорбции Еадс (ккал·моль-1) вычисляется по уравнению:
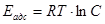
При этом предполагается, что молекула во всех слоях после первого рассматривается как совершенно эквивалентные, а число адсорбированных молярных слоев становится бесконечным, когда достигается давление насыщенного пара, а также пренебрегается членом 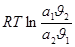 в уравнении:
в уравнении:
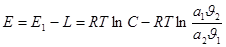
где Е1-энергия активации десорбции;
L-скрытая теплота конденсации;
a1, a2 -коэффициенты конденсации молекул газовой фазы на молекулах первого и второго слоях соответственно;
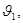
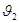 - частоты колебаний молекул в первом и втором слоях соответственно;
- частоты колебаний молекул в первом и втором слоях соответственно;
Поэтому значение Еадс имеет приближенный характер.
Сорбцию паров воды изучали при 298 К на вакуумной сорбционной установке Мак-Бена с пружинными весами. Остаточное давление (10–3 тор) контролировали ионизационным термовакуумметром ВИТ-3М. Привес образцов и разность уровней в коленах U-образного манометра измеряли при помощи катетометра КМ-6 с точностью 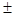 0,02 мм.
0,02 мм.
На рис. 1 приведена зависимость степени сорбции от количества порообразователя толуола.
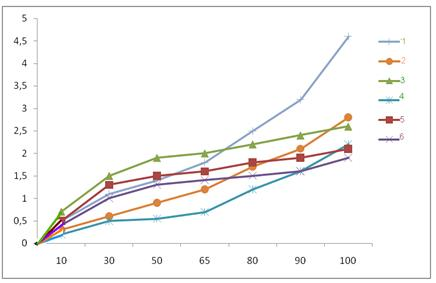
Рис. 1. Изотермы сорбции паров воды сополимерами
АН:ГТТ, полученных в присутствии толуола.
1-после гидролиза; 2- ДЭА 30 %; 3- Сополимер модифиц. ГА;
4- ДЭА 10 %; 5- АН:СА (95:5) (гелевый образец) и 6- 30 % толуола соответственно сополимеры:
Как видно из рис. 11 ход изотерм сорбции гелевого и пористых сополимеров с различной добавкой толуола резко отличаются между собой пористостью по сравнению остальных образцов, а добавка 10 % толуола фактически не приводила к заметным качественным изменениям в структуре сополимера. Результаты определения поровой характеристики сополимеров приведены в табл. 1.
Таблица 1
Поровые характеристики сополимеров, полученных в присутствии различных количеств порообразователя толуола
|
Образец |
Ёмкость монослоя, Хm, г/г |
Удельная поверхность, Sуд, м2/г |
Суммарный объем пор, W0, см3/г |
Средний радиус пор, rk, Å |
|
АН:СА (95:5)* |
0.0142 |
49.80 |
0.021 |
8.43 |
|
Сополимер модифиц. ГА, |
0,0135 |
47,55 |
0,026 |
10,93 |
|
30 % толуола |
0.0058 |
20,55 |
0,019 |
18,49 |
|
ДЭА 10 % |
0.0052 |
18,38 |
0,022 |
15,55 |
|
ДЭА 30 % |
0.0052 |
51,70 |
0,028 |
10,83 |
|
После Гидролиза |
0.0102 |
36,03 |
0,046 |
25,53 |
*-гелевый образец
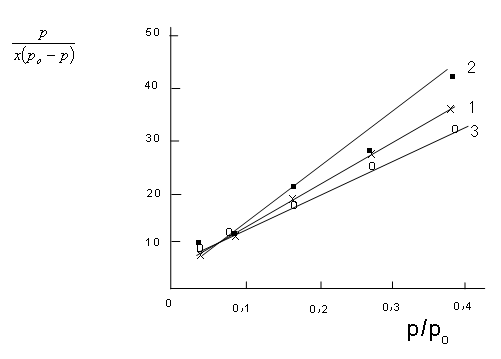
Рис. 2. Изотермы адсорбции водяного пара в координатах уравнения БЭТ образцами сополимеров АН с ГТТ. 1, 2, 3 –соответственно гелевый образец, 10 и 30 % толуола
На рис. 2 представлены зависимости 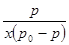 от р/родля сополимеров АН с ГТТ, полученных в присутствии различных количеств толуола.
от р/родля сополимеров АН с ГТТ, полученных в присутствии различных количеств толуола.
Как видно из рис. 2 изотермы адсорбции паров воды в координатах уравнения БЭТ зависимость 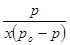 от
от 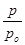 имеет прямолинейный характер в области низких давлений. Это подтверждает применимость уравнения БЭТ для характеристики изотерм сорбции водяного пара сополимерами АН с ГТТ.
имеет прямолинейный характер в области низких давлений. Это подтверждает применимость уравнения БЭТ для характеристики изотерм сорбции водяного пара сополимерами АН с ГТТ.
На основании изотерм сорбции были рассчитаны поровые характеристики сополимеров, которые приведены в таблице 2.
Таблца 2
Поровые характеристики сополимеров АН с ГТТ, полученных в различных условиях
|
Образец |
S |
i |
C |
xm, г/г |
Sуд м2/г |
W0, cм3/г |
rk, Å |
Еадс, |
|
АН:СА (95:5)* |
93,42 |
10,5 |
8,90 |
0,0142 |
49,80 |
0,021 |
8,43 |
1,294 |
|
Сополимер модифиц. ГА, |
118,95 |
6,8 |
17,49 |
0,0135 |
47,55 |
0,026 |
10,93 |
1,693 |
|
30 % толуола |
79,21 |
4,9 |
16,17 |
0,0058 |
20,55 |
0,019 |
18,49 |
1,647 |
|
ДЭА 10 % |
92,69 |
5,9 |
15,71 |
0,0052 |
18,38 |
0,022 |
15,55 |
1,630 |
|
ДЭА 30 % |
83,85 |
3,2 |
26,20 |
0,0052 |
51,70 |
0,028 |
10,83 |
1,932 |
|
После гидролиза |
75,0 |
5,5 |
13,64 |
0,0102 |
36,03 |
0,046 |
25,53 |
1,546 |
*-гелевый образец
Данные показывают, что суммарный объем пор увеличивается с увеличением количества порообразователя. Для значений средних радиусов пор не наблюдается отчетливая закономерность.