Введение
Тяжелые металлы — хорошо известные загрязнители окружающей среды из-за их токсичности, стойкости в окружающей среде и биоаккумуляционной природы. Среди тяжелых металлов свинец является элементом, потенциально токсичным для практически всех органов человеческого чела. Свинец может быть токсичным для сердечно-сосудистой, репродуктивной, пищеварительной, нервной и почечной систем, подавлять активность некоторых ферментов, участвующих в биосинтезе гемоглобина, и сокращать продолжительность жизни эритроцитов. Поэтому исследование по определению Pb(II) необходимо для охраны здоровья населения.
На сегодняшний день существует множество методов определения ионов металлов, в которых вольтамперометрия представляет собой метод с высокой чувствительностью и точностью, позволяющий определять следовые количества и ультраследовые количества металлов с помощью недорогого и простого в использовании оборудования. В методе вольтамперометрия в качестве рабочего электрода часто используется ртутный электрод. Тем не менее из-за высоко токсичного потенциала ртути и ее солей было проведено множество исследований по поиску новых, менее токсичных электродов для замещения ртутного электрода.
Материалы из ферромагнитного оксида/восстановленного оксида графена были синтезированы и модифицировали электроды для идентификации органических веществ, таких как аскорбиновая кислота, дофамин, мочевая кислота [1, 2], и родамин B [3]. Применение материалов Fe 3 O 4 /rGO в основном основано на большой площади поверхности, пористости, малом размере частиц, магнитных и электрохимических свойствах материала.
Цель настоящей работы — определение ионов Pb(II) в воде электрохимическим методом с использованием стеклянного угольного электрода, модифицированного Fe 3 O 4 /rGO.
Экспериментальная часть
Fe 3 O 4 /rGO были синтезированы и диспергированы на стеклянном угольном электроде (GC)по методике [3].
Электрохимическую природуионов Pb(II) исследовали путем сканирования циклического потенциала от -0,95 В до -0,20 В со скоростью развертки потенциала 0,1 В/с в растворе 500 ppb Pb(II) + 0,1 М ацетатного буфера, pH 6, на электродах: GC и Fe 3 O 4 /rGO/GC. Для определения роли Н + в электродной реакции Pb(II) рН раствора при измерении изменяли от 4 до 7. При этом для определения лимитирующей стадии и количества электронов, скорость развертки потенциала изменяли от 0,05 В/с до 0,3 В/с.
Концентрацию ионов Pb(II) определяли дифференциальной импульсной вольтамперометрии (DPV) на электроде Fe 3 O 4 /rGO/GC при условии: амплитуда модуляции: 0,03 В; потенциальное обогащение -0,8 В; время обогащения 90 с; степ: 0,015 В. Уравнение стандартной кривой строили методом линейной регрессии. Повторяемость измерения DPV оценивалась при концентрациях Pb(II) 1 ppb, 50 ppb и 100 ppb. Каждый сигнал измеряется 9 раз. Относительное стандартное отклонение (RSD) определяется по формуле:
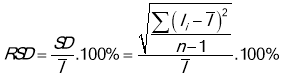
где SD: стандартное отклонение измерения; I
i
,
Предел обнаружения (LOD) рассчитывали по формуле:
LOD = 3 SD/a(2)
где a — наклон линейного уравнения.
Обсуждение результатов
1. Электрохимическая природа Pb(II) на электроде Fe 3 O 4 /rGO/GC
Кривы циклические вольтамперограммы (ЦВА) в растворе Pb(II) на электродах: GC и Fe 3 O 4 /rGO/GC показаны на рис. 1.
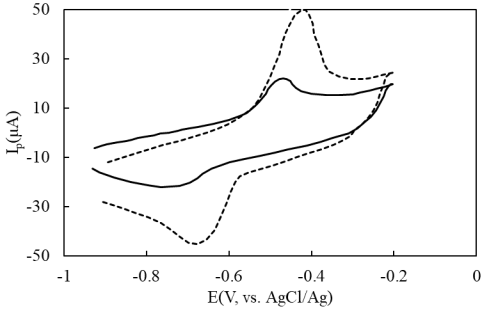
Рис. 1. ЦВА GC (—) и Fe 3 O 4 /rGO/GC (---) в 500 ppb Pb(II) + 0,1 ацетатного буфера, pH 6, при скорости развертки потенциала v = 0,1 В/c.
Из рисунка 1 видно, что на обеих кривых ЦВА появляются пики при значении потенциала Е = -0,45 ÷ -0,42 В и Е = -0,66 ÷ -0,63 В на обратной обратного направления сканирования. Это показывает, что окисление свинца является обратимым процессом. После модификации электрода GC материалом Fe 3 O 4 /rGO интенсивность токового сигнала значительно увеличилась. Пиковый анодный ток на электроде GC составляет I pa = 13,7 μА, а на электроде Fe 3 O 4 /rGO/GС I pa = 39,4 μА (почти в 3 раза).
Электрохимическую активность материалов Fe 3 O 4 /rGO в отношении окисления свинца можно объяснить высокой проводимостью rGO и Fe 3 O 4 , большой площадью поверхности электрода, а также наличием адсорбционных центров на модифицированной поверхности электрода. Кроме того, электрокаталитическая способность материалов Fe 3 O 4 также объясняется тем, что ионы Fe(II) обладают способностью отдавать электроны в процессе восстановления Pb(II) с образованием Fe(III), затем Fe(II) будет регенерироваться в процессе приема электронов для внешней цепи. Соответственно свинец окисляется по механизму EC' [4].
Для выяснения механизма процесса исследовали влияние рН и скорости сканирования на значение и положение пикового тока (I pa , E pa ). Результаты эксперимента показаны на рис. 2 и 3.
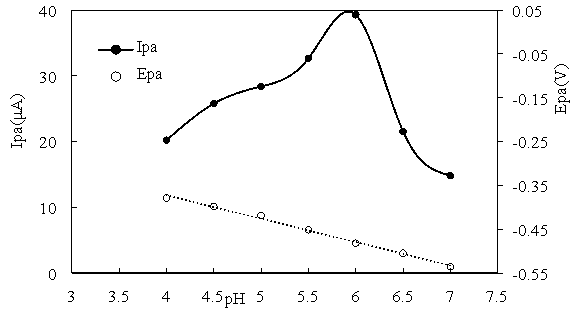
Рис. 2. Влияние pH на значения I pa и E pa раствора Pb(II) на электроде Fe 3 O 4 /rGO/GC
Экспериментальные результаты показывают, что при увеличении рН от 4 до 7 пиковый ток (I pa ) быстро возрастает, а затем постепенно снижается. При рН = 6 пиковый ток достигает максимума. В среде рН = 4 ÷ 7 потенциал пикового тока (E pa ) линейно зависит от рН среды. Это доказывает участие ионов H + в окислении свинца на электроде Fe 3 O 4 /rGO/GC.
По результатам линейной регрессии получали уравнение:
E pa (V) = -0,0534 pH — 0,1559, R² = 0,9948
Предположим, что окисление протекает по схеме: Red ⇌ Ox + ne + mH +
Уравнение Нернста при 25°С:
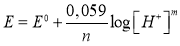
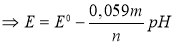
Отсюда следует, что отношение между количеством электронов и протонов равно n/m = 1,1.
Влияние скорости развертки потенциала на сигнал анодного тока также дает информацию о механизме процесса. Из рис. 3 следует, что увеличение скорости развертки потенциала приводит к увеличению пикового анодного тока. Это свидетельствует о том, что реакция переноса электрона происходит только на поверхности. Чтобы определить, стадия диффузии или адсорбции контролируют электрохимическое окисление, построили график зависимость lnI pa от lnv.
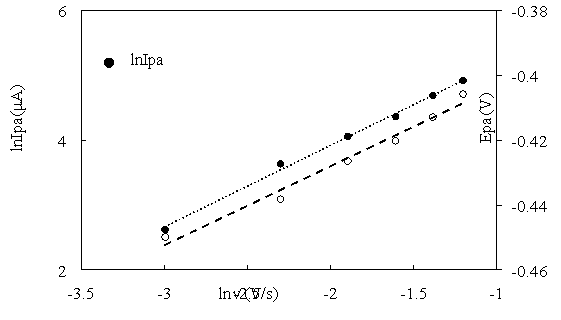
Рис. 3. Зависимости lnI pa и E pa отlnv
По результатам линейной регрессии получают уравнение:
lnI pa = 1,2579 lnv + 6,4382, R² = 0,9959
Наклон уравнения составляет 1,2579 > 0,5. Это свидетельствует о том, что процесс адсорбции является лимитирующей стадией [4].
Соотношение между потенциалом пикового тока и скоростью развертки также дает информацию о механизме окисления. Количество электронов, которыми обмениваются при окислении, связано с Ep и lnv по уравнению:
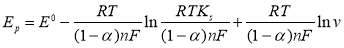
Из уравнения линейной регрессии: E p = 0,0244 lnv — 0,3792; R² = 0,9807
→ n = 2,1 ≈ 2 и m = 1,9 ≈ 2.
Таким образом, по результатам исследования можно сделать вывод, что процесс, происходящий на электроде, происходит по схеме:
+ Процесс обогащения: Pb(II) + Fe 3 O 4 /rGO/GC + 2e → Pb-Fe 3 O 4 /rGO/GC
+ Процесс разрядки:
Pb-Fe 3 O 4 /rGO/GC + 2CH 3 COOH → Pb(CH 3 COO) 2 + 2e + 2H + + Fe 3 O 4 /rGO/GC
2. Линейный диапазон, предел обнаружения и повторяемость измерения для определения ионов Pb ( II )
Кривы дифференциальной импульсной вольтамперограммы Fe 3 O 4 /rGO/GC в растворе Pb(II) с разными концентрациями показаны на рис. 4.
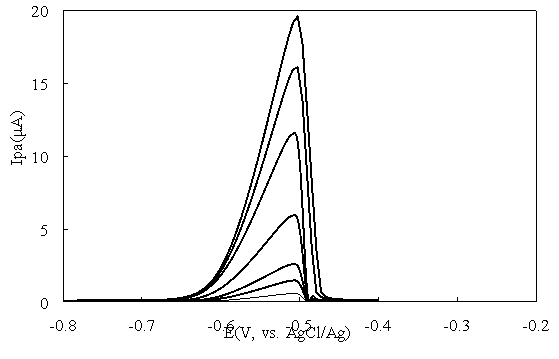
Рис. 4. Сигналы DPV электрода Fe 3 O 4 /rGO/GC в растворе Pb(II) с концентрацией от 1 ppb до 100 ppb + 0,1 М ацетатный буфер pH = 6
Из pис. 4 видно, что на всех кривых имеется четкий пик в положении E ≈ -0,51 В. Пиковый ток линейно увеличивается с концентрацией Pb(II) (рис. 5).
В результате построения уравнения стандартной кривой Pb(II) методом линейной регрессии получено уравнение:
I pa (μА) = 0,2031 C(ppb) + 0,7831; R = 0,9957
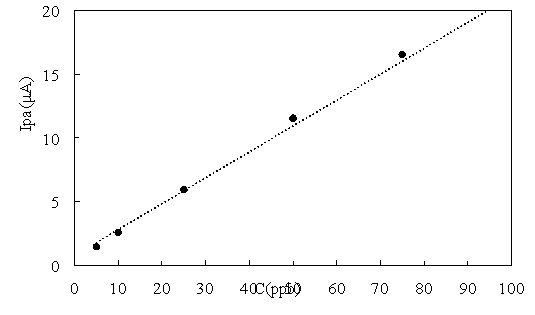
Рис. 5. График линейной зависимости пикового тока от концентрации Pb(II)
Предел обнаружения (LOD) рассчитывали по формуле (2) со значением 0,90 ppb. Среднее относительное стандартное отклонение (RSD) для растворов с концентрацией 1 ppb, 50 ppb и 100 ppb составляет 3,7 %. Этот результат указывает на то, что модифицированный электрод Fe 3 O 4 /rGO/GC, можно многократно использовать для обнаружения Pb(II).
Заключение
Модификация GC-электрода материалом Fe 3 O 4 /rGO сильно увеличивает сигнал анодного тока при измерении CV в растворе Pb(II). Изучена электрохимическая природа Pb(II) на электроде Fe 3 O 4 /rGO/GC, и показано, что в процессе окисления на электроде Pb обменивает 2 электрона, одновременно высвобождая 2 H + . Модифицированный электрод Fe 3 O 4 /rGO/GC можно использовать повторно для обнаружения Pb(II), предел обнаружения Pb(II) определен как 0,90 ppb.
Литература:
- Hazhir T. Fe 3 O 4 magnetic nanoparticles/reduced graphene oxide nanosheets as a novel electrochemical and bioeletrochemical sensing platform / Hazhir T. Adollah S., Somayeh Kh. // Biosensors and Bioelectronics. — 2013. — № 49. — C.1–8.
- Nguyen T. A. T. Electrochemical Determination of Paracetamol Using Fe 3 O 4 /Reduced Graphene-Oxide-Based Electrode / Nguyen Thi Anh Thu, Hoang Van Duc, Nguyen Hai Phong [и др.] // Journal of Nanomaterials. — 2018. — VOL. 2018. — 15 C.
- Vu Thi Duyen. An investigation into electrochemical behavior of Rhodamine B on Fe 3 O 4 /rGO-modified GCE electrode / Vu Thi Duyen, Ngo Thi My Binh, Doan Van Duong [и др.] // The University of Danang — University of Science and Education. — 2021. — VOL. 19. — № 1. — C. 52–57.
- Jafar S. A new kinetic–mechanistic approach to elucidate electrooxidation of doxorubicin hydrochloride in unprocessed human fluids using magnetic graphene based nanocomposite modified glass / Jafar S., Mohammad H., Nasrin Sh. [и др.] // Materials Science & Engineering C. — 2016. — № 61. — C. 638–650.







