Настоящее исследование проведено для оценки микробного разнообразия в полости рта и зубных щетках, а также для оценки антибактериальной активности нескольких видов зубных паст. В текущем исследовании использовалось 8 марок зубных паст для изучения их воздействия на бактерии, выделенные из ротовой полости членов трех семей. Бактериальные штаммы выделяли с использованием селективных сред и идентифицировали на основании культуральных, морфологических, биохимических признаков. Полученные инокуляты подвергали воздействию зубных паст. С учетом зоны ингибирования роста микроорганизмов было обнаружено, что два вида зубных паст обладали выраженными антибактериальными свойствами, один вид — умеренно-выраженным, а остальные не обладали противомикробным действием. В зубных щетках обнаружено большое количество бактерий, резистентных к антибиотикам.
Ключевые слова: полость рта, микроорганизмы, зубные пасты, зубные щетки, резистентность.
The present study was carried out to assess the microbial diversity in the oral cavity and toothbrushes, as well as to evaluate the antibacterial activity of several types of toothpastes. The current study used 8 brands of toothpaste to study their effects on bacteria isolated from the mouths of family members. Bacterial strains were isolated using selective media and identified based on cultural, morphological, and biochemical characteristics. The resulting inoculums were exposed to toothpastes. Taking into account the zone of inhibition of the growth of microorganisms, it was found that two types of toothpastes had pronounced antibacterial properties, one type had a moderately pronounced one, and the rest did not have an antimicrobial effect. A large number of bacteria resistant to antibiotics have been found in toothbrushes.
Keywords: oral cavity, microorganisms, toothpastes, toothbrushes, resistance.
Введение
Микрофлора полости рта обильна и разнообразна. В настоящее время из полости рта выделено, по данным разных авторов, от ста до трехсот видов микроорганизмов. Большинство из них представлено транзиторными видами. Постоянными обитателями полости рта являются около 30 микробных видов, в том числе кокки, дифтероиды, спирохеты, риккетсии, велонеллы, грибы, актиномицеты, дрожжи, простейшие и вирусы. При этом значительную часть микроорганизмов полости рта взрослых людей составляют анаэробные виды [1, 2].
Самую большую группу постоянно обитающих в полости рта бактерий составляют кокки (85–90 %). Они расщепляют белки с образованием сероводорода, разлагают углеводы, сбраживают углеводы по типу молочнокислого брожения с образованием значительного количества молочной кислоты и других органических кислот. Велонеллы, используя молочную кислоту, продуцируют метаболиты, крайне важные для размножения других автохтонных анаэробных бактерий. Кислоты, образующиеся в результате жизнедеятельности кокков, подавляют рост некоторых гнилостных и болезнетворных микроорганизмов, попадающих в полость рта из внешней среды [1].
Находясь в равновесии в ротовой полости, микробиота образует экосистему в виде биопленки, которая важна для укрепления иммунитета и поддержания здоровья [3, 4]. Матрицу для развития биопленки создает слюна. Она содержит биополимеры, которые играют важную роль в формировании тонкой бесклеточной органической пленки, которая формируется на поверхности рта после контакта со слюной и способствует микробной колонизации [5]. К этой пленке затем прикрепляются другие микроорганизмы, чтобы еще больше увеличить разнообразие и сложность биопленки [6, 7].
Нормальная микрофлора полости рта в основном состоит из Firmicutes , Actinobacteria, Bacteroidetes, Fusobacteria и Proteobacteria , которые незаменимы для здоровья человека благодаря их способности ингибировать размножение экзогенных микроорганизмов и способствовать гомеостазу и защите хозяина [8]. Симбиотические отношения могут нарушаться, например, из-за плохого ухода за полостью рта, что приводит к дисбактериозу и заболеваниям, связанным с зубным налетом [9].
Биопленки могут способствовать образованию зубного камня, деминерализации, кариесу, воспалению десен и заболеваниям пародонта. Бактерии из зубной биопленки могут распространяться на другие части тела в результате бактериемии и вызывать системные заболевания.
Гигиена полости рта оказывает большое влияние на общее состояние здоровья и качество жизни. Доказана взаимосвязь между здоровьем полости рта и системными заболеваниями, в том числе сердечно-сосудистой, дыхательной, эндокринной и костно-мышечной систем. Патогенные микроорганизмы, их токсины и медиаторы воспаления могут проникать из очага инфекции в кровоток, оказывая влияние на общее состояние организма. Поэтому большое значение в стоматологии имеет правильная гигиена полости рта и соблюдение правил асептики и антисептики.
Гигиене полости рта способствуют химические вещества, содержащиеся в зубных пастах. На рынке представлено множество зубных паст с различным составом. Зубные пасты содержат, например, фтор, триклозан и ксилит, эфирные масла, растительные и другие компоненты.
Для подавления роста вредных бактерий, защиты эмали, а также предотвращения воспаления десен начиная с девятнадцатого века широко используются зубные щетки. Однако остаточная влага и остатки пищи, находящиеся на зубных щетках, создают подходящую среду для роста различных микроорганизмов, среди которых могут быть и потенциально опасные для различных заболеваний полости рта. Многие микроорганизмы прилипают к пластиковым поверхностям на головках щеток даже после короткого времени воздействия. Затем они остаются на зубных щетках в течение нескольких дней или даже недель после чистки [10]. Поэтому загрязненные зубные щетки могут повторно занести микроорганизмы в полость рта и способствовать передаче заболеваний [11].
Методы и объекты исследования
Объектами исследования были зубные пасты, состав которых приведен в таблице 1.
Таблица 1
Состав исследованных зубных паст
|
Обозначение зубной пасты |
Состав зубной пасты |
|
ЗП1 |
Магния Хлорид, Кокамидопропил Бетаин, Вода, Бромелайн, Глицерин, Калия Гидроксид, Кальция Глицерофосфат, Кремния диоксид, Ксилит, Натрия лаурилсаркозинат, Гидроксиацетофенон, Ксантановая Камедь, Натрия сахарин, Ароматизатор. |
|
ЗП2 |
Aqua, Hydrated Silica, Sorbitol, Hydroxyethylcellulose, Olaflur, Aroma, Saccharin, Limonene, CI 77891 |
|
ЗП3 |
Aqua, Hydrogenated Starch Hydrolysat, Glycerin, Hydrated Silica, Calcium Hydroxyapatite, Cellulose Gum, Potassium Thiocyanate, Lactoferrin, Lactoperoxidase, Glucose Oxidase, Glucose Pentaacetate, Aroma, Aloe Barbadensis Leaf Extract, Xanthan Gum, Cocamidopropyl Betaine, Lonicera Caprifolium Flower Extract, Lonicera Japonica Flower Extract, Glycyrrhiza Glabra Root Extract, Vitis Vinifera Seed Extract, Sodium Benzoate, Potassium Sorbate, Arginine, Capsorubin, CI 75470, Helianthus Annuus Seed Oil, Xanthophylls, Tocopherol, Ascorbyl Palmitate, Zea Mays Starch, Maltitol, Citric Acid, Pentylene Glycol. Fluoride free |
|
ЗП4 |
Пантенол, калия хлорид, кокамидопропил бетаин, вода, гарпагофитума экстракт корня, гидроксиапатит, глицерин, глюкозооксидаза, двуокись титана, децил глюкозид, калия роданид, кальция карбонат, кремния диоксид, ксилит, лимонная кислота, мальтодекстрин, маннит, ментол, монофторфосфат натрия, натрия метабисульфит, натрия хлорид, олова оксид, полилизин, сорбит, сукралоза, целлюлозы ацетат, центеллы азиатской экстракт, цетиловый спирт, эхинацеи пурпурной экстракт корня, ксантановая камедь, лимонен, линалоол, натрия гидроксид, CI 77007, комплекс цитрусовых биофлавоноидов |
|
ЗП5 |
Aqua, Glycerin, Dicalcium Phosphate Dihydrate, Xylitol (10 %), Silica, Calcium Glycerophosphate, Tillia Cordata Flower Extract, Xanthan Gum, Lonicera Caprifolium Extract, Lonicera Japonica Extract, Sodium Benzoate, Magnesium Chloride. |
|
ЗП6 |
Эхинацея, мирра, ромашка, ратания, мята, шалфей, фторид натрия, бикарбонат натрия |
|
ЗП7 |
Вода, сорбитол, диоксид кремния, натрий-карбоксиметил целлюлоза, натрия лаурилсульфат, ароматическая композиция, паста гидроксиапатитная, тринатрийфосфат, экстракты крапивы и тысячелистника, диоксид титана, карбомер, метилпарабен, натрия сахарин, пропиленгликоль, лимонен |
|
ЗП8 |
Aqua, Hydrogenated Starch Hydrolysate, Aluminum Hydroxide, Hydrated Silica, Silica, Poloxamer 188, Sodium Lauryl Sulfate, Aroma, Hydroxyethylcellulose, Aluminum Lactate, Titanium Dioxide, Allantoin, Aluminum Fluoride, Sodium Saccharin, Chlorhexidine Digluconate, Bisabolol, Limonene |
Количественный учет микроорганизмов проводили методом смывов с поверхности слизистой оболочки ротовой полости и с последующим посевом на плотные питательные среды. Зубные щетки после использования промывали в стерильном физиологическом растворе в стерильных одноразовых пробирках.
Идентификацию бактерий выполняли в следующей последовательности: описание культуральных признаков выделенного микроорганизма; получение чистой суточной культуры путем посева на питательные среды; окраска по Граму и микроскопирование препарата.
Определение антимикробных свойств зубных паст осуществляли диффузионным методом лунок, которые вырезали в толстом слое агара стерильным металлическим стержнем (пробочным сверлом). При наличии чувствительности к образцам зубных паст вокруг соответствующих лунок отмечается зона угнетения роста микроорганизмов. Диаметр зон задержки роста измеряли с точностью до 1 мм.
Определение чувствительности бактерий к антибиотикам осуществляли диффузионным методом [12] с использованием дисков, пропитанных антибиотиками (табл. 2).
Таблица 2
Перечень использованных антибиотиков
|
N п/п |
Наименование антибиотика |
Краткое обозначение |
Концентрация антибиотика |
|
1 |
Тобрамицин |
ТОБ |
10 мкг |
|
2 |
Оксациллин |
ОКС |
1 мкг |
|
3 |
Ломефлоксацин |
ЛОМ |
10 мкг |
|
4 |
Фурадонин |
ФД |
300 мкг |
|
5 |
Кларитромицин |
КТМ |
15 мкг |
|
6 |
Тетрациклин |
ТЕТ |
30 мкг |
|
7 |
Ампициллин |
АМП |
10 мкг |
|
8 |
Олеандомицин |
ОЛЕ |
15 мкг |
|
9 |
Линкомицин |
ЛИН |
15 мкг |
|
10 |
Доксициклин |
ДОК |
30 мкг |
|
11 |
Бензилпенициллин |
ПЕН |
10 ЕД |
|
12 |
Неомицин |
НЕО |
30 мкг |
|
13 |
Фосфомицин |
ФОС |
200 мкг |
|
14 |
Левомицетин |
ЛЕВ |
30 мкг |
Результаты исследования
Микробиом полости рта человека отличается высокой сложностью видового состава. Выделение микроорганизмов с поверхности слизистой оболочки ротовой полости является сложным процессов. Поэтому далеко не все микроорганизмы биопленочного микробиома удается выделить и идентифицировать. Тем не менее, нами выделены и идентифицированы такие микроорганизмы, как Streptococcus spp. , Veillonella spp. , Bifidobacterium spp., Actinobacteria spp., Bacteroidetes spp., Staphylococcus spp. (табл. 3).
Таблица 3
Процентное соотношение выделенных микроорганизмов в разных семьях
|
Микроорганизмы |
Семья 1 |
Семья 2 |
Семья 3 |
||||||
|
П |
М |
Р |
П |
М |
Р |
П |
М |
Р |
|
|
Streptococcus spp. |
23,3 |
25,1 |
19,1 |
27,4 |
29,3 |
21,2 |
31,7 |
30,4 |
18,3 |
|
Veillonella spp. |
12,2 |
9,7 |
3,5 |
20,1 |
18,8 |
14,9 |
13,1 |
15,7 |
6,6 |
|
Bifidobacterium spp. |
3,0 |
1,0 |
0,9 |
2,7 |
1,9 |
0,7 |
2,8 |
3,5 |
0,7 |
|
Actinobacteria spp. |
4,4 |
4,7 |
3,5 |
3,3 |
2,0 |
2,3 |
5,5 |
7,9 |
3,0 |
|
Bacteroidetes spp. |
11,1 |
12,6 |
7,3 |
14,1 |
10,1 |
5,1 |
15,6 |
10,0 |
4,2 |
|
Staphylococcus spp. |
12,0 |
11,4 |
8,3 |
8,8 |
7,1 |
9,1 |
13,8 |
12,6 |
15,1 |
|
Прочие |
34,2 |
35,5 |
57,4 |
27,6 |
30,8 |
46,7 |
17,5 |
32,5 |
52,1 |
Примечание: П — папа, М — мама, Р — ребенок.
Общее количество микроорганизмов на поверхности слизистых оболочек и поверхности зубов в 1 см 3 смывов колебалось в разных семьях от 10 3 КОЕ до 10 4 КОЕ.
Исследования показали совпадающее (за некоторым исключением) соотношение выделенных видов микроорганизмов у членов разных семей. Причем у детей количество выделенных микроорганизмов ниже, что можно объяснить более тщательным соблюдением профилактических мероприятий.
Инокуляты выделенных микроорганизмов использовали для оценки антимикробной активности зубных паст. Из восьми зубных паст три вида обладали выраженным антимикробным действием, один вид показал слабое антимикробное действие, а остальные зубные пасты не проявляли антисептических свойств (табл. 4).
Таблица 4
Антимикробная активность зубных паст
|
Микроорганизмы |
ЗП1 |
ЗП2 |
ЗП3 |
ЗП4 |
ЗП5 |
ЗП6 |
ЗП7 |
ЗП8 |
|
Streptococcus spp. |
± |
– |
– |
– |
– |
+ |
+ |
+ |
|
Veillonella spp. |
± |
– |
– |
– |
– |
+ |
+ |
+ |
|
Bifidobacterium spp. |
± |
– |
– |
– |
– |
+ |
+ |
+ |
|
Actinobacteria spp. |
± |
– |
– |
– |
– |
+ |
+ |
+ |
|
Bacteroidetes spp. |
± |
– |
– |
– |
– |
+ |
+ |
+ |
|
Staphylococcus spp. |
± |
– |
– |
– |
– |
+ |
+ |
+ |
Примечание: + выраженное проявление антимикробной активности; ±слабое проявление антимикробной активности; — отсутствие антимикробной активности.
Исследования показали, что зубные щетки содержат различные микроорганизмы, которые в период использования могут влиять на микробиом ротовой полости. Общее количество бактерий, выделенных из зубных щеток членов семьи, колебалось от 3,0×10 2 КОЕ/мл до 1,0×10 3 КОЕ/мл. На зубных щетках членов семьи обнаружены такие бактерии, как Enterococcusspp. , Pseudomonasspp. , Streptococcusspp. , Lactobacillusspp. и Staphylococcus spp . (рис. 1).
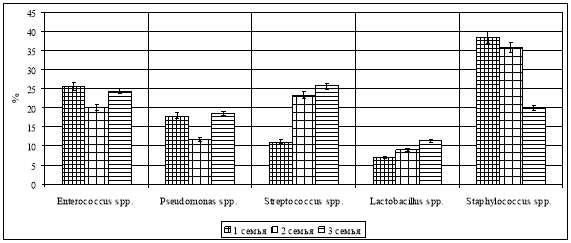
Рис. 1. Микробный пейзаж зубных щеток в различных семьях
Эти микроорганизмы в определенной степени ответственны за проявление кариеса. Кроме того, они обладали мультирезистентностью к тестируемым антибиотикам (рис. 2).
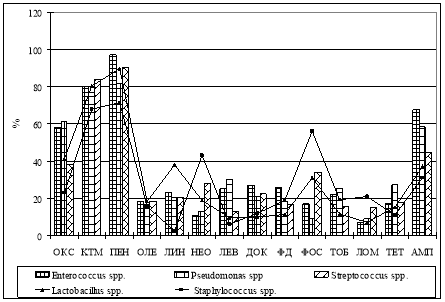
Рис. 2. Дифференциальная антибиотикорезистентность микроорганизмов зубных щеток
Было установлено, что до 84,1 % микроорганизмов, обитающих на зубных щетках, резистентны к кларитомицину, до 97,1 % — к бензилпенициллину, до 67,7 % — к ампициллину. Это свидетельствует о том, что устойчивость к антибиотикам является серьезной проблемой общественного здравоохранения. Ее можно в некоторой степени решить, сводя к минимуму ненужное и чрезмерное назначение антибиотиков, а также правильно применяя назначенные антибиотики.
Литература:
- Лыков И. Н., Шестакова Г. А. Микроорганизмы: Биология и экология. — Калуга. Изд-во «СерНа». 2014 г. 451 с.
- Wade W. G. The oral microbiome in health and disease // Pharmacol. Res. — 2013. — Vol. 69(1). — Р. 137–143. doi: 10.1016/j.phrs.2012.11.006.
- Zarco M. F., Vess T. J., Ginsburg G. S. The oral microbiome in health and disease and the potential impact on personalized dental medicine // Oral Dis. — 2012. — Vol. 18(2). — Р. 109–120. doi: 10.1111/j.1601–0825.2011.01851.x.
- Marsh P. D. Dental plaque as a microbial biofilm // Caries Res. — 2004. — Vol. 38(3). — Р. 204–211. doi: 10.1159/000077756.
- Jakubovics N. S., Goodman S. D., Mashburn-Warren L., Stafford G. P., Cieplik F. The dental plaque biofilm matrix // Periodontol. — 2021. — Vol. 86(1). — Р. 32–56. doi: 10.1111/prd.12361.
- Soria S., Isabel P., Bejarano A., Sharma A. Biofilms: Development and molecular interaction of microbiome in the human oral cavity // New and Future Developments in Microbial Biotechnology and Bioengineering: Microbial Biofilms. — 2020. — Р. 61–75. https://doi.org/10.1016/b978–0–444–64279–0.00005–0https://doi.org/10.1016/b978–0–444–64279–0.00005–0
- Хавкин А. И., Ипполитов Ю. А., Алешина Е. О., Комарова О. Н. Микрофлора и болезни полости рта // Экспер. клин. Гастроэнтерол. — 2015. — № 6. — С. 78–81.
- Marsh P. D., Head D. A., Devine D. A. Prospects of oral disease control in the future — an opinion // J. Oral. Microbiol. — 2014. — Vol. 6. — Р. 261–276. doi: 10.3402/jom.v6.26176.
- Assed Bezerra Da Silva L, Nelson-Filho P, Saravia ME, De Rossi A, Lucisano MP, Assed Bezerra Da Silva R. Mutans streptococci remained viable on toothbrush bristles, in vivo, for 44 h. // Int. J. Paediatr. Dent. — 2014. — Vol. 24(5). — Р. 367–372. doi: 10.1111/ipd.12079.
- Pradeep S., Nandini G., Hiranmayi S., Kumar G., Bijjala N. K., Guduri S. A. Prospective Study on Assessment of Microbial Contamination of Toothbrushes and Methods of Their Decontamination // Cureus. — 2022. — Vol. 14(10):e30155. doi: 10.7759/cureus.30155.
- Richards D. How clean is your toothbrush? // Evid Based Dent. -2012. — Vol. 13(4). — Р. 111. doi: 10.1038/sj.ebd.6400895.
- Лыков И. Н. Лабораторный практикум по общей микробиологии. Калуга: Издатель Захаров С. И. («СерНа»), 2020. — 244 с.










