К сожалению, согласно прогнозам Всемирной организации здравоохранения, в ближайшее время количество онкологических заболеваний будет продолжать расти. Поэтому, поиск новых лекарственных препаратов для борьбы с раком является одним из наиболее актуальных и приоритетных направлений научных исследований. Механизмы этиологии и патогенеза раковых заболеваний окончательно не выявлены из — за большой сложности и многообразия молекулярных механизмов, происходящих при этом процессов.
Онкологические заболевания — одни из самых распространенных заболеваний в мире. Наиболее распространены рак молочной железы, рак предстательной железы, рак желудка и прямой кишки, рак легкого. В настоящее время в мире насчитывается более 30 миллионов человек, которым поставлен диагноз «рак», при этом ежегодно во всем мире регистрируются более 12 миллионов новых случаев заболевания раком [https://www.google.ru/webhp//www.cancer.org/downloads/STT]
В развивающихся странах каждый третий заболевший умирает от рака, и зачастую от момента постановки диагноза до гибели пациента проходит очень мало времени (например, 95 % пациентов с карциномой поджелудочной железы умирают в течение первых трех лет, а иногда и в течении года после постановки диагноза [3, 9, 15, 16, 17, 18, 19, 20 22]
Многолетний опыт применения различных медицинских препаратов позволил выявить клинически позитивные стороны в лечении онкологических больных людей. У большинства препаратов имеются серьезные недостатки — токсические влияния на здоровые органы и ткани, что постоянно многих ученых и врачей стимулирует поиск новых более безопасных лекарственных средств.
История применения экстрактов животного происхождения насчитывает много тысячелетий и в основном связана с их использованием в качестве средств омоложения и продления активного долголетия [5, 6, 7, 8, 9, 10, 14, 15, 17, 18].
С глубокой древности в восточной медицине для приготовления ряда лекарств использовалось сырье животного происхождения: головной мозг, щитовидная железа, вилочковая и поджелудочная железа, панты, желчь и т. д.
Об эффективности животных препаратов, как средств лечения, было известно задолго до А. Бертольда, Н. Е. Введенского, Ч. Броун — Секара, И. М. Мечникова, Л. В. Соболева, К. Бернара, В. Кенноеа, А. Карреля, И. Мюллера, Ф. Старлинга, которые много сделали как в экспериментальном, так и практическом плане для выявления терапевтических и омолаживающих свойств органопрепаратов [Лубяко А. А.,2003]
В16 веке известный азербайджанский ученый и врач Рамазан ибн Шейх Али Ленкорани в своём медицинском трактате «Фаррух –намэ Джемали» описывает метод лечения болезней внутренних органов. В первой же главе он подробно характеризует лечебное действие молока, мозга, желудка, почек, печени и тд., в основе которого лежит принцип подобия. Ленкорани особо отмечает, что действие экстрактов органов, полученных от различных животных и птиц, не одинаково [3, 6, 9].
В конце 19 века один из французких исследователей доктор Э.Эртог (E.Hertoghe) впервые применил экстракты щитовидной железы животных для лечения недостаточности щитовидной железы человека. Его именем был назван клинический синдром умеренной недостаточности щитовидной железы — «синдром Эртога», а также один из типичных симптомов этой недостаточности — «симптом Эртога»: выпадение наружной трети брови. Э.Эртог был автором многих научных трудов и пользовался международной известностью. Ещё в своей первой основной работе «Скрытая микседема» он писал о связи преждевременного старения с недостатком гормонов [Hertoghe T., Nabe J. –J., 2000].
Признанным основоположником отечественного производства органопрепаратов и их практического использования является петербургский доктор фармации А. В. Пель. В 30 –е годы в СССР, разработанная им лизатотерапия — лечение препаратами, полученными посредством специальной обработки внутренних органов крупного рогатого скота, — стала весьма популярной. Научной предпосылкой метода явилось представление о ведущей роли нарушения функции желез внутренней секреции в старении организма и разнообразной патологии человека [5, 6, 7, 8, 9, 10, 12, 13, 16].
Метод тканевой терапии активно внедрялся учёным Одесского научно — исследовательского института глазных болезней и тканевой терапии им. академика В. П. Филатова [Емельянова Н. А.,2005].
В результате фракционной перегонки мясокостной муки из животного материала профессору А. В. Дорогову удалось выделить 3 фракции АСД, имеющие различное функциональное применение. В 1950 году А. В. Дорогову было выдано авторское свидетельство на изобретение АСД, а в 1951 году препарат рассекретили. Он был разрешен Фармакологическим комитетом Минздрава СССР к производству и применению и был включен «Фармакопею» Машковского. Применялась фракция № 1 АСД, как наиболее активная А. В. Дорогов лечил людей от различных заболеваний, вплоть до онкологических в запущенной форме [5, 6, 7, 8, 9, 10].
Таким образом, побудительным мотивом для применения экстрактов органов животных для ревитализации и лечения послужило представление об этом источнике биоматериала как о носителе широкого спектра биологически и метаболически активных веществ, влияющих на процессы пролиферации и дифференцировки клеток. Использование для этих целей органов более высоко организованных животных, таких, как крупный рогатый скот, овцы, свиньи (домашние животные), обусловлено их сходством по своему анатомическому строению (органы пищеварения и др) и близостью к человеку по среде обитания. Кроме того, сформировавшееся в обществе положительное отношение к лекарственным препаратам из тканей телят и коров, и других животных ассоциируется с говядиной и коровьем молоком как важнейшими составляющими человеческого питания [1, 2, 3, 5, 6, 7, 8, 9].
В отечественной литературе препараты животного происхождения обозначаются как регуляторные пептиды или пептидные биорегуляторы (цитамины, цитомедины и др.). Современная зарубежная научная литература наиболее часто использует для определения препаратов животного происхождения термин органопрепараты, в котором подчёркивается органное (из органов животных) происхождение фармакологически активной субстанции [5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18].
С терапевтической точки зрения крайне важным является не только биоматериал здоровых специально выращиваемых животных или птиц, но и состав, способы получения фармакологически активной субстанции –внутриклеточных биорегуляторов. [5, 6, 7, 8, 9,10].
Анализ литературных данных о существующих и новых препаратах для терапии раковых заболеваний показал, что наибольшее внимание в последнее время уделяется белкам, аминокислотам и фетальным органопрепаратам (пептидам, цитокинам). Препараты пептидной природы могут предотвращать возникновение рака (профилактика рака) и защищать нормальные клетки (в том числе стволовые клетки костного мозга) при проведении стандартной химио — и радиотерапии.
Исследования многих авторов Р. А. Абдумаликов, А. И. Агенко, А. Г. Бабаева, В. И. Дуда, Н. А. Кольберг, Б. И. Кузник, Н. Н. Кязимова, И. С. Ролик, Е. Н. Скрипкина, и др., показали, что у некоторых пептидных тканевых препаратов, имеется выраженная противоопухолевая активность, поэтому дальнейшие работы в этом направлении мы находим весьма перспективны.
С годами увеличение чувствительности к инфекции, снижение иммунного надзора, как следствие происходит увеличение возрастной заболеваемости раком –это ни что иное, как сбой в функционировании иммунной системы. Для противодействия этим процессам должен использоваться комплекс средств и методов, среди которых ключевую роль играют тканевые пептидные препараты.
Применение тканевых (пептидных) препаратов очень важно лицам с отягощённой раковой наследственностью и с наличием предрака.
Разработанный новый отечественный тканевой (органный) — препарат «Бурсанатал». В качестве сырья использовали Фабрициеву бурсу цыплят бройлеров в возрасте 35–42 дней, взятую в процессе убоя и разделки птицы. Технология включает следующие стадии производства: бурсу измельчают, затем гомогенизируют в водно-солевом растворе, экстрагируют, полученный экстракт нагревают, удаляют термолабильную фракцию, фильтруют с целью отделить вещества с молекулярной массой более 10 Кд.
Готовый препарат представляет собой непрозрачную водную суспензию кремового цвета со слабым специфическим запахом.
Проведены исследования химического состава (табл. 1).
Таблица 1
Общий химический состав препарата «Бурсанатал» (n=5)
|
Показатели |
Содержание,% |
|
Влага |
3,50,08 |
|
Сухой остаток |
94,61,4 |
|
белок |
16 |
|
Рн |
6,90,2 |
|
Зола |
1,20,08 |
|
Жир |
0,240,03 |
«Бурсанатал» содержит комплекс белков с молекулярной массой от 10,0 до 1,0 кДа, которые обладают иммуномодулирующими свойствами в отношении В — лимфоцитов. Отечественный тканевой иммунномодулятор «Бурсанатал», производится во Всероссийском научном центре по безопасности биологически активных веществ «Бианц», с 2004 года.
Исследования острой, подострой и хронической токсичности.
Выполнены в эксперименте на белых беспородных мышах и крысах линии Вистар на базе ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
Испытуемый препарат вводили животным однократно, внутрибрюшинно, в дозах 0,5, 5, 50, 500 и 5000 мг/кг или внутрижелудочно (per os) — 6, 60, 600 и 6000 мг/кг. Срок наблюдения — 21 день. Хроническую токсичность изучали в течение 30 суток. «Бурсанатал» ежедневно назначали мышам в однократной терапевтической дозе — 750 мг/кг и 20-и кратной — 15000 мг/кг, крысам соответственно 41/5 и 8300 мг/кг. Объем вводимого жидкого препарата составлял для мышей 0,5 мл, крыс — 2,0 мл, растворы готовили ex tempore. Срок наблюдения составил 37 дней. Контрольная группа получала плацебо (физиологический раствор) в аналогичных количествах.
На первые и седьмые сутки после последнего назначения препарата половину животных из каждой группы декапитировали, проводили макро- и микроскопические исследования печени, легких, сердца, тимуса, селезенки, корня языка, желудка, тонкого и толстого кишечника, брыжейки, головного мозга.
Полученные результаты показали, что в течении всего исследования летальных исходов у экспериментальных и контрольных животных не наблюдалось, каких-либо внешних признаков токсического действия не выявлено, поведенческие реакции и динамика изменения веса не отличались. Физическое развитие крыс и мышей не зависело от дозы испытуемого препарата.
Установлен ЛД50 «Бурсанатала» при введении в желудок животным обоих видов — >6000 мг/кг, при внутрибрюшинном — более 5000 мг/кг, что позволяет отнести иммуномодулятор в первом случае к 4 классу малоопасных веществ, во втором — к относительно безвредным веществам 6-го класса токсичности.
Влияние препарата на состояние крови и внутренних органов.
Образцы крови отбирали через сутки после окончания 30 — дневного курса введения препарата. Изучали гематологические показатели крови мышей и крыс: лейкоциты, лимфоциты, моноциты, гранулоциты, эритроциты, концентрацию гемоглобина, гематокрит, средний объем эритроцитов и тромбоцитов, среднее содержание и концентрацию гемоглобина в эритроците, ширину распределения эритроцитов, тромбоциты, тромбокрит.
«Бурсанатал» не оказывал критического влияния на содержание гемоглобина и форменных элементов, не выявлено других достоверных изменений. О функциональном состоянии внутренних органов подопытных животных судили по показателям плазмы крови: содержанию общего белка, креатинина, глюкозы, активности аминотрансфераз: АСТ (аспартатаминотрансферазы и АЛТ (аланинаминотрансферазы). Полученные результаты показали отсутствие достоверных отличий в биохимических показателях опытных и контрольных групп после многократного разового и хронического введения per os различных доз препарата. Функциональные нарушения различных органов — почек, печени, поджелудочной железы, отсутствовали.
Патоморфологические исследования.Экспериментальным животным внутрижелудочно вводили «Бурсанатал» — 15000 мг/кг в течении 30 суток. На 1-е и 7-е сутки после последнего назначения проводили макро- и микроскопические исследования внутренних органов на наличие патологических изменений.
Органы брюшной и грудной полости не отличались от контрольных образцов по величине, консистенции и окраске, состоянию серозных покровов брюшины и плевры. Гистологические исследования органов пищеварительной системы — языка, желудка, тонкой и толстой кишок, печени, не выявили отклонений от нормы. В органах лимфатической системы — тимусе, селезенке и мезентеральных лимфатических узлах, не отмечено активации пролиферативных процессов, образования и накопления иммунокомпетентных клеток. Микроскопический анализ легких патологических изменений не выявил. Мозговая оболочка, сосудистое русло, структура нервной ткани и гистологическая картинка сердца — без отклонений. Проведенные исследования свидетельствуют об отсутствии признаков токсического действия препарата в испытуемых дозах при длительном пероральном применении.
Цитотоксичность.Изучали путем использования перевиваемых культур клеток человека и мыши, полученных из коллекции клеточных культур Института цитологии РАН. Применяли различные тесты для оценки общей жизнеспособности клеточного монослоя с наличием маркеров повреждения клеток в культуре. Изменения метаболического состояния клеток оценивали по снижению суммарной активности митохондриальных дегидрогеназ в микротетразолиевом тесте.
Препарат «Бурсанатал» добавляли к кондиционированным клеткам — мишеням в концентрации от 0,02 до 10 мг/мл и инкубировали в течение 48 часов. Установлено отсутствие метаболического ответа клеток в культуре, препарат не нарушал жизнеспособности клеток и не проявлял цитотоксических свойств в испытанных количествах.
Определение неспецифической резистентности к инфекциям.
Влияние препарата «Бурсанатал» на неспецифический иммунитет оценивали в эксперименте по определению устойчивости мышей к экспериментальной сальмонеллезной инфекции. Животным 3-х опытных групп вводили per os ежедневно, в течение семи суток, испытуемый препарат в количестве 750 (терапевтическая доза), 150 и 3750 мг/кг, контрольная группа получала дистиллированную воду. Через 24 часа после последнего приема препарата экспериментальных и интактных мышей заражали различными дозами суточной агаровой культурой Salmonella enteritidis 92. Наблюдение за животными длилось в течение 21 суток. Защитное действие иммуномодулятора определяли по выживаемости мышей и показателю ЛД50.
Установлено, что «Бурсанатол» не оказывал заметного защитного действия при заражении культурой возбудителя сальмонеллеза в дозе 500 м.к. (70 ЛД50). Вместе с тем увеличение сроков гибели мышей, получавших препарат перед заражением, свидетельствует о некотором повышении устойчивости животных.
Оценка иммуномодулируемого действия. Иммунодепрессия индуцирована у экспериментальных животных — мышей с помощью цитостатика «Циклофосфан». Иммунодефицитным животным вводили per os «Бурсанатал» на протяжении 7 дней.
Отмечено снижение количества всех анализируемых субпопуляций лимфоцитов (CD3+, CD22+, CD3+ CD4+, CD3+CD8+) у иммунодепрессивных мышей по сравнению с интактной группой, получавших физраствор. Введение испытуемого препарата способствовало увеличению лимфоцитов на 7-е сутки, однако к 14-м суткам содержание Т- и В — лимфоцитов снижалось.
Получены данные по определению субпопуляций Т- лимфоцитов (R1), В — лимфоцитов (R2), цитотоксических Т — лимфоцитов (R3) и Т — хелперов (R4).
Функциональную активность нейтрофилов перитонеального экссудата мышей определяли методом спонтанной и индуцированной хемилюминесценции (ХЛ). Для активации фагоцитов применяли опсонизированный зимозан, как индукатор фагоцитоза. В качестве контроля использовались нейтрофилы интактных животных.
Показано, что под влиянием «Бурсанатала» происходит выраженное увеличение уровня ХЛ по сравнению с контролем в 1,7 раза (рис. 1).
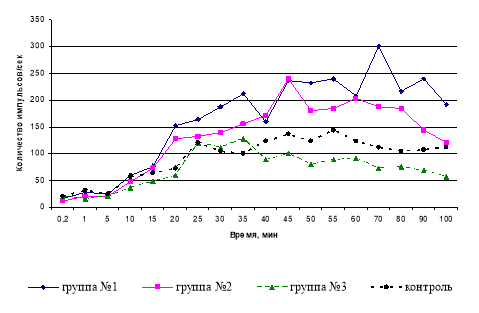
Рис. 1. Идуцированная хемилюминесценция нейтрофилов здоровых мышей, получавших «Бурсанатал» (группа № 1), иммунодепрессивных мышей, принимавших «Бурсанатал» (группа № 2) и иммунодепрессивных (группа № 3) через сутки после окончания эксперимента
Дана оценка испытуемого препарата в отношении пролиферативной активности лимфоцитов селезенки.
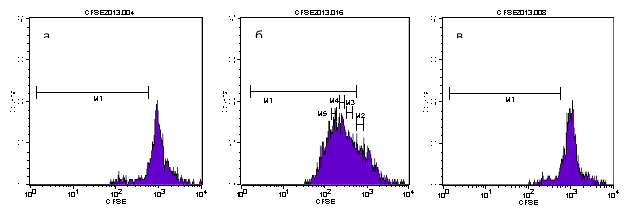
Недельное внутрижелудочное введение иммунодепрессивным мышам терапевтических доз «Бурсанатала» выводило иммунную систему из состояния угнетения. Количество сионтанных профилирующих лимфоцитов увеличивалось более чем в 11 раз (до 10,6 %). Стимуляция лимфоцитов митогенамами конканавалином А (Кон А) и липополисахаридом (ЛПС) приводила к повышению уровня активных Т- клеток (78,5 %) и В — клеток (9,3 %), что свидетельствует об иммуностимулирующем действии препарата на фоне иммунодефицита (рис. 2, табл. 2).
![]()
![]()
![]() Рис. 2. Количество (%) пролифилирующих селезёночных лимфоцитов, полученных от иммунодепрессивных мышей, получавших «Бурсанатал»: без стимуляции митогенами (а), после стимуляции КонА (б) и ЛПС (в)
Рис. 2. Количество (%) пролифилирующих селезёночных лимфоцитов, полученных от иммунодепрессивных мышей, получавших «Бурсанатал»: без стимуляции митогенами (а), после стимуляции КонА (б) и ЛПС (в)
Таблица 2
Пролиферативная активность лимфоцитов мышей различных опытных групп под воздействием стимуляторов ибез них (%)
|
Группы мышей |
Без стимулятора |
Стимуляторы | |
|
КонА |
ЛПС | ||
|
Интактные (здоровые) мыши |
1,9 |
46,9 |
2,3 |
|
Интактные мыши + «Бурсанатал» |
80,8 |
95,1 |
79,8 |
|
Иммунодепрессивные мыши |
0,9 |
40,8 |
3,4 |
|
Иммунодепрессивные мыши + «Бурсанатал» |
10,4 |
78,5 |
9,3 |
Полученные данные, отражающие влияние «Бурсанатала» на пролиферативную активность лимфоцитов у здоровых и с индуцированной иммуносупрессией мышей
(рис. 4). Иммуностимулирующее действие препарата продемонстрировали показатели функциональной активности лимфоцитов: процент бласттрансформации (БТ); митотическая активность бластов (МАБ); индекс деления (ИД). Из таблицы 3 следует, что два из трех изученных показателей были выше у животных, принимавших иммуномодулятор.
Таблица 3
Показатели функциональной активности лимфоцитов
|
Группы |
% БТ |
% МАБ |
ИД |
|
Интактные мыши |
40,7 |
39,0 |
5,3 |
|
Интактные мыши + «Бурсанатал» |
36,2 |
52,9 |
7,4 |
|
Иммунодепрессивные мыши |
36,5 |
51,3 |
5,1 |
|
Иммунодепрессивные мыши + «Бурсанатал» |
41,6 |
46,5 |
5,9 |
Полученные материалы показали, что препарат «Бурсанатал» не обладает острой токсичностью (при однократном введении) в отношении мышей и крыс, что позволяет отнести его к малотоксичным или относительно безвредным веществам. После многократного (в течение 30 дней) перорального введения животным «Бурсанатала» в дозе, значительно превышающей терапевтическую дозу для человека с учетом видового пересчета, не наблюдаются изменения в общем состоянии и поведении животных. Препарат не вызывает каких-либо отклонений гематологических и биохимических показателей. Морфологическое строение внутренних органов соответствует норме.
Недельное внутрижелудочное применение «Бурсанатала» незначительно повышает устойчивость мышей к генерализованной сальмонеллёзной инфекции.
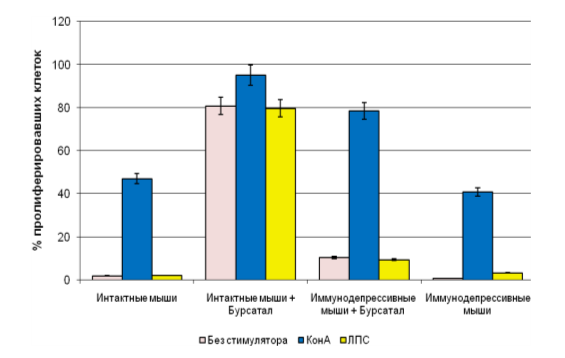
Рис. 3. Пролиферативная активность лимфоцитов (%), полученных от интактных и иммунодепрессивных мышей на 14 сутки после окончания недельного курса приема «Бурсанатала»
В экспериментах на мышах линии Balb/c установлено, что «Бурсанатал» обладает незначительным иммуностимулирующим действием. Внутрижелудочное введение животным данного препарата в терапевтической дозе повышает в крови количество Т- и В-лимфоцитов, стимулирует активность перитонеальных нейтрофилов и селезёночных лимфоцитов как у здоровых, так и иммунодепрессивных мышей.
На основании проведенных испытаний можно заключить, что препарат «Бурсанатал» является нетоксичным и обладает направленными иммуностимулирующими свойствами.
Для изучения молекулярных механизмов развития онкологических заболеваний и разработки новых противораковых агентов крайне важны исследования, проводимые на животных моделях. Пригодность in vivo моделей рака зависит от того, насколько точно они имитируют человеческие заболевания [3, 9, 15, 16, 17, 18, 19, 20 22]
Идеальная опухолевая модель должна соответствовать следующим требованиям:
- обладать теми же гистопатологическими особенностями, что и человеческая опухоль;
- прогрессирование модельной опухоли должно протекать по тем же стадиям, что и у человека, а также вызывать одинаковые физиологические и системные эффекты;
- в инициации и развитии модельной опухоли должны быть задействованы те же гены и биохимические пути. что и в случае человеческой опухоли [2, 3, 9, 15, 16, 17, 18, 19].
Опухолевый ответ в модельной системе должен максимально точно отражать ответ человеческой опухоли на специфическую терапию и помогать исследователю прогнозировать терапевтическую эффективность в клинических анализах на онкологических пациентах. Доступность таких моделей позволит обнаруживать новые мишени для более эффективного киллинга раковых клеток, а также разрабатывать новые превентивные или терапевтические противораковые препараты и исследовать механизмы действия и устойчивости к противораковой терапии in vivo. [3, 5, 6,7 9, 15, 16, 17, 18, 19, 20, 21]
Анализ противоопухолевой активности тканевого пептидного препарата «Бурсанатал» на мышиных моделях CВRB РМЖ иТ— лимфолейкоза invivo.
В первую неделю после перевивки была выявлена задержка появления опухоли у обоих опытных групп (самок и самцов). Пальпируемые опухоли были обнаружены у 35 % леченых пептидным препаратом «Бурсанатал» у мышей — самцов и 19 % пальпируемых опухолей у мышей — самок, в то время как в контрольной группе у мышей –самцов опухоли пальпировались у 73 %, а в контрольной группе у мышей — самок, опухоли пальпировались у 57 %.
Во второй неделе после перевивки задержку появления опухолей наблюдали у 75,3 % мышей — самцов леченых тканевым препаратом «Бурсанатал», и 58,2 % у мышей — самок леченным тканевым препаратом «Бурсанатал», в то время как в контроле опухоли пальпировались у 96,7 % мышей –самцов и 89,9 % у мышей — самок.
Таким образом, однократные инъекции пептидным препаратом «Бурсанатал», оказал краткосрочное влияние на динамику появления опухолей. Наиболее длительную задержку появления опухолей наблюдали у мышей –самок, получавших лечения тканевым препаратом «Бурсанатал».
Достоверное замедление роста опухолей на 18,3 % у мышей –самок и на 25,2 % у мышей –самцов, наблюдали на четвертой недели, после перевивки тканевым препаратом «Бурсанатал»
Из результатов сравнительного анализа следует, что тканевой препарат «Бурсанатал» обладает противоопухолевой активностью, особенно выражена на мышах — самках, при однократных инъекциях, на медленнорастущей подкожной мышиной модели СВRB.
После подтверждения противоопухолевого эффекта «Бурсанатала» на модели мышей — самцов и мышей самок медленнорастущей (СВRB РМЖ), мы изучили действие тканевого препарата «Бурсанатал» на модели –мышей характеризующейся агрессивным инвазивным ростом с макроскопическими метастазами в легкие, печень, почки и селезенку. При испытаниях на быстрорастущей модели –самцов и модели — самок, использовали перевиваемую подкожную модель РМЖ мышей разделенных по половому признаку, линии ВLRB при многократном подкожном введении тканевого препарата «Бурсанатал» вокруг опухоли. В данном опыте сингенным самцам и самкам проводили подкожную перевивку в дозе 10² ОК На мышь. Инъекции в дозе 1 мг на мышь — самцам и мышь — самок, проводили подкожно с интервалом в 48 часов, (5 инъекций на курс лечения, дни 1, 3, 5, 7, 9 после перевивки). Противоопухолевую активность препарата оценивали по торможению роста опухоли, уменьшению количества микроскопических метастазов в легких и улучшению выживания леченных мышей — самцов и леченных — мышей самок по сравнению с мышами — самцов и мышами — самок контрольных групп.
Многократное (5 инъекций) лечение привело к значительному замедлению роста опухоли у леченых мышей — самок, по сравнению с контролем на 12,3 % у леченных мышей –самцов на 9,3 %, начиная с 14 дня лечения и до одного месяца после прививки ОК. Максимальное торможения роста опухоли наблюдали на 14 -15 –сутки у мышей –самок, и на 19 -20 сутки у мышей –самцов, после перевивки -43,8 % у мышей –самок и 47,3 % у мышей — самцов. Эксперимент был прекращен на 45 –день после перевивки на 81,7 % выживании мышей — самок в леченной группе и на 50 день после перевивки на 79,3 % выживании мышей –самцов в леченной группе, тогда как все животные контрольных групп (мыши с-самки и мыши –самцы) погибли. После гистологической экспертизы внутренних органов мышей –самок и мышей –самцов экспериментальных групп, было выявлены следующие изменения. Очаги метастазирования в легких, были меньше у опытной группы мышей –самок, чем у опытной группы мышей –самцов на 3,2 %. Тогда как у контрольной группы данный показатель (метастазы в легких) у мышей –самок было больше в 4,35 раза по сравнению с данным показателем у мышей -самок опытной группы. И на 7,3 раза больше очагов метастазов наблюдалось у мышей — самцов контрольной группы, чем с данным показателем у мышей –самцов опытной группы. Масса селезенки была в несколько раз больше у мышей опытах групп, и не имела метастазов, тогда как селезенка у мышей контрольной группы имела очень маленькие размеры с большим количеством крупных метастазов.
Таким образом, тканевой препарат «Бурсанатал» проявил выраженное долгосрочное локальное и системное противоопухолевое действие на быстрорастущей подкожной BLRB модели РМЖ, особенно у мышей –самок в опытной группе. Возможно благодаря не только иммунных механизмов защитного действия, но и эндокринного фактора.
Литература:
- Кольберг, Н. А. Альтернативная терапия, современные методы профилактики и лечения при нарушениях обмена веществ в организме птицы / Н. А. Кольберг, Т. Р. Швецова, Т. М. Пасынкевич // Аграрный вестник Урала. — 2009. — № 12. — С. 60–65
- Кольберг Н. А. Влияние иммунокорректора «Бурсанатал» на качество мяса птицы, / Н. А. Кольберг, В. М. Позняковский // Мясная индустрия. — 2016. — № 11. — С. 44–46
- Кольберг Н. А. Влияние препарата «Бурсанатал» на иммунитет и обменные процессы организма животных и птиц / Н. А. Кольберг, В. М. Позняковский // АПК продукты здорового питания. — 2016. — № 10. — С. 34–38
- Ролик И. С. Фетальные органопрепараты: клиническое применение. Руководство для врачей. М.: РегБиоМед. 2003. 736 с.
- Ролик И. С. Аутоиммунная патология и фетальные органопрепараты.//Натуропатия и гомеопатия. 2003.1. 18 -20
- Ролик И. С. Основы клинической фармакологии и органопрепаратов. Руководство для врачей. М.: РегБиоМед. 2004. 336 с.
- Ролик И. С. Особенности фармакологии органопрепаратов. Принцип подобия Парацельса. //. По стопам Парацельса. 2005. 1. С.1
- Ролик И. С. Органопрепараты как экстракты клеточных пептидов — биорегуляторов.// Cabines Russie. 2009.70. 64 -67
- Холоденко И. В., Доронин И. И. Опухолевые модели в изучении онкологических заболеваний/ И. В. Холоденко//Иммунология. -2013 -№ 5. — С. 282 -286
- Adzick N. S., Longaker M. T. Therapeutic implications.//Ann.Surg.1992. 215 (1)/ 3 -7
- Christ H. W. Mehrgleisige immunmodulation bei Neurodermitis: drei Tropfen Thymusexntrakt helfen. // Aerztliche Praxis. 1995. 96. S. 15.
- Gianoli A. C. Revitalisation. Cytobiologische Revue. 1980. 4. 70 -74.
- Gianoli A. C. Revitalisationstherapie in Klinik und Praxis. // Z.praeklin. Geriatrie. 1975. 5/186 -192.
- Hagmaier W., Hoepke H., Landsberger A., Renner H. Erfolgreiche Behandlung Krebskranker durch Immuntherapie mit fetalem Mesenchym –Lyophilisat. // Cytobiol.Rev. 1979. 3/10 -14
- Kamb A. What's wrong with our cancer models? Nature Rev.Drug Discovery. 2005; 4: 161 -5.
- Ross S. R. Mouse mammary tumor virus molecular biology and oncogenesis. Virus. 2010; (9) 2000–12.
- Hess H. Die Therapie mit Biomodulatoren //Der Kassenarz. 1993. 25/26. 4
- Huss W. J., Maddison L. A., Greenberg N. M. Autochthonous mouse models for prostate cancer: past, present and future.Semin. Cahcer Biol.2001; 11: 245 -60
- Klein G., Klein E., Kolberg N. The transformation of a solid transplantable mouse carcinoma into an «ascites tumor». Cancer Res. 1951; 11: 466 -9.
- Ozaslan M., Karagoz I. D. Kilic I. H., Guldur M. E. Ehrlich ascites carcinoma. Aft. J. Biotech. 2011; 10 (13): 2375–8
- Renner H. Klinische Aspekte einer Tumor –Immuntherapie mit liophilisierten fetalen Zellen // Cytobiol.Rev. 1979. 3. 3–6.
- Theurer K. E. Innovative Biotherapie: Fortschritte d. Zell -, Molekularum immunobiologie. Stuttgart: Hippokrates –Verlag. 1987. 304 S.

