Приведены результаты лабораторных исследований технологии очистки сточных вод гальванопроизводств, предусматривающей электроактивацию растворов щелочных реагентов с образованием феррат натрия. Показано, что электроактивация 30 % раствора каустической соды позволяет снизить концентрации ионов тяжелых металлов в очищенных сточных водах: железа в 66 раз; меди в 90–146 раз;цинка в 56–100 раз; кадмия в 4 раза, хрома (III) в 3–6 раз.
Ключевые слова: щелочной реагент, феррат натрия, мембранный электролизер; реагентная очистка; электроактивация.
Одним из основных технологических приемов обезвреживания сточных вод гальванопроизводств, содержащих ионы тяжелых металлов является реагентный метод, предусматривающий дозирование в сточные воды щелочных реагентов.
Традиционно используемый на станциях нейтрализации реагентный метод осаждения катионов тяжелых металлов в виде их гидроксидов не обеспечивает необходимой степени извлечения из сточных вод высокотоксичных компонентов. В очищенных этим методом сточных водах присутствуют значительные остаточные концентрации ионов тяжелых металлов, находящихся в виде комплексных соединений. Разрушить эти соединения можно методами химической деструкции.
Методы химической деструкции загрязнений широко применяются в процессах очистки и доочистки сточных вод. Сущность процессов реагентной деструкции заключается в окислении загрязняющих соединений сточных вод в ходе протекания окислительно-восстановительных реакций [1–2].
Одним из наиболее мощных реагентов-окислителей является феррат натрия. Окислительный потенциал феррата натрия (в кислой среде Е° = +2,2 В) выше окислительного потенциала озона и является наибольшим в ряду реагентов-окислителей, используемых в настоящее время.
Феррат натрия проявляет ярко выраженные окислительные свойства и способен окислять многие токсичные вещества до малотоксичных продуктов. Окислительные и дезинфицирующие свойства феррата натрия были описаны многими авторами [1–2].
Феррат натрия представляет собой экологически чистый реагент-окислитель. В ходе обработки сточных вод феррат-ионами происходит восстановление железа с +6 до +3; в результате образуется нетоксичное соединение, обладающее ярко выраженными коагулирующими и флоккулирующими свойствами, — гидроксид железа(Ш) («ржавчина»). Поэтому феррат натрия может выступать в роли мощного дезинфицирующего, дезодорирующего и коагулирующего реагента.
На основании этого для активации щелочных реагентов, используемых на локальных канализационных очистных сооружениях гальваностоков, было предложено осуществлять на их основе технологический процесс электрохимического синтеза феррата натрия.
Наиболее простым и технологичным способом получения щелочного раствора феррата натрия является обработка крепкого раствора щелочи в электролизере с железным анодом.
С целью повышения выхода по току основного продукта предлагается разделять прикатодные и прианодные области электролита в электролизере неселективной мембраной, что позволяет предотвратить восстановление на катоде образовавшегося феррата натрия.
Феррат натрия является нестабильным соединением, в присутствии воды он со временем разлагается с выделением кислорода.
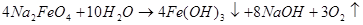 (1)
(1)
Период полураспада раствора феррата натрия в 40 % щелочи (NaOH) составляет 7 суток.
Будучи сильным окислителем, феррат натрия легко окисляет комплексные соединения тяжелых металлов, что должно способствовать повышению эффективности процесса реагентной очистки сточных вод гальванопроизводств. При этом феррат натрия, в отличие от хлора, не образует токсичных продуктов реакции.
Продуктом ферратной обработки является гидроксид железа(Ш), выступающий в роли коагулянта. Поэтому ферратная обработка позволит увеличить гидравлическую крупность образующегося осадка и существенно интенсифицировать работу сооружений, предназначенных для осветления сточных вод.
Окислительно-восстановительный потенциал феррат-ионов зависит от рН среды.
В кислой среде уровень окислительно-восстановительного потенциала феррат-ионов достигает величины Е0 = +2,2 В
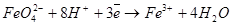 (2)
(2)
В нейтральной и щелочной среде значение окислительно-восстановительного потенциала феррат-ионов Е° = +0,72 В.
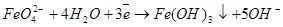 (3)
(3)
В процессе взаимодействия с водой одна молекула феррата натрия образует 5 ионов 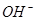 , что обусловливает повышенный уровень щелочности обработанных сточных вод, вследствие чего можно ожидать существенного сокращения расхода щелочных реагентов на локальных очистных сооружениях гальваностоков.
, что обусловливает повышенный уровень щелочности обработанных сточных вод, вследствие чего можно ожидать существенного сокращения расхода щелочных реагентов на локальных очистных сооружениях гальваностоков.
На первом этапе исследований проводилось изучение влияния концентрации раствора каустической соды на стабильность полученного реагента-окислителя.
Исследовали модельные растворы каустической соды в водопроводной воде с массовой концентрацией щелочи по товарному продукту 50 % и 30 %.
В первой серии опытов в электролизер заливали 100 мл 50 % раствора каустической соды и проводили электрообработку. Полученный образец активированного 50 % раствора каустической соды, содержащий 1 % феррата натрия, хранили в темном месте при температуре 20°С. Период полного распада 1 % раствора феррата натрия в 50 % растворе каустической соды составил 360 ч.
Во второй серии опытов в электролизер заливали 100 мл 30 % раствора каустической соды и проводили его электрообработку. Период полного распада 1 % раствора феррата натрия в 30 % растворе каустической соды составил 140 ч.
На втором этапе исследований проводили изучение процесса реагентной очистки реальных сточных вод гальванопроизводств с использованием активированных растворов каустической соды. Сточные воды отбирали в мерный стакан вместимостью 1 л, и в них дозирующим устройством переменного объема вводили раствор каустической соды. Перемешивание сточных вод с реагентами осуществляли с помощью магнитной мешалки.
Было проведено четыре серии экспериментов — две для 50 % и две для 30 % раствора каустической соды. В контрольных сериях использовали неактивированные растворы каустической соды. В опытных сериях экспериментов использовали активированные растворы каустической соды, прошедшие обработку в электролизере (т. е. содержащие феррат натрия).
После 15-минутного перемешивания в сточные воды дозировали флоккулянт (полиакриламид). Сточные воды перемешивали в течение 3 минут, затем отключали магнитную мешалку, сточные воды отстаивались в течение 30 минут. Осветленные сточные воды отбирали на химический анализ. Часть объема отобранных осветленных сточных вод подвергали фильтрации через бумажный фильтр. Полученный фильтрат также отправляли на химический анализ.
Дополнительно повысить эффективность химического осаждения ионов тяжелых металлов можно за счет применения реагентов-осадителей, содержащих сульфидные соединения. Было принято решение изучить возможность дополнительной обработки сточных вод, прошедших очистку с использованием активированного раствора каустической соды, сульфидом натрия (концентрация сульфида натрия по товарному продукту в обрабатываемых сточных водах 10 мг/л).
Результаты исследования процесса очистки сточных вод гальвано-производств с использованием 50 % растворов щелочи (каустической соды) представлены в табл. 1.
Таблица 1
Результаты исследований процесса очистки сточных вод гальвано-производств с использованием 50 % растворов щелочи
|
Показатели загрязнений сточных вод |
Концентрации загрязнений в исходных сточных водах, мг/л |
Концентрации загрязнений в сточных водах, обработанных щелочью, после отстаивания, мг/л |
Эффект очистки сточных вод с использованием щелочи после отстаивания, % |
Концентрации загрязнений в сточных водах, обработанных активированной щелочью, после отстаивания, мг/л |
Концентрации загрязнений в сточных водах, обработанных активированной щелочью, после отстаивания и фильтрации, мг/л |
Концентрации загрязнений в сточных водах, обработанных активированной щелочью и сульфидом, после отстаивания и Фильтрации, мг/л |
Эффект очистки сточных вод с использованием активированной щелочи и сульфида после отстаивания и фильтрации, % |
|
Железо |
19,75 |
3,29 |
83,3 |
1.99 |
- 0.05 |
<0,05 |
99,8 |
|
Медь |
0,74 |
0,45 |
39,2 |
0,23 |
<0,005 |
<0,005 |
99,3 |
|
Хром(Ш) |
1,92 |
0,64 |
66,7 |
0,73 |
0,26 |
0,26 |
86.5 |
|
Цинк |
1,92 |
0,28 |
85,4 |
<0,005 |
<0,005 |
< 0.005 |
99,7 |
|
Кадмий |
1,20 |
0.02 |
98,3 |
0,1 |
0,015 |
< 0.005 |
99,6 |
В процессе реагентной обработки сточных вод как в контрольной, так и в опытной серии экспериментов в мерный стакан дозировали по 0,42 мл раствора щелочи. При добавлении неактивированного раствора каустической соды значение рН сточных вод увеличилось до 9,52. При добавлении активированного раствора каустической соды значение рН сточных вод возросло до 9,61.
Более значимое увеличение уровня рН сточных вод при добавлении в них активированного раствора каустической соды может быть объяснено протеканием реакции окисления ферратом натрия, сопровождающейся выделением 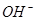 -ионов (согласно уравнению (3)).
-ионов (согласно уравнению (3)).
Результаты исследования процесса очистки сточных вод гальвано-производств с использованием 30 % растворов щелочи (каустической соды) представлены в табл. 2.
Таблица 2
Результаты исследований процесса очистки сточных с использованием 30 % раствороввод гальвано-производств щелочи
|
Показатели загрязнений сточных вод |
Концентрации загрязнений в исходных сточных водах, мг/л |
Концентрации загрязнений в сточных водах, обработанных щелочью, после отстаивания, мг/л |
Эффект очистки сточных вод с использованием щелочи после отстаивания, % |
Концентрации загрязнений в сточных водах, обработанных активированной щелочью, после отстаивания, мг/л |
Концентрации загрязнений в сточных водах, обработанных активированной щелочью, после отстаивания и фильтрации, мг/л |
Концентрации загрязнений в сточных водах, обработанных активированной щелочью и сульфидом, после отстаивания и фильтрации, мг/л |
Эффект очистки сточных вод с использованием активированной щелочи и сульфида после отстаивания и фильтрации, % |
|
Железо |
2,30 |
<0,05 |
97,8 |
< 0.05 |
<0,05 |
<0,05 |
97.8 |
|
Медь |
1,72 |
0,73 |
57.6 |
0,31 |
<0,005 |
<0,005 |
99.7 |
|
Хром(Ш) |
0,90 |
0,28 |
68,9 |
<0,05 |
<0,05 |
<0,05 |
94,4 |
|
Цинк |
0.78 |
0,50 |
35,9 |
0,18 |
<0,005 |
<0,005 |
99,4 |
|
Кадмий |
1,02 |
0,02 |
98,0 |
0,07 |
0.01 |
<0,005 |
99,5 |
В процессе реагентной обработки сточных вод в контрольной серии экспериментов в мерный стакан добавляли 0,32 мл неактивированного раствора щелочи. Значение рН сточных вод увеличилось до 9,86. После 15-минутного перемешивания сточных вод магнитной мешалкой уровень рН сточных вод понизился до 9,4, что может быть объяснено образованием гидроксидов тяжелых металлов.
В опытной серии экспериментов при реагентной обработке сточных вод в мерный стакан добавляли 0,27 мл активированного раствора щелочи. Значение рН сточных вод увеличилось до 9,75. После 15-минутного перемешивания сточных вод магнитной мешалкой, несмотря на интенсивные образования хлопьев гидроксидов тяжелых металлов, уровень рН сточных вод повысился до 9,86.
Процесс повышения уровня рН сточных вод после их обработки активированным раствором щелочи, как было указано выше, может быть объяснен протеканием реакции окисления ферратом натрия, сопровождающейся выделением 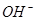 -ионов.
-ионов.
Таким образом, активационная обработка 30 % раствора каустической соды в мембранном электролизере с железным анодом позволяет уменьшить расход щелочи на процесс реагентной очистки сточных вод гальванопроизводств в 1,19 раза.
Выделяющийся в процессе гидролиза феррата натрия гидроксид железа(Ш) является коагулянтом. Поэтому использование активированного раствора каустической соды позволило существенно улучшить седиментационные свойства образующегося осадка. Гидравлическая крупность образующегося в контрольной серии экспериментов осадка составила и0 = 0,4–0,7 мм/с, а в опытной серии экспериментов гидравлическая крупность образующегося осадка достигала значений и0 = 3–5 мм/с.
Значительное повышение величины гидравлической крупности осадка, образующегося в процессе реагентной обработки сточных вод, позволит существенно интенсифицировать работу установленных на локальных канализационных очистных сооружениях осветлителей.
Внедрение на сооружениях по очистке сточных вод гальванопроизводств предлагаемой технологии активации щелочных реагентов может обеспечить достижение качества очищенных сточных вод, требуемого при сбросе их в водоем, и снизить концентрации ионов тяжелых металлов; железа — в 66 раз, меди — в 90–146 раз, цинка — в 56–100 раз, кадмия — в 4 раза, хрома(Ш) — в 3–6 раз.
Литература:
1. Яковлев, С. В. Водоотводящие системы промышленных предприятий / С. В. Яковлев, Я. А. Карелин, Ю. М. Ласков. — М: Стройиздат, 1990. — 510 с.
2. Перфильев, Ю. Д. Новая ферратная технология очистки воды / Ю. Д. Перфильев, Л. А. Куликов, С. К. Дедушенко. — М.: МГУ им. М. В. Ломоносова, 2004. — 7 с.

