Методами определения фотокаталитической активности (потенциометрически и хроматографически) изучены фотокаталитические свойства поверхности бинарных компонентов (CdS, ZnTe) и твердых растворов на их основе(CdS)x(ZnTe)1-x. По полученным УФ–спектрам рассчитаны значения ΔЕ — ширины запрещенной зоны, исходя из которых компоненты системы CdS–ZnTe могут проявлять фотокаталитическую активность при длине волны от 364 до 670 нм. По разработанной методике создана схема модельной установки получения водорода из воды.
Ключевые слова: фотокатализ, полупроводники, твердые растворы, водород, хроматография, УФ–спектроскопия.
1. Введение
О водородной энергетике мечтают давно: удельная теплота сгорания водорода в три раза выше, чем у нефти или бензина; продуктом сгорания водорода является водяной пар; ресурсы сырья для получения водорода безграничны. Именно материалы полупроводниковой природы в настоящее время нашли широкое применение в процессах, связанных с фотокатализом.
Преобразование солнечной энергии в химическую может происходить в результате любой эндотермической реакции, протекающей под действием видимого света [1, 2].
Система фотохимической конверсии, основанная на окислительно-восстановительном процессе, должна включать фотоиндуцированную реакцию переноса электрона. В таком случае молекула поглощает квант энергии определенной величины, переходит в электронное возбужденное состояние, в котором является лучшим окислителем и восстановителем, чем в основном состоянии.
При реакции переноса электрона между таким возбужденным состоянием и подходящим реакционным партнером часть энергии поглощенного света переходит в химическую энергию (рис. 1).
Исходное вещество, например вода, которую желательно превратить в топливо
Н2О →Н2(г) + ½ О2(г)
не возбуждается солнечным светом (спектр электронного поглощения воды не совпадает со спектром излучения солнца). Именно поэтому мы используем полупроводниковые сенсибилизаторы системы CdS–ZnTe.
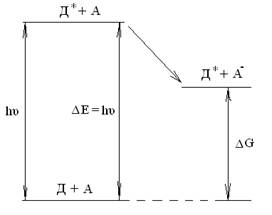
Рис. 1. Диаграмма конверсии световой энергии в химическую (Д — донор, А — акцептор)
Свет сначала используется для генерирования окислительно-восстановительных эквивалентов [3–5]. В качестве восстановителя можно использовать восстановленную форму переносчика (R–) или электрон (e–cb) в частице полупроводника, в качестве же окислителя — окисленную форму сенсибилизатора (S+) или дырки в валентной зоне (h+) в частице полупроводника. Световая реакция связана с темновым (каталитическим) процессом образования водорода и кислорода из воды и регенерированием исходных реагентов (рис. 2).
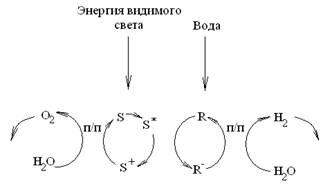
Рис. 2. Принципиальная схема циклов разложения воды
Процесс окисления воды с использованием полупроводников идет по реакции:
4h (CdS) + 2H2O → O2 + 4H+
Водород и кислород генерируют соответственно с помощью электронов зоны проводимости и дырок валентной зоны, полученных при зон-зонном возбуждении [6–8].
В работе исследованы фотокаталитические свойства сульфида кадмия, теллурида цинка и их твердых растворов (CdS)х(ZnTe)1–х вреакции разложения воды. Фотокаталитическую активность определяли потенциометическим и хроматографическим методами в щелочной среде.
Приготовленные суспензии CdS, ZnTe, и (CdS)х(ZnTe)1–х подвергали облучению галогенной лампой при λ = 364–670 нм. Оптимальная длина волны, при которой следует ожидать наиболее эффективного протекания фотокаталитического процесса должна соответствовать значению ширины запрещенной зоны. Если использовать кванты света больше ΔЕ, то их энергии вполне достаточно для переноса электрона из валентной зоны полупроводников системы CdS–ZnTe в зону проводимости.
Условия облучения суспензий отражены в табл. 1.
Таблица 1
Оптимальная длина волны для преодоления энергетического барьера в полупроводниках системы (CdS)x−(ZnTe)1–x
|
Состав |
l, нм |
|
CdS |
≤ 509 |
|
(CdS)0,9(ZnTe)0,1 |
≤ 575 |
|
(CdS)0,75(ZnTe)0,25 |
≤ 466 |
|
(CdS)0,5(ZnTe)0,5 |
≤ 763 |
|
(CdS)0,25(ZnTe)0,75 |
≤ 615 |
|
(CdS)0,1(ZnTe)0,9 |
≤ 555 |
|
ZnTe |
≤ 554 |
2. Фотокатализ водных суспензий компонентов системы CdS–ZnTe
Результаты выполненных исследований фотокаталитических свойств сульфида кадмия, теллурида цинка и твердых растворов на их основе в вводной суспензии представлены в табл. 2.
Из приведенных данных зависимостей изменения концентрации ионов водорода в водных суспензиях полупроводников системы CdS–ZnTeпри облучении длинами волн видимой части спектра (λ = 364–670 нм) видно: происходит выделение водорода, что подтверждено потенциометрически (рН изменяется от ~12,90 до ~9,25) и хроматографически. Наибольший скачок разницы водородного показателя наблюдается не только в течение первого часа облучения, но и при последующей выдержки суспензии в свете облучения.
Таблица 2
Изменение концентрации ионов водорода в процессе облучения водной суспензии (CdS)х(ZnTe)1-х при разных длинах волн в течение 5 часов
|
[Н+]∙ 103, нмоль/л Образец |
λ = 364нм |
λ = 490нм |
λ = 540нм |
λ = 590нм |
λ = 670нм |
|
CdS |
456,2 |
9,42 |
– |
– |
– |
|
(CdS)0,9(ZnTe)0,1 |
119,52 |
12,09 |
4,11 |
– |
– |
|
(CdS)0,75(ZnTe)0,25 |
20,09 |
– |
– |
– |
– |
|
(CdS)0,5(ZnTe)0,5 |
5,12 |
3,15 |
1,28 |
1,01 |
0,96 |
|
(CdS)0,25(ZnTe)0,75 |
3,75 |
2,36 |
1,74 |
0,55 |
– |
|
(CdS)0,1(ZnTe)0,9 |
1,45 |
0,9 |
0,39 |
– |
– |
|
ZnTe |
1,05 |
0,96 |
0,54 |
– |
– |
По данным УФ–спектроскопии установлено, что края полос отражения для исследованных полупроводников лежат почти во всем диапазоне спектра, т. е. компоненты системы CdS–ZnTe могут проявлять фотокаталитическую активность при длине волны от 364 до 670 нм.
Изменение концентрации ионов водорода в процессе облучения водной суспензии наиболее интенсивно протекает при λ = 364нм (табл. 3).
Таблица 3
Результаты хроматографического анализа (λ = 364нм)
|
Концентрации, % Образец |
Х кислорода |
Хводорода |
|
CdS |
19,42 |
80,58 |
|
(CdS)0,9(ZnTe)0,1 |
27,75 |
72,25 |
3. Заключение
Как показали исследования, теллурид цинка, а также твердые растворы содержащие 50, 75 и 90 об. % ZnTe, значительной фотокаталитической активностью в реакции разложения воды не обладают. Возможно, это связано с влиянием свойств легирующей примеси — ZnTe.
При облучении полупроводников системы CdS–ZnTe при разных длинах волн наибольшая концентрация ионов водорода в водной суспензии при λ = 364нм отмечалась для CdS ([Н+] ∙ 103 = 457,09 нмоль/л) и для (CdS)0,9(ZnTe)0,1 ([Н+] ∙ 103 = 120,23 нмоль/л), об этом свидетельствуют результаты хроматографического анализа.
Проведение точно такой же реакции, но без сульфида кадмия не дает положительных результатов: значение водородного показателя не изменяется.
По впервые разработанной методике создана схема модельной установки по получению водорода из воды (рис. 4).
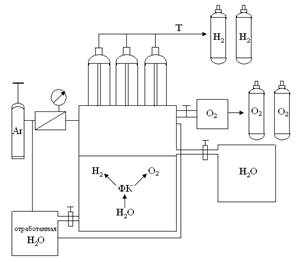
Рис. 4. Принципиальная схема получения водорода из воды с использованием в качестве фотокатализатора исследуемые бинарные соединения и твердые растворы системы CdS–ZnTe
Литература:
1. Замараев К. И., Пармон В. Н. Фотокаталитическое преобразование солнечной энергии: гетерогенные, гомогенные и молекулярно-организованные системы. Новосибирск: Наука. Сиб. Отд-ние, 1991. 358 с.
2. Пармон В. Н. Фотокаталитическое преобразование солнечной энергии. Химические и биологические методы. Новосибирск: Наука. Сиб. отд–ние, 1985. В 2 ч. Ч. 1. С. 42–58.
3. Медведев С. А. Физика и химия соединений AIIBVI. М.: Изд–во «Мир», 1970. 624с.
4. Карпова Е. О., Нагибина И. Ю. Технология полупроводникового фотокатализа — экологически чистого способа прямого использования солнечной энергии // Омский научный вестник. Омск: Изд-во ОмГТУ, 2013. № 3 (123). С. 304–307.
5. Кировская И. А., Тимошенко О. Т., Карпова Е. О. Каталитические и фотокаталитические свойства компонентов системы InP-CdS, ZnTe–CdS // Журнал Физической Химии. 2011. Т. 85, № 4. С. 633–636.
6. Kirovskaya I. A., Timoshenko O. T., Karpova E. O. The Catalytic and Photocatalytic Properties of InP–CdS and ZnTe–CdS System Components // J. Phys. Chem. 2011. Vol. 85. Nо 4. РР. 557–560.
7. Саката Т., Каваи Т. Фотосинтез и фотокатализ на полупроводниковых порошках // Энергетические ресурсы сквозь призму фотохимии и катализа. М.: Мир, 1986. С. 361–388.
8. Мурадов Н. З., Бажутин Ю. В., Безуглая А. Г. Фотосенсибилизированное сульфидом кадмия разложение сероводорода в водных растворах под действием видимого света // Журнал Физической Химии. 1982. Т. 56, № 10. С. 2563–2564.







