В данной статье исследуются вопросы эффективности, связанные с современными методами диагностики инсульта. Рассматриваются лучевые методы, такие как компьютерная томография и магнитно-резонансная томография, для точного определения размеров и объема повреждений мозга. Электрофизиологические методы, включая электроэнцефалографию, используются для выявления областей ишемического повреждения. Кроме того, статья обсуждает роль метаболических биомаркеров и молекулярных методов исследования в диагностике инсульта, предоставляя информацию о состоянии пациента и тяжести заболевания, статья также охватывает модель фототромботического инсульта (ФТИ) и анализирует плюсы и минусы данной модели, данные методы исследования имеют потенциал улучшить точность и своевременность диагностики инсульта.
Ключевые слова: инсульт, диагностика, лучевые методы, электрофизиологические методы, метаболические биомаркеры, молекулярные методы, модель фототромботического инсульта, преимущества, ограничения.
Инсульт является одной из основных причин смертности и инвалидности в мире [1]. Несмотря на огромное число исследований, терапевтические возможности для пациентов с инсультом остаются очень ограниченными. Это заставляет продолжать исследования тонких патофизиологических механизмов развития инсульта с целью разработки новых эффективных средств его профилактики и лечения.
Инсульт занимает второе место среди причин смерти в мире с годовой смертностью около 5,5 млн человек. Бремя цереброваскулярных заболеваний заключается не только в высокой смертности, но и в высокой заболеваемости, которая также приводит к тому, что до 50 % выживших становятся хроническими инвалидами [2]. Как правило, среди всех инсультов на долю ишемического инсульта (ИИ) приходится около 80 % случаев, но фактические пропорции типов инсульта зависят от популяции [3].
Лучевые методы определения размеров и объема очага повреждения. В настоящее время для определения объема ишемического повреждения и выявления области пенумбры как в клинике, так и в эксперименте применяются различные технологии МРТ [6]. Объем очага повреждения определяют чаще всего с использованием Т2-взвешенных МРТ изображений [9]. Это эффективный неинвазивный метод оценки размера инфаркта в течение первых 2 недель после начала ишемии. Методы объемной микроскопии всего мозга, такие как серийная двухфотонная томография (STPT), могут дать подробную информацию о процессах повреждения и регенерации в мозге после инсульта [4]. Также для сравнения размера и расположения области поражения применяют автоматизированное картирование, анализ связей и гистологических структур с использованием атласа [6]. Следует отметить, что, в отличие от других моделей инсульта, при ФТИ вазогенный отек, который соответствует сильному гиперинтенсивному сигналу на T2WI, проходит в течение первых 2 недель после инсульта и трансформируется в гипоинтенсивную полость.
Электрофизиологические методы выявления области ишемического повреждения. Разрабатываются и другие способы для количественной оценки структурного повреждения головного мозга на модели ФТИ у крыс, в частности — с помощью электроэнцефалографии (ЭЭГ). Спектральный анализ выявил статистически значимую корреляцию относительных мощностей альфа, тета, дельта, отношения дельта/альфа, отношение (дельта + тета) / (альфа + бета) с объемом инсульта. Анализ слухового вызванного потенциала выявил значительную связь амплитуды и латентного периода с объемом инсульта. Эти результаты демонстрируют возможности ЭЭГ в качестве метода мониторинга повреждения головного мозга после инсульта [16].
Инсульт в артериях вертебробазилярной системы (ВВС) составляет 20–25 % в структуре ишемического инсульта и часто носит жизнеугрожающий характер. Для инсульта в артериях ВВС характерны широкий спектр неспецифических симптомов, множество имитаторов и зачастую атипичная клиническая картина, что нередко обусловливает позднюю или неправильную диагностику.
Обсудим наиболее сложные ситуации, встречающиеся в клинической практике.
Вялый тетрапарез и стволовая дисфункция (бульбарный синдром, парез мышц языка, дыхательные нарушения).
Может развиться при двустороннем инфаркте продолговатого мозга, который составляет в структуре инсульта в артериях ВВС всего 1 % и связан с окклюзией передней спинальной артерии (чаще на фоне атеросклеротического стеноза позвоночной артерии в сегменте V4). На МРТ форма инфаркта напоминает сердце [14]. Описанная клиническая картина требует проведения дифференциальной диагностики с синдромом Гийена—Барре, который характеризуется прогрессированием симптомов более суток (пик — 2 нед), дистальными парестезиями в дебюте (с наличием болей или без них), восходящим тетрапарезом, арефлексией, отсутствием патологических рефлексов; также могут наблюдаться нарушение фотореакций зрачков и двусторонний парез мимических мышц. Типична моторная или сенсомоторная полиневропатия по данным электро-нейромиографии, а также повышение уровня белка в цереброспинальной жидкости со 2-й недели заболевания [5].
Также должна проводиться дифференциальная диагностика с миастеническим кризом. Следует обращать внимание на наличие миастении в анамнезе и провоцирующие факторы (инфекционное заболевание, прием антибиотиков и некоторых других препаратов, аспирация, хирургические операции, беременность, депривация сна, физический и эмоциональный стресс). Мышечная слабость зависит от активности (в том числе увеличивается к вечеру), характерны слабость мышц шеи («свисающая голова», «свисающая челюсть»), двусторонний птоз, попадание еды и жидкости в нос при глотании, а также двусторонний парез мимических мышц [16].
Положительные пробы на патологическую утомляемость и проба со льдом (ice test), отсутствие патологических рефлексов и ответ на прозерин свидетельствуют о миастении, для подтверждения чего используется элект-ромиографический декремент-тест, однако он нечасто доступен в условиях оказания экстренной помощи. Другой причиной развития обсуждаемой клинической картины может явиться осмотический демиелинизирующий синдром, известный также как центральный понтинный миелинолиз. Заболевание наблюдается у 2,5 % пациентов отделений интенсивной терапии; 30–78 % случаев связаны с гипонатриемией и/или ее быстрой коррекцией. К другим причинам относятся хронический алкоголизм, цирроз печени, нутритивная недостаточность, почечная недостаточность, ожоги и опухоли. Воздействие триггера обычно предшествует симптомам в интервале от 1 до 14 дней.
Симптоматика зависит от локализации демиелинизации. Наиболее частое проявление — энцефалопатия с нарушением уровня бодрствования / сознания, делирием, нарушением памяти и внимания. При центральном понтинном миелинолизе с нейровизуализационной картиной тотального поражения часто развивается синдром запертого человека. Также характерны дизартрия, дисфагия, зрачковые, глазодвигательные нарушения и угнетение сухожильных рефлексов. Подтверждением диагноза служит МРТ головного мозга, демонстрирующая типичную локализацию демиелинизации в центральных отделах моста мозга — симптом «крыла летучей мыши» или «трезубца Нептуна (Посейдона)» [7].
Острый приступ головокружения. Головокружение является одним из наиболее частых симптомов инфаркта мозжечка. Каждый десятый пациент с инфарктом мозжечка испытывает изолированное головокружение. У четырех из пяти пациентов имеется инфаркт в бассейне медиальных ветвей задней нижней мозжечковой артерии с вовлечением узелка, реже головокружение возникает при инсульте в бассейне верхней или передней нижней мозжечковой артерии. В последнем случае (при инфаркте в бассейне лабиринтной артерии) развивается острый кохлеовестибулярный синдром. Несмотря на то, что инсульт в артериях ВВС часто проявляется головокружением в сочетании с очаговой неврологической симптоматикой, малые инфаркты с вовлечением нижней ножки мозжечка, узелка и вестибулярных ядер могут вызвать изолированное головокружение.
Первичная дифференциальная диагностика острого головокружения проводится в рамках острого вестибулярного синдрома, который, с использованием алгоритма NIHTS+ или его модификаций, далее подразделяется на центральный и периферический [3]. Для центрального варианта синдрома, обычно связанного с поражением/дисфункцией структур мозжечка, характерны разнонаправленный взор-индуцированный нистагм, вертикальный нистагм, торсионный нистагм, отрицательный импульсный тест поворота головы (ИТПГ), а также выраженная туловищная атаксия [3]. Наличие последней специфично для инфаркта мозжечка [4].
Иногда за несколько часов или дней до развития острого вестибулярного приступа больные испытывают кратковременные эпизоды головокружения или неустойчивости, что также требует проведения дифференциальной диагностики с транзиторной ишемической атакой [36]. Слух при нейроните не снижается, если нет сочетанных заболеваний или острого лабиринтита / инфаркта лабиринта. Отсутствуют симптомы поражения ствола или других отделов головного мозга. Изредка инфаркт с избирательным поражением области входа вестибулярного нерва в продолговатый мозг, вестибулярных ядер, дорсолатеральных отделов моста или клочка мозжечка может проявляться головокружением, имитирующим вестибулярный нейронит (синдром псевдо-нейронита) [5]. Также характерен быстрый регресс, как головокружения, так и нистагма, тогда как при нейроните спонтанный нистагм сохраняется длительное время (особенно при его визуализации с использованием очков Френзеля или системы «Видеофрензель»). Данный метод диагностики эффективен так как, минимизация ошибок в дифференциальной диагностике периферического острого вестибулярного синдрома достигается при помощи использования количественных тестов — видеонистагмографии и видео-ИТПГ [8].
Существенные диагностические сложности, в применении данного метода, могут возникнуть при наличии у пациента изолированного позиционного нистагма. При наличии признаков нетипичности (изолированный меняющий направление позиционный нистагм, несоответствие характеристик нистагма предположительно вовлеченному полукружному каналу, отсутствие латентного периода, персистирование и отсутствие ответа на репозиционные маневры) следует в первую очередь исключать инфаркт мозжечка с поражением клочка или узелка.
Таким образом, инсульт в артериях ВВС характеризуется чрезвычайно вариабельной клинической картиной. Несмотря на то, что у большинства пациентов имеются неспецифичные в отношении локализации поражения симптомы, при данном виде инсульта могут наблюдаться синдромы, распознавание которых значительно ускоряет постановку диагноза. Низкая информативность методов нейровизуатизации в ранние сроки заболевания в совокупности с малой специфичностью клинической картины определяет необходимость дифференциальной диагностики инсульта в артериях ВБС.
Несомненно, что клинические методы дифференциальной диагностики, продолжает играть ключевую роль в ведении пациентов с инсультом в артериях ВБС.
В 2023 году, в основе общепринятых представлений о первичной и вторичной профилактике ишемического инсульта (ИИ) лежит концепция факторов риска (ФР). Инструментами прогнозирования служат шкалы риска и таблицы стратификации риска, в которые, как правило, включены традиционные ФР — возраст и пол, сердечно-сосудистые заболевания (ССЗ), сахарный диабет (СД), высокий уровень холестерина в крови, малоподвижный образ жизни, фибрилляция предсердий, курение и употребление алкоголя.
В то же время существует понятие так называемого «резидуального (остаточного) риска». Это риск макро- и микрососудистых осложнений, который сохраняется у большинства пациентов, несмотря на современные стандарты терапии, включающие оптимальный контроль показателей уровня холестерина липопротеидов низкой плотности (ХС ЛПНП), артериального давления (АД) и глюкозы крови [5]. Предполагаемыми механизмами «резидуального риска» могут быть воспалительный, тромботический и метаболический [6]. Для повышения диагностической значимости шкал оценки риска цереброваскулярных заболеваний и ИИ в них включают разные биомаркеры, которые участвуют в механизмах развития макро- и микрососудистых осложнений. Под биомаркером понимают «характеристику, которая объективно измеряется и оценивается как индикатор нормальных биологических процессов, патогенных процессов или фармакологического ответа на терапевтическое вмешательство» [7]. Хотя термин биомаркер может включать клинические или визуализационные измерения, он обычно используется для описания молекул, обнаруженных в жидкостях организма [8]. В зависимости от своей роли биомаркеры делятся на три основные категории: скрининговые, диагностические и прогностические. Биомаркеры могут предоставить информацию о гетерогенности развития и стать ориентиром для более эффективной персонализированной стратификации риска инсульта.
Потенциальными биомаркерами для скрининга субъектов высокого риска по развитию инсульта были названы: С-реактивный белок (СРБ), фибриноген, провоспалительные цитокины, фактор фон Виллебранда, мозговой натрийуретический пептид (BNP), соотношение альбумин/креатинин в моче, асимметричный диметиларгинин (ADMA) и другие. [9]. По данным другого обзора, при изучении значений 23 биомаркеров в развитии атеротромботического подтипа инсульта авторы в качестве перспективных биомаркеров для скрининга выделили ассоциированный с беременностью плазменный белок-А и фактор роста эндотелия сосудов. Однако в настоящее время недостаточно доказательств для применения этих биомаркеров в клинической практике [10].
Zanetti D. et al. [11] в 2020 г. выполнили исследование для оценки причинно-следственных ассоциаций 27 циркулирующих биомаркеров с 7 сердечно-сосудистыми событиями у 451 933 участников (UK. Biobank) в сочетании с данными общедоступной сводной статистики GWAS (англ, genome-wide association studies). После менделеевской рандомизации было обнаружено 9 биомаркеров крови, связанных с развитием ИИ.
Однако, по данным другого анализа, только для гликированного гемоглобина была установлена связь с ИИ (отношение шансов (ОШ)=1,132; ДИ 95 % 1,072–1,193; р=8,01х10‘5) [15].
Таким образом, на сегодняшний день трудно выделить тот скрининговый биомаркер, который наиболее диагностически значим для оценки высокого риска развитию инсульта.
Метаболические биомаркеры. Известно, что инсулинорезистентность (ИР)-ключевое звено в патогенезе сахарного диабета 2-го типа и, следовательно, повышенного риска инсульта. Диагноз ИР у большинства пациентов основывается на клинических данных (признаках метаболического синдрома): гипергликемия, дислипидемия, абдоминальное ожирение, АД выше 130/80 мм рт. ст. Из биохимических показателей гиперинсулинемический-эугликемический клэмп-тест (HIEC) считается текущим «золотым стандартом» для определения ИР, однако из-за трудностей в его выполнении в клинической практике используется редко. Распространенные анализы на ИР НОМА или HOMA-IR имеют ограничения для их использования, в том числе изменения функции (3-клеток с течением времени, отсутствие стандартизированного универсального анализа инсулина и отсутствие данных, демонстрирующих, что маркеры резистентности к инсулину предсказывают ответ на лечение. Поэтому исследователи начали изучать триглицерид-глюкозный индекс (TyG) — простой, экономически эффективный,
В 2023 году, выявление новых биомаркеров, ассоциированных с атеросклерозом и «остаточным риском», может дать новые инструменты для стратификации гетерогенной популяции пациентов на группы риска. В настоящее время существует перспективность целого ряда гемодинамических, кардиальных, коагуляционных, воспалительных, эндотелиальных сывороточных биомаркеров, которые могут применяться в прогнозировании риска развития ИИ. Дальнейшие наблюдения, особенно масштабные проспективные клинические исследования, необходимы для оценки значимости таких биомаркеров. Кроме того, правильные пороговые уровни должны быть точно интерпретированы и тщательно переоценены, прежде чем их можно будет использовать в клинической практике.
Церебральная амилоидная ангиопатия (ЦАА) — хроническое цереброваскулярное заболевание, обусловленное отложением бета-амилоида в стенках артерий среднего и мелкого калибров головного мозга [1]. В настоящее время возрастает интерес исследователей всего мира к этому заболеванию, что объясняется ростом его распространенности и повышением риска развития инсультов и деменции у больных с этой патологией [2]. Для подтверждения диагноза данного заболевания на сегодняшний день применяются модифицированные Бостонские критерии, в соответствии с которыми выделяют достоверный, вероятный и возможный варианты ЦАА [3].
«Достоверная ЦАА» может быть установлена на основании данных патоморфологического исследования при выявлении кровоизлияний типичной локализации в отсутствие иных диагностически значимых повреждений головного мозга. Именно посмертная биопсия головного мозга рассматривается как главный метод верификации ЦАА [4].
В реальной клинической практике наибольшее значение имеет диагноз «Вероятная ЦАА», который устанавливается с учетом клинических и нейровизуализационных данных. Выделяют строго специфичные геморрагические нейровизуализационные маркеры ЦАА и негеморрагические маркеры патологии белого вещества головного мозга, к которым, в частности, относятся гиперинтенсивности белого вещества (ГБВ, англ.— White Matter hyperintensites) [5]. ГБВ представляют собой зоны повышения сигнала по магнитно-резонансной томографии (МРТ) в режимах T2/FLAIR в белом веществе головного мозга [16] и могут отмечаться при микроангиопатии головного мозга разного генеза, но наиболее часто— при ЦАА и гипертензивной церебральной микроангиопатии (гЦМА) [17]. Сходство клинических проявлений патологии мелких церебральных сосудов при ЦАА и гЦМА диктует необходимость поиска методов их дифференциальной диагностики, поскольку тактика ведения пациентов с данными состояниями отличается [8].
В то время как для гЦМА ГБВ являются одними из признанных «нейровизуализационных маркеров» при выполнении МРТ головного мозга [9], взаимосвязь между ЦАА и наличием ГБВ стала изучаться лишь в последнее десятилетие [10]. Следует отметить, что для ЦАА характерно преобладание ГБВ в задних отделах головного мозга и в перивентрику-лярном белом веществе, окружающем задние рога боковых желудочков, а при гЦМА в патологический процесс вовлекается вся перивентрикулярная область.
Несмотря на повсеместное внедрение в клиническую практику КТ и МРТ, предоставивших возможность прижизненной верификации ЦАА, на сегодняшний день вопросы ранней диагностики этой патологии до конца не решены [15]. Наряду с ЦАА, распространенным фактором риска развития церебральной микроангиопатии является АГ, поэтому необходим поиск четких дифференциально-диагностических критериев поражения мелких церебральных сосудов различной этиологии [16].
Рассчитываемый по результатам МРТ фронтоокципитальный градиент позволяет оценить различную выраженность Т2-гиперинтенсивностей белого вещества между лобной и затылочной долями. Результаты нашей работы указывают на статистически значимые различия в значениях ФОГ при ЦАА и гЦМА. Полученные показатели ФОГ ниже 1 свидетельствуют о преобладании поражения затылочных долей головного мозга, характерного для ЦАА, что соответствует данным литературы [5].
Церебральная амилоидная ангиопатия является труднодиагностируемым патологическим состоянием с геморрагическими и негеморрагическими маркерами поражения. Высокая специфичность пространственного паттерна Т2-гиперинтенсивностей белого вещества головного мозга при церебральной амилоидной ангиопатии определяет потенциал его использования в качестве биомаркера данной патологии. Фронто-окципитальный градиент является перспективным негеморрагическим маркером, обладающим высокой специфичностью и чувствительностью в диагностике церебральной амилоидной ангиопатии.
Максимально близко патогенез острого ишемического инсульта воспроизводят современные модели фокальных повреждений головного мозга, чаще обусловленных окклюзией просвета средней мозговой артерии (СМА) [2]. Окклюзия сосуда, как правило, достигается за счет использования синтетических нитей небольшого диаметра, сгустка крови или протромботического препарата [3]. Одной из таких экспериментальных моделей является метод фотохимического тромбоза. Данная модель позволяет наиболее приближенно к естественным условиям имитировать события, инициируемые окклюзией сосудов мозга при инсульте у человека [4].
В большинстве исследований с помощью фсгготромботической окклюзии микрососудов воспроизводят неокортикальный инсульт. Хотя этот метод вызывает тромботический инсульт, он не имеет прямой клинической аналогии, так как наблюдается окклюзия главным образом небольших сосудов коры (менее 40 мкм), а не крупной артерии или ее ответвлений. Тем не менее, это относительно простой, неинвазивный способ генерации локального инфаркта в любой заранее выбранной области неокортекса у крысы или мыши, поэтому он активно используется в экспериментах по моделированию, диагностике и терапии ишемического инсульта [6].
Молекулярные методы исследования. После ишемического инсульта повреждение клеток распространяется от очага инфаркта к окружающим тканям (область пенумбры). Для выявления белков, участвующих в механизмах альтерации нейронов и нейропротекции в пенумбре, исследуют изменения экспрессии белков с использованием микрочипов антител, наностринговых технологий и др. Например, с помощью микрочипов антител изучали изменения экспрессии более 200 нейрональных белков в пенумбре через 4 или 24 ч после очагового фототромботического инфаркта. Наибольшие изменения были выявлены через 4 ч после повреждающего воздействия и затрагивали белки путей передачи сигналов, белки, отвечающие за рост и направление аксонов; везикулярный транспорт; биосинтез нейромедиаторов; межклеточные взаимодействия; белки цитоскелета и другие. Известно, что эти белки участвуют как в процессах повреждения нейронов, так и в нейропротекции.
Моделирование фототромботического инсульта (ФТИ). Для индукции фототромбоза наркотизированным животным в кровеносную систему (внутривенно крысам или внутрибрюшинно мышам) вводят раствор светочувствительного красителя (чаще всего, это Бенгальский Розовый) [7]. Он почти не проникает в клетки и остается в сосудистой системе головного мозга. Голову животного фиксируют в стереотаксической установке, выполняют продольный разрез кожи и удаляют надкостницу. Для крыс может понадобиться трепанация черепа в нужном месте с помощью специального бура [8]. Затем на определенном расстоянии от черепа устанавливают лазер, проводят облучение светом с длиной волны 520–560 нм в течение 10–30 мин, после чего операционную рану ушивают. Фотосенсибилизатор под воздействием интенсивного светового облучения производит активные формы кислорода, которые повреждают мембраны эндотелиоцитов кровеносных сосудов, что приводит к адгезии и агрегации тромбоцитов и, в конечном итоге, образованию тромбов в области облучения (рис. 1).
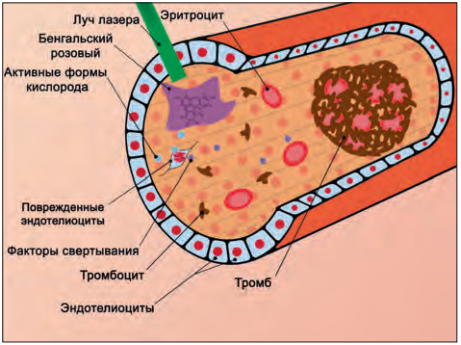
Рис. 1. Схематическое изображение механизма развития окклюзии кровеносного сосуда при фотоиндуцированном тромбозе
Локализация инсульта определяется местом облучения лазером, а его тяжесть — дозировкой фотосенсибилизатора и света [12].
Преимущества и ограничения модели фототромбоза. В основе патогенеза модели ФТИ лежит тромбообразование вследствие нарушения целостности эндотелия с быстро прогрессирующим ишемическим инфарктом и гибелью клеток в относительно небольшом объеме коры. В отличие от данной модели, в других моделях инсульта требуются более инвазивные методы хирургии, такие как окклюзия средней мозговой артерии (СМА). При этом повреждается одновременно кора и подкорковые области, а область ишемической полутени (пенумбры) хорошо выражена. ФТИ является устоявшейся моделью для изучения фокальных ишемических повреждений мозга [12]. Патологические процессы в головном мозге, моделируемые фотохимическим тромбозом, аналогичны процессам, происходящим при остром нарушении мозгового кровообращения по ишемическому типу (атерот-ромботический, кардиоэмболический инсульт). Данная модель характеризуется высокой воспроизводимостью, возможностью контроля объема инфаркта мозга и низкой летальностью. Так, показано, что объем инфаркта зависит от интенсивности лазерного излучения, а также — от продолжительности светового воздействия: увеличение времени экспозиции светового пучка с 15 до 20 мин приводит увеличению объема инфаркта, что, однако, не усугубляет функциональные нарушения [17]. Модель ФТИ позволяет изучать динамику изменений сенсомоторных путей без влияния подкорковых областей. Использование данной модели дает возможность получить статистически достоверные количественные данные о степени повреждения мозга и динамике патологических и репаративных процессов, оценивать нейропротекторное действие фармакологических препаратов [13].
Итак, достоинствами данной модели являются: минимальная инвазивность, хорошая воспроизводимость кортикального инсульта, как у крыс, так и у мышей, низкая летальность среди животных, возможность выбора области воздействия, точность локализации местоположения ишемии, возможность контроля размеров и глубины ишемического повреждения [15].
К ограничениям модели можно отнести ее перманентный окклюзионный характер, что не позволяет использовать данную модель для изучения механизмов ишемически-реперфузионного повреждения клеток, а также реперфузионной терапии [10]. Другая проблема заключается в том, что фототромбоз вызывает в равной степени как сосудистые, так и цитотоксические отеки, тогда как ишемический инсульт у человека вызывает преимущественно цитотоксические отеки, которые не сразу приводят к нарушению гематоэнцефалического барьера, что является существенным ограничением, затрудняющим экстраполяцию полученных с помощью этой модели данных [5]. Из-за быстрого и интенсивного развития отека тканей и некроза получается относительно небольшая зона пенумбры. Это является одним из ограничений фототромботической модели, которое нужно учитывать при оценке эффективности реперфузии [2]. Ишемическая полутень, или пенумбра, была впервые определена Аструпом и его коллегами на основе электрофизиологических наблюдений как область, в которой снижение мозгового кровотока превышает порог недостаточности электрической функции, но не порог мембранной недостаточности. Пенумбра представляет собой пространственно-динамическую область мозга с ограниченной жизнеспособностью, которая характеризуется сложными патофизиологическими изменениями, затрагивающими функции нейронов. Сегодня пенумбра в более широком смысле определяется как область ишемизированной ткани, которая функционально повреждена и подвержена риску инфаркта, но потенциально может быть сохранена.
Также одним из недостатков модели фототромбоза является то, что, как правило, у экспериментальных животных отсутствует неврологический дефицит, или его очень сложно диагностировать.
Для решения этих и других проблем разрабатываются модификации модели ФТИ и новые современные методы диагностики повреждений. В ранних версиях модели фототромбоз вызывал тяжелый инсульт с быстро развивающейся зоной ишемии и отсутствием зоны пенумбры, но более поздние модификации модели с использованием других параметров лазера позволили получить более широкую зону пенумбры [11]. Например, менее интенсивное, но продолжительное фотодинамическое действие на кору головного мозга крыс (диодный лазер; 532 нм, 60 мВт/см2, 30 мин) приводило к возникновению пенумбры шириной 1,5–2 мм вокруг ядра инфаркта диаметром 3 мм, что было подтверждено данными гистологического и ультраструктурного исследований [11]. В работе U. I. Tuor и соавт. (2016) 5-минутное облучение коры головного мозга крысы светом с длиной волны 555 нм и интенсивностью около 40 мВт/см2 после введения 10 мг/ кг Бенгальского Розового индуцировало небольшой инфаркт с умеренной и диффузной пенумброй [10]. Т. A. Clark с соавт. (2019) предложили модификацию модели фототромбоза у мышей с использования цифрового микро-зеркального прибора. Осуществлялась окклюзия нескольких ветвей СМА на поверхности моторной коры, при этом ограничивался коллатеральный мозговой кровоток и перекрывались ветви передней мозговой артерии. Данная методика позволила расширить зону пенумбры и отсрочить спонтанную реперфузию целевых артерий подобно тому, как это происходит у людей. В этом заключалось ее отличие от традиционной фототромботической модели, которая чаще всего приводит к постоянной окклюзии артерий и относительно ограниченному коллатеральному кровотоку. В связи с этим, предложенная модификация может служить потенциальной моделью ишемии-репер-фузии головного мозга.
Полагают, что устойчивость модели ФТИ к фибринолитической терапии связана с тем, что в результате фотохимической реакции в сосудах формируется богатый тромбоцитами, но бедный фибрином сгусток. Недавно было предложена модель фототромбоза у мышей, в которой для фотоактивации тромбоза в проксимальной ветви СМА была использована комбинация красителя Бенгальского Розового (50 мг/кг) и субтромботической дозы тромбина (80 ЕД/кг), что приводило к образованию обогащенных фибрином и чувствительных к tPA свертков крови. При этом, размеры и локализация инфаркта были постоянными, а внутривенное введение tPA (Альтеплаза, 10 мг/кг) в течение 2 ч после фотоактивации достоверно уменьшало размер инфаркта. Таким образом, модель ФТИ с усиленным тромбином может быть полезна для тестирования тромболитических методов лечения.
Недавно была предложена техника оптического просветления черепа у мышей без краниотомии, в ходе которой создается «оптическое окно», через которое может проникать световой луч. На основе этой техники была создана контролируемая модель ишемического инсульта путем комбинации метода оптической очистки черепа in vivo и процедуры фототромбоза. Данная модель представляет значительную ценность для исследований ишемического инсульта [12].
Таким образом, сегодня, ряд преимуществ модели фототромботического инсульта (малая инвазивность, высокая воспроизводимость, возможность контроля объема инфаркта мозга и низкая летальность) обусловливают ее активное использование в экспериментальных исследованиях ишемического инсульта. Патологические процессы в головном мозге, моделируемые фотохимическим тромбозом, аналогичны процессам, происходящим при остром нарушении мозгового кровообращения по ишемическому типу (атеротромботический, кар-диоэмболический инсульт). Следовательно, данная модель позволяет изучать клеточные и молекулярные механизмы ишемического повреждения головного мозга и может быть полезна для поиска возможностей терапии инсульта.
Литература:
- Андропова П. Л., Гаврилов П. В., Казанцева И. П., Домиенко О. М., Наркевич А. Н., Колесникова П. А. и др. Оценка межэкспертной согласованности врачей-рентгенологов в диагностике ишемического инсульта в бассейне средней мозговой артерии с помощью компьютерной томографии. Медицинская визуализация. 2023;27.
- Драпкина О. М., Концевая А. В., Калинина А. М., Авдеев С. Н., Агальцов М. В.; Александрова Л. М., и др Профилактика хронических неинфекционных заболеваний в Российской Федерации. Национальное руководство 2022. Кардиоваскулярная терапия и профилактика. 2022;21(4):3235. https://doi.org/10.15829/1728–8800–2022–3235.
- Кузьменко Н. В., Плисс М. Г., Цырлин В. А., Галагудза М. М. Метаанализ влияния пола и возраста на сезонную динамику риска инсультов головного мозга. Анализ риска здоровью. 2023;(1):124–136 DOI: 10.21668/health.risk/2023.1.12
- Морозов С. П., Владзимирский А. В., Кпяшторный В. Г., Андрейченко А. Е., Кульберг Н. С., Гомболевский В. А. и др. (сост.) Клинические испытания программного обеспечения на основе интеллектуальных технологий (лучевая диагностика). Серия «Лучшие практики лучевой и инструментальной диагностики». М.; 2019:34.
- Гаврилов П. В., Ушков А. Д., Смольникова У. А. Выявление округлых образований в легких при цифровой рентгенографии: роль опыта работы врача-рентгенолога. Медицинский альянс. 2019;(2):51–56.
- Куракина А. С., Семенова Т. Н., Гузанова Е. В., Нестерова В. Н., Щелчкова Н. А., Мухина И. В., и др. Прогностическое значение исследования нейронспецифической енолазы у пациентов с ишемическим инсультом. Современные технологии в медицине. 2021;13(2):68–73. DOI: 10.17691/ stm2021.13.2.08.
- Мелдо А. А. Разработка и внедрение системы искусственного интеллекта в лучевой диагностике очаговых образований в легких: дис.... д-ра мед. наук; 3.1.25. Санкт-Петербург; 2022:235.
- Толпыгина С. Н.; Загребельный А. В., Чернышева М. И., Воронина В. П.; Кутишенко Н. П., Дмитриева Н. А.; и др. Отдаленная выживаемость больных, перенесших острое нарушение мозгового кровообращения, в различных возрастных группах в регистре РЕГИОН М. Российский кардиологический журнал. 2023;28(2):5250. DOI:10.15829/1560–4071–2023–5250.
- Кулеш А. А. Нейропротективная терапия в остром периоде ишемического инсульта. Неврология, нейропсихиатрия, психосоматика. 2021;13(4):94–102. DOI: 10.14412/2074–2711–2021–4-94–102
- Сехвейл С. М. М., Гончарова З. А. Массивный ишемический инсульт (краткий обзор литературы). Вестник новых медицинских технологий, электронный журнал. 2019;(1):48–52. eLIBRARY ID: 37024686.
- Чехонацкий В. А., Чехонацкий И. А. Магнитно-резонансная томография с основными и дополнительными программами в диагностике ишемического инсульта в острой фазе. Бюллетень медицинских интернет-конференций. 2017;7 (б):1040. eLIBRARY ID: 29981350
- Силкин В. В.; Ершов В. И., Бурдаков В. В., Бирюкова Т. В., Бредихин А. Ю., Лозинская Т. Ю. Математическое моделирование тяжелого ишемического инсульта с полиор-ганной недостаточность: ретроспективное наблюдательное исследование. Вестник Интенсивной терапии им. А. И. Салтанова. 2023;1:91–99. DOI: 10.21320/1818–474Х-2023–1-91–100.
- Цыган Н. В., Андреев Р. В., Пелешок А. С., Коломейцев С. В., Яковлева В. А., Рябцев А. В., Гуменная М. А., Литвиненко И. В. Периоперационный мозговой инсульт в хирургии клапанов сердца: патогенез, клиника, диагностика, лечение и профилактика // Журнал неврологии и психиатрии им. С. С. Корсакова. 2018. № 118(4). С. 52–60.
- Калашникова Л. А., Гулевская Т. С., Добрынина Л. А. Актуальные проблемы патологии головного мозга при церебральной микроангиопатии. Журнал неврологии и психиатрии им. С. С. Корсакова 2018; 118(2): 90–99, https://doi.org/10.17116/jnevro20181182190–99.
- Гнедовская Е. В., Добрынина Л. А., Кротенкова М. В., Сергеева А. Н. МРТ в оценке прогрессирования церебральной микроангиопатии. Анналы клинической и экспериментальной неврологии 2018; 12(1): 61–68, https://doi.Org/10.25692/ACEN.2018.1.9.
- Phuah C. L., Chen Y., Strain J. F., Yechoor N., Laurido-Soto O. J., Ances B. M., Lee J. M.; for the Alzheimer's Disease Neuroimaging Initiative. Association of data-driven white matter hyperintensity spatial signatures with distinct cerebral small vessel disease. Neurology 2022; 99: e2535-e2547, https://doi.org/10.1212/ WNI.0000000000201186.
- Zhang S. C., Jia J. J., Zhao H. L., Zhou B., Wang W., Lu X. H., Wang H., Wang Z. R, Wu W. P. Early MRI imaging and follow-up study in cerebral amyloid angiopathy. Open Med (Wars) 2021; 16(1): 257–263, https://doi.org/10.1515/med-2021–0212.







