The article is devoted to the study of the regeneration characteristics of the cornea nerve fibers in the treatment of purulent keratitis with platelet- and leukocyte-rich autoplasma with the imposition of a bandage lens using the immunohistochemical method. The study results show that such treatment of purulent keratitis begins to act earlier compared to treatment with antibiotics and is more effective, as evidenced by a higher expression level of the marker of cells proliferative activity of Ki-67. Also, the expression peak of the S100 marker, which is used to identify satellite and Schwann cells of peripheral nerves, appeared earlier (on the 7th day) with such treatment compared to treatment with antibiotics and then sharply declined, providing the possibility of the complete regeneration of corneal tissues, while maintaining its transparency. This allows us to speak about the interaction synergism of all cellular elements («epithelial» and «non-epithelial») during the regenerative process in the cornea by the treatment of purulent keratitis using autoplasma rich in platelets and leukocytes with the imposition of a bandage lens.
Keywords: treatment of platelet- and leukocyte-rich autoplasma with the imposition of a bandage lens, purulent keratitis, immunohistochemistry, satellite and Schwann cells, S100 marker.
Актуальность. Известные на сегодняшний день статистические данные свидетельствуют о том, что заболевания и повреждения роговицы занимают одно из ведущих мест среди причин, приводящих больных к слабовидению или даже к слепоте [7]. В научной литературе имеется много данных как экспериментальных, так и клинических исследований, касающихся морфологических аспектов регенерации роговицы [3, 6]. В последнее время это приобрело особое значение в связи с совершенствованием методов лечения на основе современных технологий [2]. Однако, несмотря на все многообразие представленных работ по вопросам регенерации роговицы, основное внимание в них уделяется все же проблемам регенерации эпителиального пласта. При этом, так называемому, стромальному компоненту (в первую очередь, состоянию нервов и сосудов), уделяется намного меньше внимания или же данные не носят системный и комплексный характер [5]. В то время как известно, что в случае недостаточной иннервации и васкуляризации, невозможна достаточная регенерация, а именно репаративная регенерация по типу реституции [8]. Особого внимания в этом случае заслуживает тот факт, что репаративная регенерация по типу реституции в роговице должна в обязательном порядке предусматривать не только восстановление ее анатомической целостности, но и проходить не в ущерб восстановления ее функциональных свойств и, в первую очередь, прозрачности.
Цель работы. Изучить особенности регенерации нервных волокон роговицы при лечении гнойных кератитов богатой тромбоцитами и лейкоцитами аутоплазмой с наложением бандажной линзы.
Материалы и методы исследования. Экспериментальное исследование было выполнено на беспородных поросятах в возрасте 2 месяцев с массой тела 14,0–15,0 кг на базе Международного учебно-научного центра Министерства Здравоохранения и медицинской промышленности Туркменистана. У всех поросят вызывались экспериментальные кератиты обоих глаз путем введения стафилококковой культуры. Использование животных в эксперименте проводилось в соответствии с правилами, регламентированными рекомендациями Европейской конвенции о защите позвоночных животных, используемых для экспериментов в научных или иных целях. I группу (сравнительную) исследования составили животные, у которых гнойный кератит лечился антибиотиками. II группу (основную) — животные, у которых его лечение проводилось с помощью применения богатой тромбоцитами и лейкоцитами аутоплазмы с наложением бандажной линзы. Взятие биоптатов тканей роговицы с подлежащей стромой размером 1,0х1,0х0,5 см осуществлялось во время операций под общим наркозом. При этом приоритетной для взятия биоптата являлась зона близкая к лимбу, так как именно там регенерация носила самый интенсивный характер. Постановка патогистологического диагноза проводилась на основе изучения препаратов, окрашенных стандартным методом с использованием гематоксилина и эозина.
После стандартного патоморфологического исследования была проведена иммуногистохимическая (ИГХ) окраска с антителами против Ki-67 (Clone MIB-1) и S100. Ki-67 является признанным маркером определения пролиферативной активности клеток, а S100, помимо своего основного применения для идентификации образующих меланин клеток, известен также как маркер сателлитных и шванновских клеток периферических нервов (Dako, Catalog, 2016). ИГХ-анализ проводили на парафиновых срезах толщиной 4 мкм. Парафиновые срезы депарафинировали и регидратировали по стандартной методике. Для визуализации иммуногистохимической реакции использовали DAB+ систему (Dako, Hamburg, Germany). Оценку результатов окрашивания проводили с применением светового микроскопа «Olympus BX43» (Япония), используя объективы х10; х20; х40. В качестве положительной окраски принималась окраска ядер при Ki-67, а также цитоплазмы и ядер при S100 со стороны сателлитных и шванновских клеток периферических нервов. Результаты иммуногистохимической окраски оценивались посредством полуколичественного (семиквантитативного) иммунореактивного Score-метода [11]. При этом ИГХ-окраска для каждого антитела выполнялась в 48 полях зрения. Статистическая обработка проводилась с помощью стандартного пакета программ Excell 2016 года. Для сравнения между двумя группами использовался тест Стьюдента, а для оценки показателей для разных временных промежутков исследования (3, 7, 14 и 28 дни) — ANOVA-тест. За статистически достоверный результат принимался показатель р<0,05 и ниже.
Результаты исследования и их обсуждение. С целью определения пролиферативной активности сателлитных и шванновских клеток на первом этапе иммуногистохимического исследования проводилась окраска на Ki-67. Ее результаты представлены в таблице 1.
Таблица 1
Изменения показателей пролиферативной активности сателлитных и шванновских клеток периферических нервов в группах в зависимости от сроков наблюдения
|
№ |
Показатель |
3 день |
7 день |
14 день |
28 день |
ANOVA- тест |
|
1 |
Пролиферативная активность сателлитных и шванновских клеток периферических нервов I группы (Score-показатель Ki-67 в условных единицах) |
3,79±0,93°Δ |
5,48±1,02 |
5,89±1,1 |
3,14±0,48°Δ |
p<0,05 |
|
2 |
Пролиферативная активность сателлитных и шванновских клеток периферических нервов II группы (Score-показатель Ki-67 в условных единицах) |
7,72±1,3 |
7,38±1,17 |
3,27±0,52*# |
1,03±0,29*#§ |
p<0,05 |
|
t-тест Стьюдента (между группами) |
p<0,05I-II |
n.s. |
p<0,05II-I |
p<0,01II-I |
Примечания: к I группе ° — по сравнению с 7-м днем, Δ — по сравнению с 14 днем; ко II группе * — по сравнению с 3-м днем, # — по сравнению с 7-м днем, § — по сравнению с 14-м днем.
По приведенным в таблице результатам можно сказать следующее. Пролиферативная активность сателлитных и шванновских клеток периферических нервов II группы уже на третий день была максимальной, постепенно снижаясь к седьмому дню и образуя своеобразное плато. После 7-го дня пролиферативная активность этих клеток резко пошла на убыль, о чем говорит достоверная разница показателей на 14-й и 28-й день по сравнению с 3-м и 7-м днями. В Iгруппе пролиферативная активность этих клеток существенно увеличилась только к 7-му дню, образовав выше названное плато между 7-м и 14-м днем. Это говорит о запаздывании пролиферативного процесса в этих клетках в Iгруппе по сравнению со II. Результат в I группе на 28-й день также идет на снижение, как и во II группе, но, как видно, с запозданием на две недели.
Данные результаты показывают, что лечение гнойных язв роговицы в эксперименте с помощью богатой тромбоцитами и лейкоцитами аутоплазмы с наложением бандажной линзы начинает действовать раньше по сравнению с лечением обычными офтальмологическими средствами и оказывается при этом более эффективным, о чем говорят более высокие показатели экспрессиимаркера Ki-67 (самый высокий во II группе — 7,72, в I — 5,89).
Второй этап ИГХ-исследования предусматривал окраску с маркером S100, который помимо своего основного предназначения по идентификации меланомных клеток, нашел также широкое применение для визуализации сателлитных и шванновских клеток периферических нервов [4]. Результаты второго этапа ИГХ-исследования иллюстрирует таблица 2.
Таблица 2
Изменения показателей экспрессии маркёра S100 сателлитными и шванновскими клетками периферических нервов в группах в зависимости от сроков наблюдения
|
№ |
Показатель |
3 день |
7 день |
14 день |
28 день |
ANOVA- тест |
|
1 |
Уровень экспрессии S100 сателлитными и шванновскими клетками периферических нервов роговицы с суммарным ядерным и цитоплазма-тическим окрашиванием. I группа, усл. ед. |
2,41±0,48 |
3,92±0,66°γ |
6,74±0,79°Δ |
10,86±1,72°Δγ |
p<0,05 |
|
2 |
Уровень экспрессии S100 сателлитными и шванновскими клетками периферических нервов роговицы с суммарным ядерным и цитоплазматическим окрашиванием. II группа, усл. ед. |
8,52±1,51 |
11,37±2,47*§ |
8,19±1,3 |
4,09±0,74*#§ |
p<0,05 |
|
t-тест Стьюдента (между группами) |
p<0,01I-II |
p<0,01I-II |
p<0,05II-I |
p<0,01II-I |
Примечания: к I группе ° — по сравнению с 3-м днем, Δ — по сравнению с 7 днем, γ — по сравнению с 14-м днем; ко II группе * — по сравнению с 3-м днем, # — по сравнению с 7-м днем, § — по сравнению с 14-м днем.
Из таблицы видно, что в отличие от пролиферативной активности (маркёр Ki-67) пик экспрессии маркёра S100 во II группе пришелся не на 3-й, а на 7-й день. Это можно объяснить не очень благоприятными условиями для регенерации нервных волокон в условиях, когда признаки некротической фазы воспаления (до 3-го дня) еще присутствуют в очаге поражения. Достигнув максимального результата на 7-й день, уровень экспрессии маркёра S100 резко пошел на убыль. В I группе и уровень экспрессии данного маркёра был ниже (самый высокий в I группе — 10,86, во II — 11,37), и отмечалось запаздывание экспрессионной окраски по сравнению с показателями во II группе (рис. 1 и 2). Результаты в таблице 2 также демонстрируют преимущества лечения гнойных кератитов с помощью богатой тромбоцитами и лейкоцитами аутоплазмы с наложением бандажной линзы. Кроме того, учитывая результаты обеих таблиц, можно сказать о необходимости коррекции тактики лечения в случае применения в качестве основных средств антибиотиков. В противном случае существует риск снижения прозрачности роговицы за счет излишнего содержания в ее тканях (особенно в строме) соединительно-тканных волокон и нервно-сосудистых сплетений.
|
|
|
|
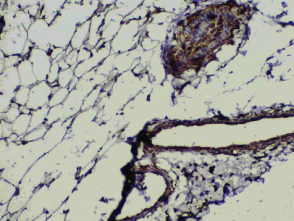
Рис. 1. I группа, 28-й день. Справа вверху нервное волокно с положительно окрашенными сателлитными и шванновскими клетками. Видно, что многие элементы не окрашены, расположение клеток в волокне хаотичное. Окраска на S100, х120. |
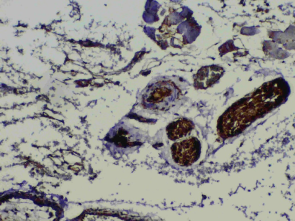
Рис. 2. II группа, 7-й день. Справа возле центра 3 нервных волокна с положительно окрашенными сателлитными и шванновскими клетками. Окраска на S100, х120. |
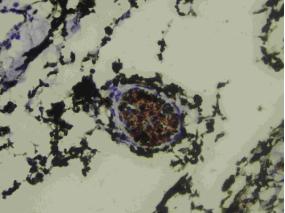
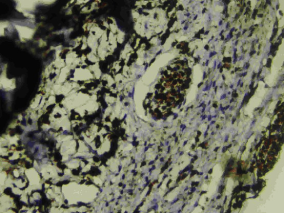
Другими словами, есть риск протекания регенераторного процесса по типу субституции (неполное восстановление структур с потерей прозрачности роговицы, рис. 3) вопреки желаемой реституции (полное восстановление структур с сохранением прозрачности роговицы, рис. 4).
|
|
|
|
Рис. 3. I группа, 28-й день. Нервное волокно с окружающей его миелиновой оболочкой (субституция с возможной потерей прозрачности роговицы). Вокруг данной структуры отек и макрофагальная инфильтрация. Окраска на S100, х260. |
Рис. 4. II группа, 7-й день. Нервное волокно без миелиновой оболочки (реституция без потери прозрачности роговицы). Вокруг данной структуры отек и макрофагальная инфильтрация. Окраска на S100, х260. |
Выше было сказано, что биоптаты были взяты из зоны лимба,так как именно там регенерация носила самый интенсивный характер и присутствовали все эпителиальные компоненты роговицы. Это было сделано сознательно исходя из двух факторов. Во-первых, невозможно говорить о каком-либо влиянии нейротрофического фактора (в данном случае «представителя» стромального или неэпителиального компонента) на результат регенерации роговицы в виде эпителиального компонента. Другими словами, только имея результат в виде регенерировавшего эпителиального пласта, можно оценивать тот или иной способ лечения. Во-вторых, и это является наиболее важным в осознании механизмов регенерации роговицы с целью восстановления ее полной прозрачности, известно, что в передней части стромы роговицы ветви длинных ресничных нервов, теряя миелиновую оболочку, организуются в нервные пучки, окруженные шванновскими клетками, и образуют субэпителиальное нервное сплетение [1]. Отсутствие миелиновой оболочки нервных волокон роговицы (НВР) является одним из условий поддержания ее прозрачности (для сравнения, рис. 3 и 4). НВР имеют преимущественно параллельную ориентацию соответственно строению коллагеновых фибрилл стромы роговицы. Проникая через мембрану Боумена, аксоны лишаются шванновских клеток и за счет вертикального и горизонтального ветвления образуют суббазальное, а затем и интраэпителиальное нервные сплетения. В области поверхностных эпителиальных слоев НВР заканчиваются свободными нервными окончаниями [9, 10]. Выше сказанное объясняет, что в случае взятия биоптата из центральных частей роговицы (вдали от лимба), оценить нейротрофическую функцию за счет ИГХ-исследования сателлитных и шванновских клеток периферических нервов роговицы, не представлялось бы возможным.
Выводы. Результаты экспериментальной работы показывают, что лечение гнойных кератитов богатой тромбоцитами и лейкоцитами аутоплазмой с наложением бандажной линзы по сравнению с лечением антибиотиками оказалось более эффективным как по времени наступления регенерации, так и по ее качественным характеристикам. В частности, были получены доказательства своевременного восстановления нейротрофической функции в ходе регенераторного процесса. Последнее позволяет говорить о синергизме взаимодействия всех клеточных элементов («эпителиальных» и «неэпителиальных») и дифференцировке регенераторного процесса по типу реституции в роговице при лечении данным способом. По результатам эксперимента можно также говорить о необходимости коррекции тактики лечения в случае применения в качестве основных средств антибиотиков.
Литература:
- Аветисов C. Э., Черненкова Н. А., Сурнина З. В. Анатомо-функциональные особенности и методы исследования нервных волокон роговицы // Вестник офтальмологии. — 2018. — № 6. — С. 102–106.
- Беляковский, П. В., Лобанок Е. С. Перспективы применения стволовых клеток в офтальмологии // Офтальмология в Беларуси. — 2009. — № 2. — С. 81–91.
- Бикбов, М.М., Бикбова Г. М., Хабибуллин А. Ф. «Кросслинкинг» роговичного коллагена в лечение кератоконуса // Вестник офтальмологии. — 2011. — № 5. — С. 21–25.
- Иммуногистохимические методы: Руководство // Ed. by George L. Kumar, Lars Rudbeck.: DAKO / Пер. с англ. под ред. Г. А. Франка и П. Г. Малькова. — М., 2011. — 224 с.
- Кадыров Р. З., Галиахметов Р. Ф., Нураева А. Б. Стимуляция репаративной регенерации роговицы перилимбальным введением биоматериала // Морфологические ведомости. — Москва. — 2009. — № 3. — С. 256–258.
- Канюков В. Н., Стадников А. А., Трубина О. М., Яхина О. М. Экспериментальное моделирование травматических повреждений роговицы // Вестник Оренбургского государственного университета. — 2014. — № 16(173). — С. 156–159.
- Разумовский М. И. Теоретические и практические основы социальной реабилитации слепых и слабовидящих // Медико-социальная экспертиза и реабилитация. — 2010. — № 3. — С. 3–6.
- Blum H-E., Müller-Wieland D. Klinische Pathophysiologie. // 10. Auflage. Georg Thieme Verlag. — Stutgart, 2018. — 1288 S.
- Muller LJ, Pels E, Vrensen GF. The specific architecture of the anterior stroma accounts for maintenance of corneal curvature // Br J Ophthalmol. 2001;85(4):437–443.
- Oliveira-Soto L, Efron N. Morphology of corneal nerves using confocal microscopy // Cornea. 2001;20(4):374–384.
- Remmele W., Stegner H. E. Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue // Pathologe. — 1987. — V.8. — P.138–140.