Проведено экспериментальное исследование динамики роста культуры микроводоросли рода Porphyridium, а именно Porphyridium purpureum (Bory) Ross. Построены графики зависимости изменения оптической плотности культуры в зависимости от времени выращивания (возраста культуры). Осуществлен выбор интенсивности света, при которой происходит наилучший рост микроводоросли.
Ключевые слова: микроводоросль, Porphyridium purpureum, рост биомассы, интенсивность освещения.
Объектом исследования в опыте является культура красной водоросли Porphyridium cruentum из коллекции культур ИБЮМ имени О. А. Ковалевского РАН. Среди небольшого количества одноклеточных красных водорослей, введённых в культуру, микроводоросли рода Porphyridium, в частности, Porphyridium purpureum (Bory) Ross. (синоним Porphyridium cruentum Näg.), представляют значительный интерес [1]. Практический аспект использования красной микроводросли связан, главным образом, с тем, что она может служить источником ряда ценных химических, физиологически активных ипитательных веществ: пигментов, витаминов, агароподобных полисахаридов, применяемых в медицине и пищевой промышленности [2 − 5].
Постановка задач эксперимента:
– проследить динамику роста культуры Porphyridium cruentum при трех видах освещенности 5, 10 и 15 клк;
– построить графики изменения плотности культуры микроводорослей в зависимости от времени выращивания.
Существует два основных способа культивирования клеток: накопительная (периодическая) и непрерывная культура. В случае накопительного способа выращивания в освещаемый культиватор, заполненный питательной средой, содержащей необходимые для роста биогенные элементы, вносится небольшое количество клеток микроводорослей (инокулят). Рост микроводорослей приводит со временем к увеличению концентрации клеток до некоторой максимальной плотности культуры. Эта плотность ограничена либо элементами минерального питания, либо интенсивностью света, либо накоплением метаболитов, либо другими физико-химическими условиями среды.
Материалы иметоды
Культиватор
Для выращивания культуры использовался плоскопараллельный культиватор, имеющий форму параллелепипеда со скошенным дном. Геометрические параметры: высота 55 см, длина 26 см, длина скоса 9 см, рабочий слой суспензии 2 см, рабочий объем 1,2 л.
Приборы
– концентрационный фотоэлектроколориметр КФК-2, абсолютная погрешность составляет 1,0 % при измерении коэффициента пропускания (Т), размах показаний, определяющий случайную погрешность меньше 3,0 %. Стеклянные кюветы высотой шириной 0,5 см.;
– ртутный термометр, шкала от 0 до 100°С, абсолютная погрешность составляет ±0,5°С;
– люксометр Ю-116, относительная погрешность до 5 % измеренной величины;
– pH-метр Mettler-Toledo SevenCompact, относительная погрешность pH: ±0,002;
– стеклянная пипетка, объем 10 мл, погрешность ±0,05 мл;
– 3 пластиковые пробирки.
Фотоколориметрический метод измерения коэффициента пропускания
Измерения проводят на приборе КФК-2 (длина волны 750 нм), используя стеклянные кюветы 0,5 см, входящие в комплект поставки прибора. В кювету сравнения заливают дистиллированную воду. Непосредственно перед измерением исследуемого образца его тщательно перемешивают встряхиванием, после чего заливают в измерительную кювету. Важно добиться того, чтобы время между измерением и перемешиванием было минимальным — это позволит уменьшить ошибки измерений, связанные с оседанием культуры на дно кюветы.
Поскольку оптическая плотность и пропускание связаны соотношением ![]() , для вычисления конечного результата используют следующее выражение:
, для вычисления конечного результата используют следующее выражение:
|
|
(1) |
где ![]() — оптическая плотность;
— оптическая плотность;
![]() — доля пропускания суспензии при 750 нм;
— доля пропускания суспензии при 750 нм;
k — коэффициент разбавления при подготовке пробы (в данном опыте k = 1).
Порядок проведения эксперимента
После промывания трех плоскопараллельных культиваторов раствором щелочи и дистиллятом, они были наполнены 900 мл питательной среды «Тренкешу», содержащей следующие компоненты: NaNo3; Na2HPO4; Na2EDTA; FeC6H5O7˟3H2O; MnCl2˟4H2O; Co(NO3)2˟6H2O; (NH4)6Mo7O24˟4H2O; K2Cr2(SO4)2˟24H2O; TiO2 (для приготовления среды используется морская воды). Далее по несколько миллилитров высококонцентрированной суспензии клеток были помещены в экспериментальные культиваторы, поставленные в соответствии с требуемой степенью освещенности (рис.1). Барботаж жидкости в культиваторе осуществлялся газо-воздушной смесью с 3–5 % углекислого газа.

Рис.1 Установленные культиваторы с микроводорослью Porphyridium cruentum
Отбор проб проводился в течение 8 дней с в период с 10:00 до 14:00 ч. Объем жидкости в культиваторе восстанавливался дистиллятом до исходной отметки в 900 мл, после чего, с помощью пипетки отбиралось по 10 мл раствора в пробирки.
Порядок действий при отборе проб был следующий:
– измерение температуры в трех культиваторах ртутным термометром;
– доведение дистиллятом уровня суспензии до отметки 900 мл;
– перемешивание;
– отбор 10 мл пробы в каждом из трех культиваторов;
– измерение коэффициента пропускания на длине волны 750 нм с помощью КФК-2, расчёт оптической плотности биомассы в среде;
– измерение pH каждого образца.
Результаты проведения эксперимента сведены в таблицу 1.
Таблица 1
Экспериментальные данные
|
Номер культиватора |
Параметр |
Дата и время | |||||||
|
23.07 14:00 |
24.07 10:00 |
25.07 10:00 |
26.07 10:00 |
27.07 14:00 |
28.07 10:00 |
29.07 12:00 |
30.07 11:00 | ||
|
1 (15 клк) |
t, ℃ |
23,4 |
25,9 |
29,6 |
28,6 |
28,5 |
30,0 |
28,0 |
30,0 |
|
pH |
8,30 |
9,10 |
9,30 |
9,30 |
9,10 |
9,10 |
9,10 |
9,00 | |
|
D750 |
0,28 |
0,44 |
0,52 |
0,55 |
0,60 |
0,64 |
0,71 |
0,71 | |
|
2 (10 клк) |
t, ℃ |
23,4 |
24,1 |
27,3 |
26,0 |
28,5 |
28,0 |
26,0 |
28,0 |
|
pH |
8,30 |
9,20 |
9,20 |
9,30 |
9,21 |
9,25 |
9,25 |
9,20 | |
|
D750 |
0,28 |
0,48 |
0,54 |
0,55 |
0,63 |
0,78 |
0,82 |
0,93 | |
|
3 (5 клк) |
t, ℃ |
23,4 |
22,3 |
25,4 |
24,5 |
24,5 |
25,0 |
23,0 |
25,0 |
|
pH |
8,30 |
9,10 |
9,20 |
9,20 |
9,14 |
9,10 |
9,10 |
9,05 | |
|
D750 |
0,28 |
0,32 |
0,48 |
0,52 |
0,56 |
0,59 |
0,63 |
0,61 | |
|
Возраст культуры |
τ, сутки |
0,00 |
0,83 |
1,83 |
2,83 |
4,00 |
5,83 |
6,92 |
7,88 |
Графически рост культуры изображается S-образной кривой, форма которой зависит от условий, в которых выращиваются клетки, и кинетических характеристик культуры микроводорослей. Полученные для трех культиваторов графики изменения оптической плотности водорослей Porphyridium cruentum в зависимости от времени выращивания представлены на рисунке 2.
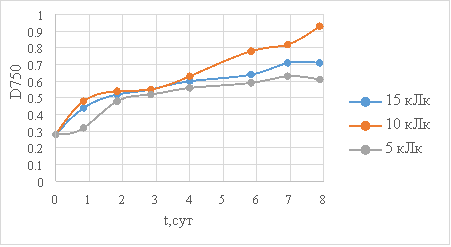
Рис.2. Динамика накопления биомассы
Проанализировав графики, можно сделать вывод, что интенсивность света 10 клк соответствует наилучшим условиям накопления биомассы культуры красной микроводоросли Porphyridium cruentum.
Литература:
- Гудвилович И. Н. Влияние условий культивирования на рост и содержание фикобилипротеинов красной микроводоросли PORPHYRIDIUM PURPUREUM (обзор) // ЭКОЛОГИЯ МОРЯ. — 2010. — № 81. — С. 28–36.
- Ahern T. J., Katoh S., Sada E. Arachidonic acid production by the red alga Porphyridium cruentum// Biotechnology and Bioengineering. — 1983. — 25. — P. 1057–1070.
- Antia N. J., Desai I. D., Romilly M. J. The tocopherol, vitamin K, and related isoprenoid quinone composition of an unicellular red alga (Porphyridium cruentum) // J. Phycology. — 1970. — 6. — P. 301–312.
- Arad S., Adda M., Cohen E. The potential production of sulphated polysaccharides from Porphyri-dium // Plant and Soil. — 1985. — 89. — P. 117–127.
- Fuentes M. R., Fernandez G. A., Perez J. S. et al. Biomass nutrient profiles of the microalga Porphy-ridium cruentum // Food Chem. — 2000. — 70, No 3. — P. 345–353.

