В статьи освещены результаты по содержания углеводов в растениях, растущих в зоне Таджикского алюминиевого завода связано с ингибированием активности ряда ферментов, принимающих участие в углеводном обмене.
Ключевые слова: активность фосфорилазы, инвертаза, фосфоглюкомутаза, сахарозофосфатсинтаза, уровень загрязнения.
Установление связи активности ферментов растительных организмов с экологическими факторами является важной предпосылкой для выявления механизмов повреждающего действия ксенобиотиков и специфики ответных реакций растений. По показателям ферментативной активности можно в определенной мере, давать оценку степени устойчивости того или иного растения, в условиях техногенного загрязнения. Результативность такого подхода была показана при оценке активности ферментов как показателе состояния почвы в неблагоприятных условиях среды. [Шебалова Н. М., 2009].
Как известно в процессе фотосинтеза образуется в первую очередь моносахарид фруктозо-6-фосфат, который затем превращается в глюкозо-6-фосфат и глюкозо-1-фосфат. Все эти реакции происходят при участии ферментов триозофосфатизомеразы, фруктозобисфосфатазы, фосфогексоизомеразы, фосфорилазы и фосфоглюкомутазы. Затем из фруктозо-6-фосфата и глюкозо-1-фосфата синтезируется сахароза. Синтез сахарозы в растениях регулируется рядом ферментов: сахарозо-фосфатсинтазой, сахарозофосфатазой сахарозо-синтетазой, а гидролиз при участии инвертазы до глюкозы и фруктозы [Ленинджер, 1974, Даффус К., Даффус Дж., 1987].
Методика исследование. Фосфоглюкомутаза катализирует обратимое превращение глюкозо-1-фосфата в глюкозо-6-фосфат. Равновесие реакции сильно сдвинуто в сторону образования глюкозо-6-фосфата и устанавливается, когда около 95 % фосфогексоз находится в форме глюкозо-6-фосфата. Фермент относительно стабилен и не активируется при нагревании до 65С. Определение активности фосфоглюкомутазы проводили как описано в Практикуме по биохимии Северина С. Е. и Соловьевой Г. А., [1989].
Сахарозофосфатсинтаза катализирует реакцию образования сахарозофосфата из уридиндифосфатглюкозы (УДФГ) и фруктозы-6-фосфата. Эта реакция обратима, поэтому для анализа активности фермента можно использовать как прямую, так и обратную реакцию.
Определение активности инвертазы проводили по методу, описанному в работе Ю. Е. Колупаева и др. [1989]. Навеску растительного материала 10г. Гомогенизировали на холоде в среде, содержащей 20мМ фосфатного буфера (рН 6,5), 1 мМ ЭДТА, 1 мМ дитиотреитола и 0,1 мМ метилфенилсуль-фонилфлюорида. Гомогенат выдерживали на холоде в течение 1 часа для полной экстракции фермента. Образцы центрифугировали в течении 20 мин. при 1500 g. В надосадочной жидкости определяли активность растворимого фермента.
Методы определения активности фосфорилазы основаны на определении изменения количества неорганического фосфора либо крахмала в реакционной смеси под влиянием фермента. Ход определения. Навеску 10 г молотого растительного материала тщательно растирают в фарфоровой ступке с песком или стеклом. Эту массу переносят в мерную колбу на 50 мл и настаивают в воде в течение 1–2 часов. Взвесь фильтруют и центрифугируют при 8000об./мин. При 4 С. Осветленный экстракт используют как ферментный препарат.
Результаты и их обсуждение. Как было показано в предыдущих разделах, под действием фторидов уменьшается содержание сахарозы в листьях и плодах и увеличивается содержание моносахаридов. Это может происходить из-за нарушения активности ферментов, участвующих в синтезе и гидролизе моносахаридов и сахарозы. Для проверки этого предположения мы исследовали активность ряда ферментов, участвующих в вышеуказанных реакциях. Результаты исследований активности фосфоглюкомутазы, сахарозосинтазы, инвертазы и фосфорилазы в листьях растений в 4 зонах представлены на рисунках 1, 2.
Как видно из этих рисунков, активность всех этих ферментов снижается пропорционально содержанию в листьях фторидов. Причем по устойчивости к фторидным загрязнениям активность ферментов в разных растениях разная. Как и в наших предыдущих экспериментах, наиболее устойчивы хлопчатник и кукуруза, наименее — дыня, арбуз, другие плодовые растение.
Большая устойчивость хлопчатника к фторидам, по сравнению с другими растениями, вероятно, связана с тем, что у хлопчатника содержатся в больших количествах эндогенные защитные вещества типа фенольных и сульфгидрильных соединений (Н.Норбаев 1984). Инвертаза катализирует расщепление сахарозы до глюкозы и фруктозы. Ингибирование инвертазы должно приводить к увеличению содержания сахарозы. Однако в наших экспериментах содержание сахарозы уменьшается пропорционально содержанию фторидов. Это противоречие можно объяснить тем, что, по-видимому, под действием фторидов снижается активность всех ферментов, включая и ответственных за синтез моносахаридов, и сахарозы.
Так как образовавшиеся в результате фотосинтеза моносахариды запасаются в основном в виде сахарозы, содержание сахарозы в растениях намного выше, чем моносахаридов. Если же синтез сахарозы из моносахаридов уменьшается, то несмотря даже на общее снижение синтеза моносахаридов их концентрация в растениях повышается. Это мы и наблюдаем в наших экспериментах. Т. е. несмотря на ингибирование фторидами ферментов, ответственных за синтез моносахаридов их концентрация под действием фторидов несколько повышается.
Чтобы убедиться, что активность ферментов зависит именно от содержания фторидов. были поставлены эксперименты, в которых семена растений проращивали и выращивали проростки в течение 10 дней в малых вегетационных сосудах при условии наличия в поливной воде различных концентраций фтористого натрия: 0,0001 %, 0,001 %, и 0,01 %. Затем в листьях определяли активность вышеуказанных ферментов.
Как показано на рисунках 3. активность всех исследованных ферментов понижается пропорционально содержанию в поливной воде фторида натрия.
Таким образом, в наших экспериментах твердо доказано, что изменение содержания углеводов в растениях, растущих в зоне Таджикского алюминиевого завода связано с ингибированием активности ряда ферментов, принимающих участие в углеводном обмене за счет увеличения содержания в растениях фторидов.
Выводы
Изменение содержания углеводов в растениях, растущих в зоне Таджикского алюминиевого завода связано с ингибированием активности ряда ферментов, принимающих участие в углеводном обмене за счет увеличения содержания в растениях фторидов
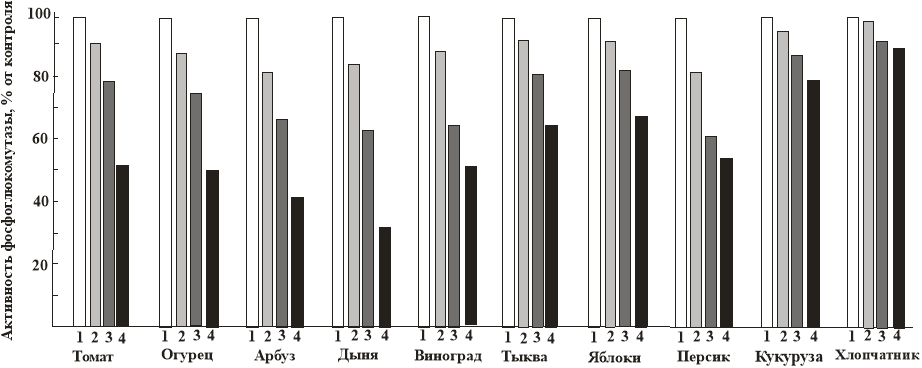
Рис.1. Активность фосфоглюкомутазы в листьях некоторых растений в: 1 — экологически чистой зоне, 2 — в зоне с содержанием фторидов 100 мг/кг, 3 — в зоне с содержанием фторидов 150–200 мг/кг, 4 — в зоне с содержанием фторидов 250–300 мг/кг.
Представлены средние значения из 4 экспериментов. Стандартное отклонение в пересчете на проценты не превышает 1,5 %
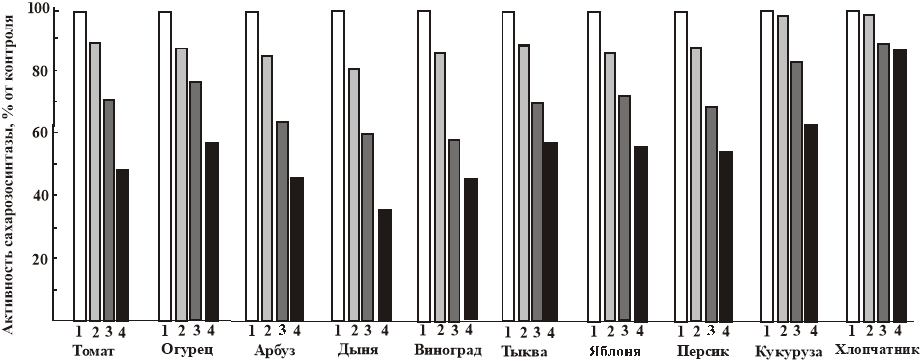 Рис.2. Активность сахарозосинтазы в листьях некоторых растений в: 1 — экологически чистой зоне, 2 — в зоне с содержанием фторидов 100 мг/кг, 3 — в зоне с содержанием фторидов 150–200 мг/кг, 4 — в зоне с содержанием фторидов 250–300 мг/кг.
Рис.2. Активность сахарозосинтазы в листьях некоторых растений в: 1 — экологически чистой зоне, 2 — в зоне с содержанием фторидов 100 мг/кг, 3 — в зоне с содержанием фторидов 150–200 мг/кг, 4 — в зоне с содержанием фторидов 250–300 мг/кг.
Представлены средние значения из 4 экспериментов. Стандартное отклонение в пересчете на проценты не превышает 1,5 %.
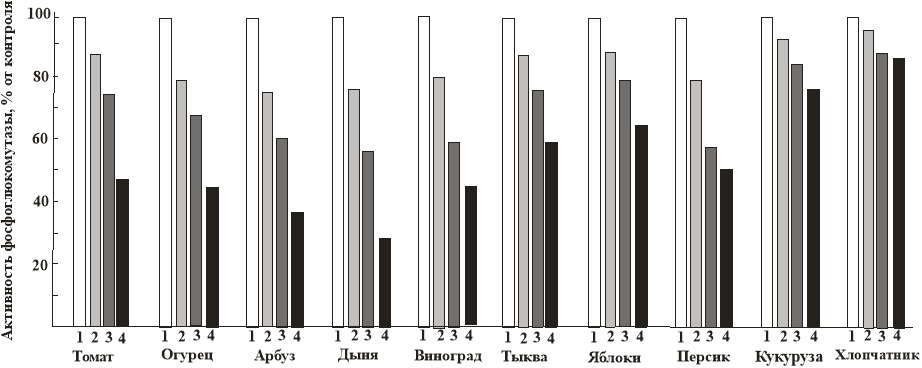
Рис. 3. Активность фосфоглюкомутазы в листьях некоторых растений, проращиваемых в присутствии в поливной воде: 1–0,2–0,0001 %, 3–0,001 %, и 4–0,01 % NaF.
Представлены средние значения из 4 экспериментов. Стандартное отклонение в пересчете на проценты не превышает 1,5 %.
Литература:
- Даффус К., Даффус Дж. Углеводный обмен растений. — Перевод с английского. Москва.: ВО «Агропромиздат», 1987–176с
- Ленинджер А. Биохимия, М: Мир, 1974г. — 957 с
- Норбаев Н. Биофизическая радиоэкология. — Ташкент: “Фан”, 1984. -174c.
- Северин С. Е., Соловьёва Г. А. Практикум по биохимии.//Москва: Из-во МГУю 1989. — 509 с.
- Колупаев Ю. Е., Сысоев Л. А., Манойло Т. А., Костенко И. В. О возможных механизмах изменения активности инвертазы калеоптилей пшеницы при холодовом закаливании. //Физиология и биохимия культурных растений.- Киев, 1989, — т.20, № 6, — С. 560–566.
- Шебалова Н. М.Активность ферментов как показатель состояния лесорастительных свойств почв, расположенных в зонах техногенного загрязнения. // Аграрный вестник Урала. 2009. — № 3 — С.57.

